《电解池》课件
图片预览



文档简介
课件22张PPT。小结2:电解电极方程式的书写 阴极不看材料,只看阳离子Ag+ > Fe3+ > Cu2+ > H+ > Pb2+ > Sn2+ > Fe2+ > Zn2+
> H+> Al3+ > Mg2+ > Na+ > Ca+ > K+小结1: 电解池的阴阳极判断方法.(串并连电路中?)注意:电解总反应不等于两电极反应简单相加
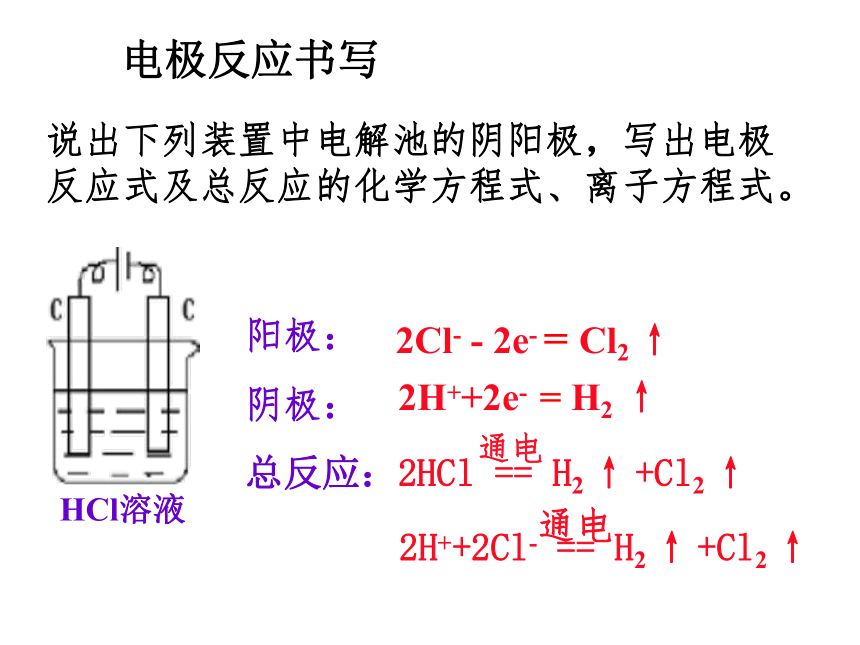
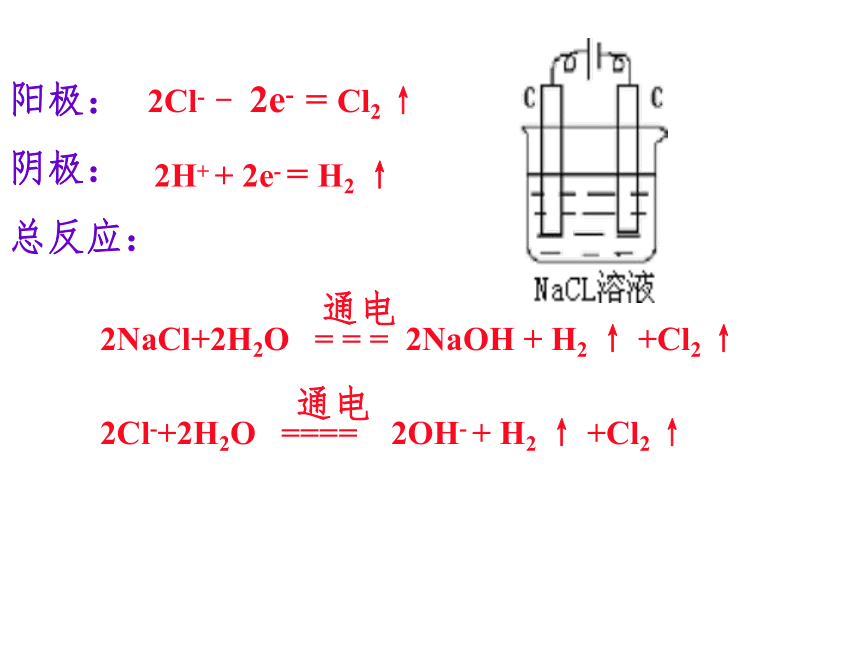
因水不能拆!说出下列装置中电解池的阴阳极,写出电极反应式及总反应的化学方程式、离子方程式。阳极:
阴极:
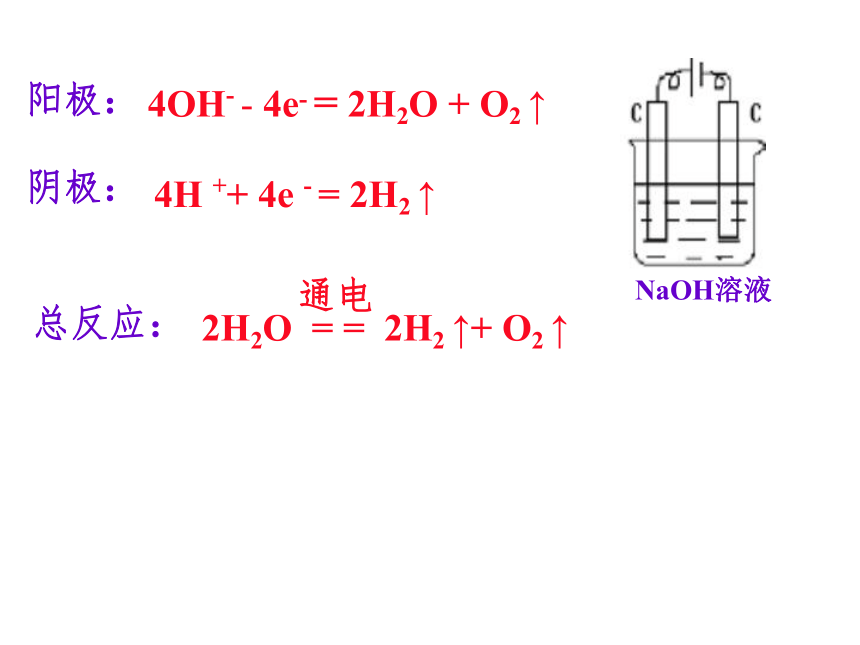
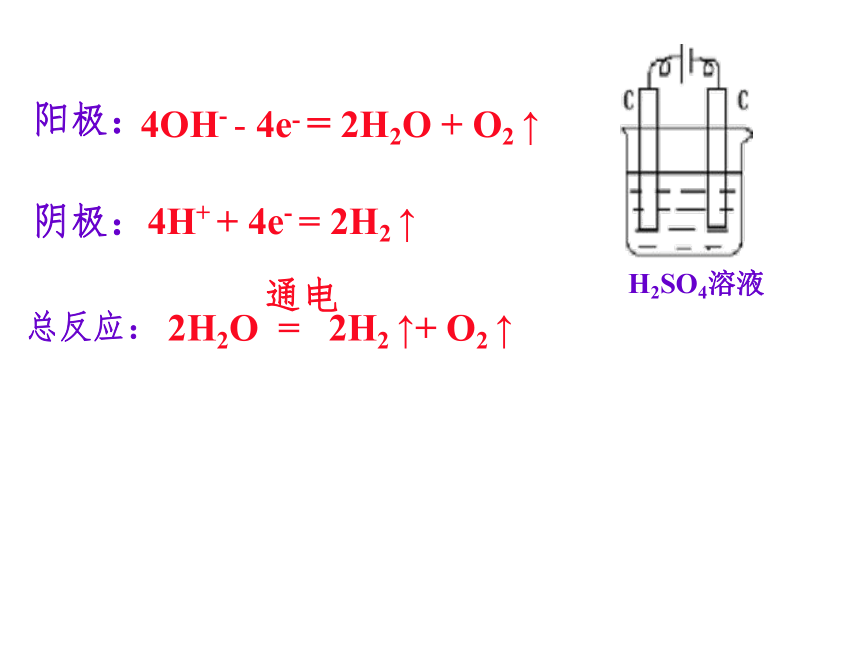
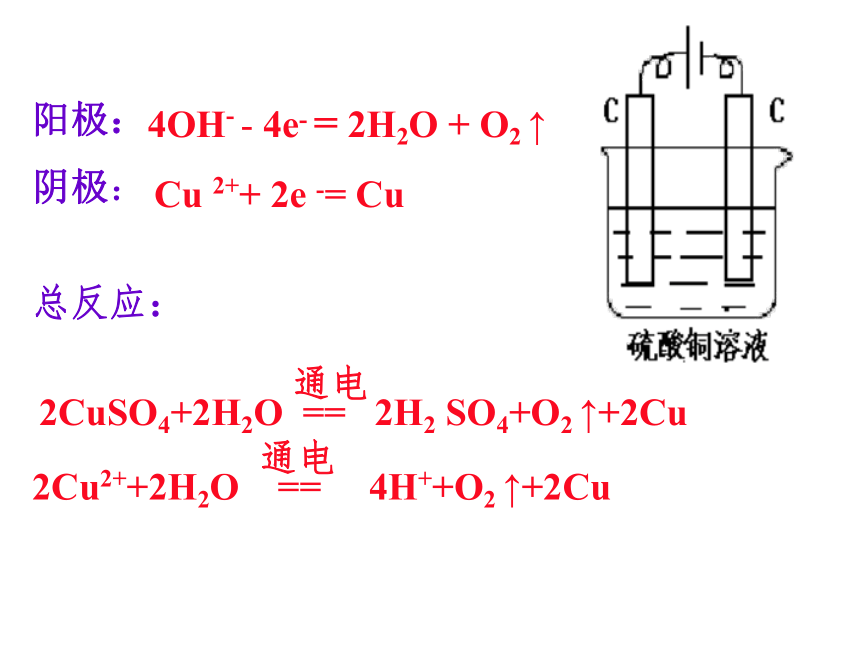
总反应:2Cl- - 2e- = Cl2 ↑2H++2e- = H2 ↑电极反应书写HCl溶液4H ++ 4e - = 2H2 ↑NaOH溶液阳极:阴极:总反应:4OH- - 4e- = 2H2O + O2 ↑阳极:阴极:4H+ + 4e- = 2H2 ↑H2SO4溶液总反应:4OH- - 4e- = 2H2O + O2 ↑阳极:4OH- - 4e- = 2H2O + O2 ↑阴极:Cu 2++ 2e -= Cu总反应:阳极:
阴极:
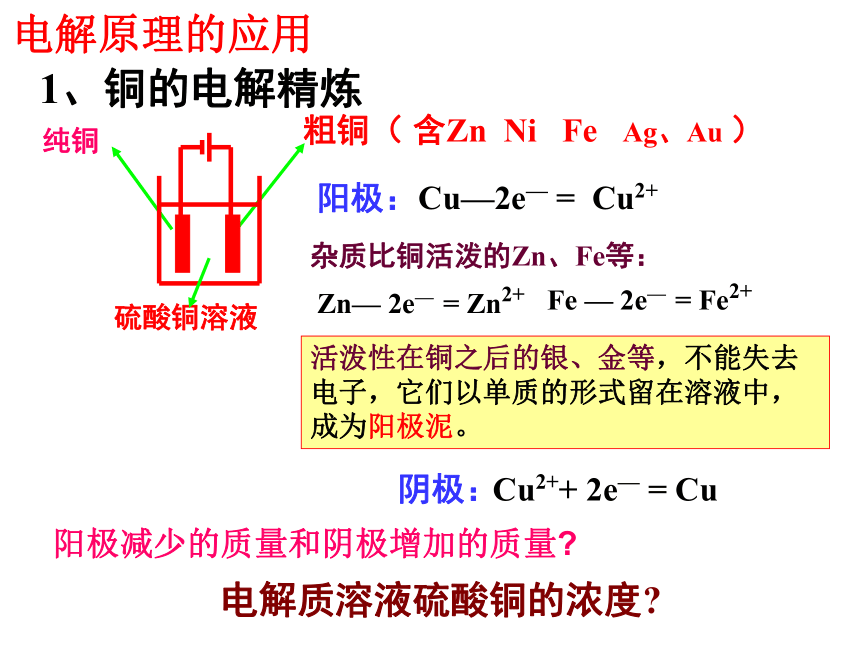
总反应:2Cl- - 2e- = Cl2 ↑2H+ + 2e- = H2 ↑1、铜的电解精炼硫酸铜溶液粗铜( 含Zn Ni Fe Ag、Au )纯铜阳极:Cu—2e— = Cu2+阴极:Cu2++ 2e— = Cu 杂质比铜活泼的Zn、Fe等: Zn— 2e— = Zn2+Fe — 2e— = Fe2+活泼性在铜之后的银、金等,不能失去电子,它们以单质的形式留在溶液中,成为阳极泥。电解质溶液硫酸铜的浓度?电解原理的应用阳极减少的质量和阴极增加的质量? 铜的电解精炼
一般火法冶炼得到的粗铜中含有多种杂质(如锌、铁、镍、银、金等),这种粗铜的导电性远不能满足电气工业的要求,如果用以制电线,就会大大降低电线的导电能力。因此必须利用电解的方法精炼粗铜。粗铜 含杂质(Zn Fe Ni Ag Au 等)纯铜粗铜阳极: Zn→ Zn2++2e-
Fe → Fe2++2e-
Ni → Ni2++2e-
Cu→ Cu2++2e-
Zn Fe Ni
CuAg Au
阴极: Cu2+ + 2e- → Cu阳极泥问:电解完后,CuSO4溶液的浓度有何变化?CuSO4溶液2、电镀1、定义:利用电解原理在某些金属的表面镀上一薄层其它金属或是合金的过程。2、装置铜镀件硫酸铜溶液阳极:Cu—2e— = Cu2+阴极:Cu2++ 2e— = Cu 4、电镀的结果: 电镀液的组成及酸碱性保持不变
3、电镀材料的选择:阴极——镀件
电镀液——含有镀层金属离子的溶液阳极——镀层金属
工业上利用这一反应,制取烧碱、氯气和氢气。 3.电解原理的应用--氯碱工业想一想:在左面的电解
饱和食盐水的实验中,
电解产物之间可能发生
哪些化学反应 ?总化学方程式: ;
总离子方程式: .
(3)电解前向溶液中滴加酚酞,通电后现象为:
___________ ,两极极板上都有气体产生,如何检验气体的种类?
阴极附近的溶液无色变为红色阳极:把湿润的碘化钾淀粉试纸放在阳极 附近,产生气体可以使湿润KI淀粉试 纸变蓝色.
(2)避免生成物H2和Cl2混合,
因为: .
(1)避免Cl2接触NaOH溶液会反应,使产品不纯,
反应方程式: .第一个问题:
Cl2 +2 NaOH =NaCl + NaClO + H2O混合遇火或遇强光爆炸解决方法:使用离子交换膜电解饱和食盐水必须解决两个主要问题:Cl2Cl2Cl—H2H+OH—淡盐水NaOH溶液精制饱和NaCl溶液H2O(含少量NaOH)离子交换膜阳极室阴极室4.电解原理的应用--电冶金(1)制取金属钠电解熔融氯化钠阳极:2Cl - - 2e- = Cl2↑阴极:2Na+ + 2e- = 2Na总反应:(2)制取金属铝电解熔融氧化铝阳极:6O2- - 12e- = 3O2↑阴极:4Al3+ + 12e- = 4Al总反应: 通电注意:反应过程中使用冰晶石(Na3AlF6)作为
熔剂,使Al2O3在较低的温度下熔化2Al2O3 == 4Al + 3O2↑冶炼铝设备图烟罩活泼金属的制备特别活泼的金属钠、镁、铝等只能通过电解的方法制取为下图所示装置中,a、b都是惰性电极,通电一段
时间后,b极附近溶液呈红色。下列说法正确的是
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的PH值逐渐减小
D.CuSO4溶液的PH值不变
AC 练 习O2~2Cu~4Ag~4H+~2H2~2Cl2~4OH-计算关系式:例二 : 用石墨电极电解100mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24L(标况)气体,则原混合液中Cu2+的物质的量浓度为( )
A.1mol/L B.2mol/L C.3mol/L D.4mol/LA阳极O2为0.1mol,电子为0.4mol则H2为0.1mol,所以Cu为0.1mol,浓度为A经典属于什么电池1经典例题121.甲为 池,乙为 池。
2.甲池中锌极为 极,铜极为 极。
乙中C1为 极,C2为 极。
3.Zn的电极反应 ,Cu的电极反应 C1电极反应 ,C2的电极反应 ,乙中的总反应
4.在甲中SO42-向 移动,在乙中SO42-向 移动.
5.甲中电子的流动方向:原电池电解池负极正极阳极阴极Zn-2e-=Zn2+Cu2++2e-=Cu 4OH--4e-=O2↑+2H2O Cu2++2e-=Cu负极阳极由Zn电极流出,通过导线最终流回Cu电极经典什么池2原电池电解池负极正极阳极阴极经典例题6.若在乙池中滴入少量的石蕊,则电解一段时间后, 电解电极 附近红色深,乙池电解后的PH
7.若在乙池中生成标准状况下的2.24L气体,则甲池中Zn电极的质量减少 g.
8.如何将乙池变成粗铜的精炼装置
9.如果甲池中Zn换成Fe电极,Cu换成C极,CuSO4溶液换成NaCl溶液,则发生的是铁的 腐蚀.
12C1减小13 C1换成粗铜,
C2换成纯铜吸氧
> H+> Al3+ > Mg2+ > Na+ > Ca+ > K+小结1: 电解池的阴阳极判断方法.(串并连电路中?)注意:电解总反应不等于两电极反应简单相加
因水不能拆!说出下列装置中电解池的阴阳极,写出电极反应式及总反应的化学方程式、离子方程式。阳极:
阴极:
总反应:2Cl- - 2e- = Cl2 ↑2H++2e- = H2 ↑电极反应书写HCl溶液4H ++ 4e - = 2H2 ↑NaOH溶液阳极:阴极:总反应:4OH- - 4e- = 2H2O + O2 ↑阳极:阴极:4H+ + 4e- = 2H2 ↑H2SO4溶液总反应:4OH- - 4e- = 2H2O + O2 ↑阳极:4OH- - 4e- = 2H2O + O2 ↑阴极:Cu 2++ 2e -= Cu总反应:阳极:
阴极:
总反应:2Cl- - 2e- = Cl2 ↑2H+ + 2e- = H2 ↑1、铜的电解精炼硫酸铜溶液粗铜( 含Zn Ni Fe Ag、Au )纯铜阳极:Cu—2e— = Cu2+阴极:Cu2++ 2e— = Cu 杂质比铜活泼的Zn、Fe等: Zn— 2e— = Zn2+Fe — 2e— = Fe2+活泼性在铜之后的银、金等,不能失去电子,它们以单质的形式留在溶液中,成为阳极泥。电解质溶液硫酸铜的浓度?电解原理的应用阳极减少的质量和阴极增加的质量? 铜的电解精炼
一般火法冶炼得到的粗铜中含有多种杂质(如锌、铁、镍、银、金等),这种粗铜的导电性远不能满足电气工业的要求,如果用以制电线,就会大大降低电线的导电能力。因此必须利用电解的方法精炼粗铜。粗铜 含杂质(Zn Fe Ni Ag Au 等)纯铜粗铜阳极: Zn→ Zn2++2e-
Fe → Fe2++2e-
Ni → Ni2++2e-
Cu→ Cu2++2e-
Zn Fe Ni
CuAg Au
阴极: Cu2+ + 2e- → Cu阳极泥问:电解完后,CuSO4溶液的浓度有何变化?CuSO4溶液2、电镀1、定义:利用电解原理在某些金属的表面镀上一薄层其它金属或是合金的过程。2、装置铜镀件硫酸铜溶液阳极:Cu—2e— = Cu2+阴极:Cu2++ 2e— = Cu 4、电镀的结果: 电镀液的组成及酸碱性保持不变
3、电镀材料的选择:阴极——镀件
电镀液——含有镀层金属离子的溶液阳极——镀层金属
工业上利用这一反应,制取烧碱、氯气和氢气。 3.电解原理的应用--氯碱工业想一想:在左面的电解
饱和食盐水的实验中,
电解产物之间可能发生
哪些化学反应 ?总化学方程式: ;
总离子方程式: .
(3)电解前向溶液中滴加酚酞,通电后现象为:
___________ ,两极极板上都有气体产生,如何检验气体的种类?
阴极附近的溶液无色变为红色阳极:把湿润的碘化钾淀粉试纸放在阳极 附近,产生气体可以使湿润KI淀粉试 纸变蓝色.
(2)避免生成物H2和Cl2混合,
因为: .
(1)避免Cl2接触NaOH溶液会反应,使产品不纯,
反应方程式: .第一个问题:
Cl2 +2 NaOH =NaCl + NaClO + H2O混合遇火或遇强光爆炸解决方法:使用离子交换膜电解饱和食盐水必须解决两个主要问题:Cl2Cl2Cl—H2H+OH—淡盐水NaOH溶液精制饱和NaCl溶液H2O(含少量NaOH)离子交换膜阳极室阴极室4.电解原理的应用--电冶金(1)制取金属钠电解熔融氯化钠阳极:2Cl - - 2e- = Cl2↑阴极:2Na+ + 2e- = 2Na总反应:(2)制取金属铝电解熔融氧化铝阳极:6O2- - 12e- = 3O2↑阴极:4Al3+ + 12e- = 4Al总反应: 通电注意:反应过程中使用冰晶石(Na3AlF6)作为
熔剂,使Al2O3在较低的温度下熔化2Al2O3 == 4Al + 3O2↑冶炼铝设备图烟罩活泼金属的制备特别活泼的金属钠、镁、铝等只能通过电解的方法制取为下图所示装置中,a、b都是惰性电极,通电一段
时间后,b极附近溶液呈红色。下列说法正确的是
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的PH值逐渐减小
D.CuSO4溶液的PH值不变
AC 练 习O2~2Cu~4Ag~4H+~2H2~2Cl2~4OH-计算关系式:例二 : 用石墨电极电解100mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24L(标况)气体,则原混合液中Cu2+的物质的量浓度为( )
A.1mol/L B.2mol/L C.3mol/L D.4mol/LA阳极O2为0.1mol,电子为0.4mol则H2为0.1mol,所以Cu为0.1mol,浓度为A经典属于什么电池1经典例题121.甲为 池,乙为 池。
2.甲池中锌极为 极,铜极为 极。
乙中C1为 极,C2为 极。
3.Zn的电极反应 ,Cu的电极反应 C1电极反应 ,C2的电极反应 ,乙中的总反应
4.在甲中SO42-向 移动,在乙中SO42-向 移动.
5.甲中电子的流动方向:原电池电解池负极正极阳极阴极Zn-2e-=Zn2+Cu2++2e-=Cu 4OH--4e-=O2↑+2H2O Cu2++2e-=Cu负极阳极由Zn电极流出,通过导线最终流回Cu电极经典什么池2原电池电解池负极正极阳极阴极经典例题6.若在乙池中滴入少量的石蕊,则电解一段时间后, 电解电极 附近红色深,乙池电解后的PH
7.若在乙池中生成标准状况下的2.24L气体,则甲池中Zn电极的质量减少 g.
8.如何将乙池变成粗铜的精炼装置
9.如果甲池中Zn换成Fe电极,Cu换成C极,CuSO4溶液换成NaCl溶液,则发生的是铁的 腐蚀.
12C1减小13 C1换成粗铜,
C2换成纯铜吸氧
