《化学平衡的移动》
图片预览







文档简介
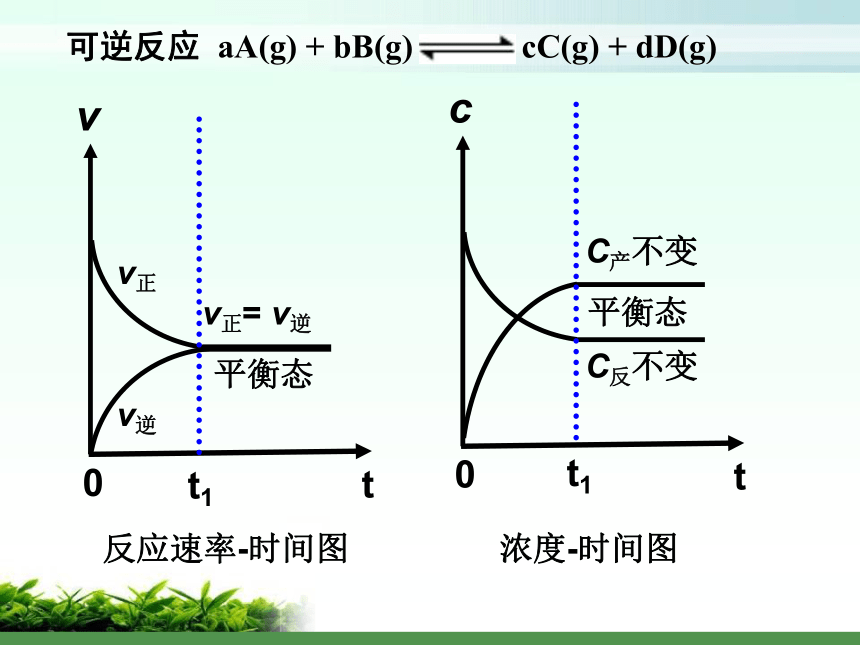
课件33张PPT。化学平衡的移动福州第三中学 卢晓平化学平衡的移动福州第三中学 卢晓平化学平衡的移动福州第三中学 卢晓平化学平衡的移动福州第三中学 卢晓平化学平衡的特征有哪些?动、等、定、变v正≠ v逆,
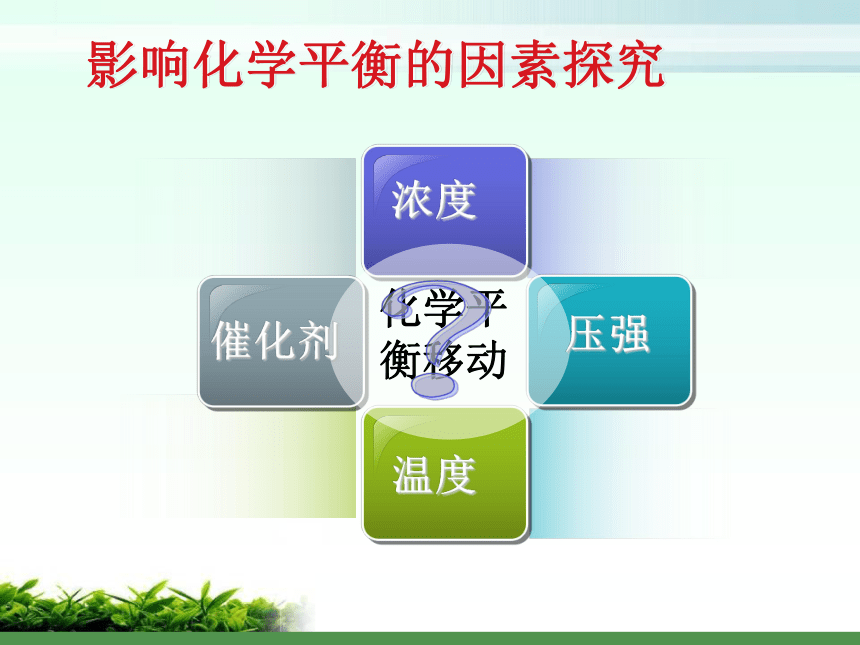
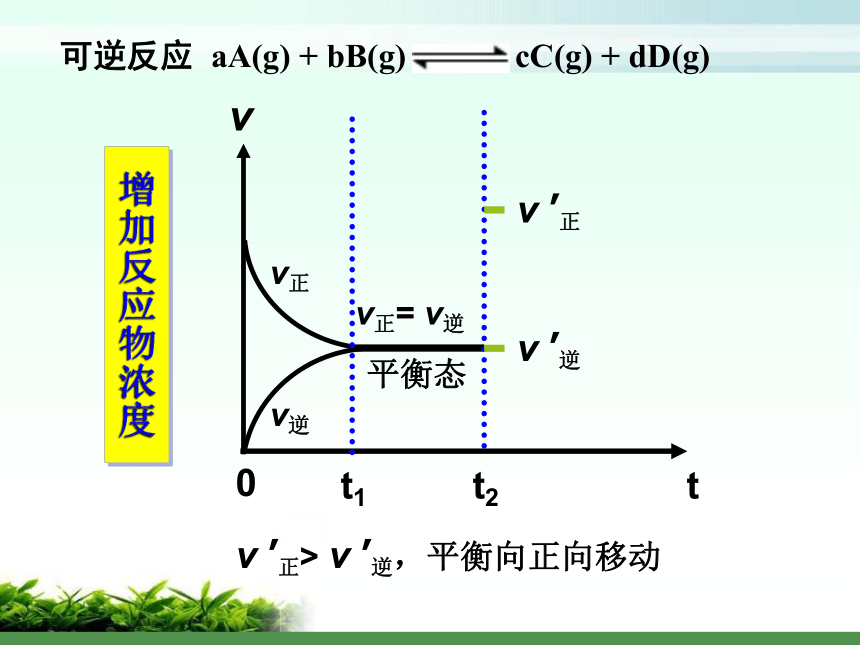
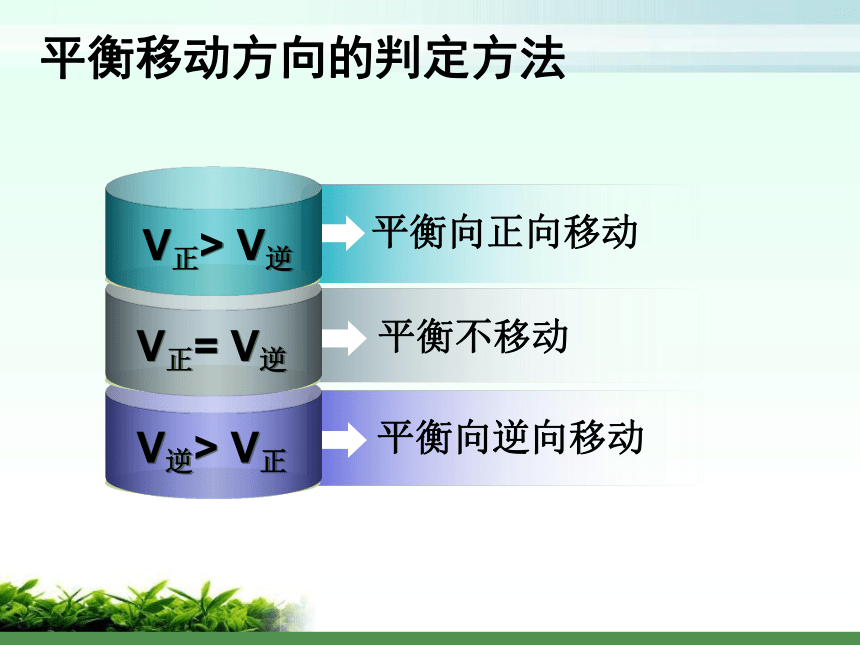
平衡发生移动影响化学平衡的因素探究?探究一:浓度对化学平衡的影响可供使用的药品: 1 mol/L 稀硝酸、1 mol/L NaOH溶液 0.1 mol/L 重铬酸钾溶液实验:平衡向正向移动增大反应物浓度或降低产物浓度平衡向逆向移动降低反应物浓度或增加产物浓度v正v逆 tv0t1增加反应物浓度v ’正> v ’逆,平衡向正向移动平衡移动方向的判定方法 V正> V逆V正= V逆 平衡向正向移动平衡不移动V逆> V正平衡向逆向移动原理初探:平衡常数与平衡移动 Q < K Q = K 平衡向正向移动平衡不移动 Q > K平衡向逆向移动平衡移动方向的判定方法二、温度对化学平衡的影响升高温度,平衡向逆向移动升高温度,平衡向正向移动结论及应用:大量实验研究表明,在其他条件不变的情况下,
升高温度,化学平衡向吸热反应方向移动;
降低温度,化学平衡向放热反应方向移动。v正= v逆v正v逆tv0 平衡态Ⅰv ’逆> v ’正,平衡向逆向移动。升高温度原理初探: 温度改变,平衡常数改变,平衡发生移动课堂小结:浓度:c(反)↑或c(产) ↓,平衡向正向移动
c(反)↓或c(产) ↑,平衡向逆向移动
2. 温度:T ↑ ,平衡向吸热方向移动
T ↓ ,平衡向放热方向移动学以致用:魔术解密课后思考:
压强、催化剂是否影响化学平衡?
如果会影响化学平衡,如何影响?
课后作业:
校本练习(18)三、压强对化学平衡的影响写出下列反应的平衡常数表达式。试分析:增大压强(体积压缩为原来一半),平衡移动的方向。 增大压强,平衡向逆向移动
增大压强,平衡向正向移动
增大压强,平衡不移动N2O4 (g) 2NO2 (g)
2. N2 (g) +3H2 (g) 2NH3 (g)
3. FeO(s) + CO(g) Fe(s)+CO2 (g)
结论:增大压强,缩小容器体积,
平衡向气体体积减小的方向移动;
减小压强,增大容器体积,
平衡向气体体积增大的方向移动;
气体体积不变的反应,改变压强,平衡不移动。
课堂小结:1. 浓度:c(反)↑或c(产) ↓,平衡向正向移动
c(反)↓或c(产) ↑,平衡向逆向移动
2. 温度:T ↑ ,平衡向吸热方向移动
T ↓ ,平衡向放热方向移动
3. 压强: P ↑ ,平衡向减体积方向移动
P ↓ ,平衡向增体积方向移动
等体积反应,P改变,平衡不移动课后思考:
催化剂是否影响化学平衡?
如果会影响化学平衡,如何影响?
课后作业:
校本练习(18)四、催化剂对化学平衡的影响 催化剂使反应活化能降低,反应速率提高。但正逆反应速率提高的幅度相同,平衡不移动。t2v正= v逆v正v逆t1 v(mol.L-1.S-1)0 平衡状态Ⅰv ’正= v ’逆,平衡不移动。加入催化剂原理初探:速率-时间关系图小结一、 浓度:C(反)↑或C(产)↓,→
C(反)↓或C(产)↑,←
二、 压强:P↑(V容↓), →减体积;
P↓ (V容↑), →增体积;
体积不变的反应, P改变,不移动
三、 温度:T↑, →吸热;
T↓, →放热
四、 催化剂:V正=V逆↑,不移动想一想:反应A(g)+3B(g) 2C(g) △H<0 达到平衡后,将体系温度降低,正反应速率 ,逆反应速率 ,(填 “增大” 、 “减小” 或 “不变” )平衡 移动,(填 “正向” 、 “逆向” 或 “不” )
反应Fe3+ (aq) + SCN-(aq) Fe(SCN) 2+ 在一定温度下达到平衡使,c (Fe3+ )=0.04 mol/L c(SCN-)=0.1 mol/L , c[Fe(SCN) 2+]=0.68 mol/L
(1)该反应的平衡常数K为多少?
(2)加入固体KSCN后,平衡向哪个方向移动? C改变,
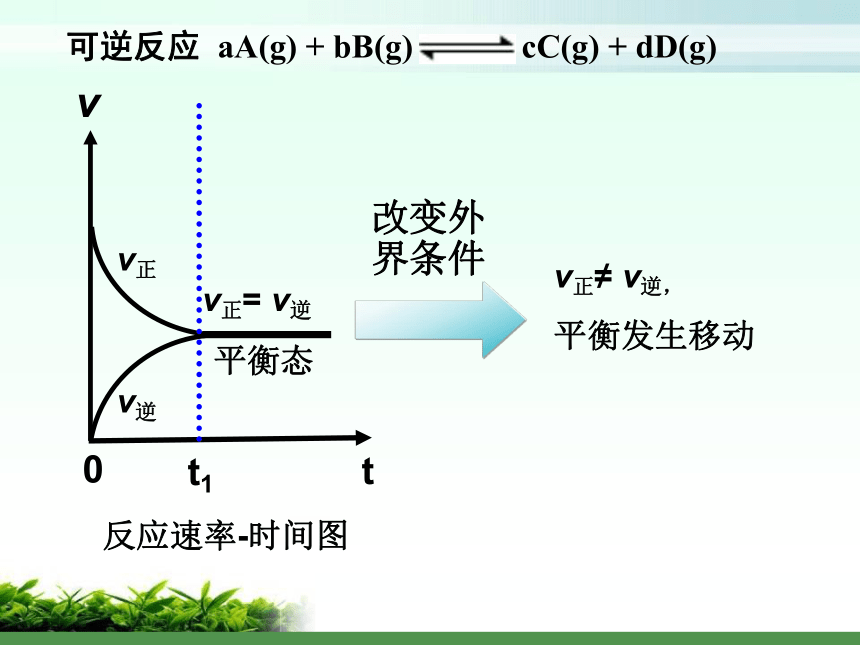
平衡发生移动改变外
界条件 K改变,
平衡发生移动
平衡发生移动影响化学平衡的因素探究?探究一:浓度对化学平衡的影响可供使用的药品: 1 mol/L 稀硝酸、1 mol/L NaOH溶液 0.1 mol/L 重铬酸钾溶液实验:平衡向正向移动增大反应物浓度或降低产物浓度平衡向逆向移动降低反应物浓度或增加产物浓度v正v逆 tv0t1增加反应物浓度v ’正> v ’逆,平衡向正向移动平衡移动方向的判定方法 V正> V逆V正= V逆 平衡向正向移动平衡不移动V逆> V正平衡向逆向移动原理初探:平衡常数与平衡移动 Q < K Q = K 平衡向正向移动平衡不移动 Q > K平衡向逆向移动平衡移动方向的判定方法二、温度对化学平衡的影响升高温度,平衡向逆向移动升高温度,平衡向正向移动结论及应用:大量实验研究表明,在其他条件不变的情况下,
升高温度,化学平衡向吸热反应方向移动;
降低温度,化学平衡向放热反应方向移动。v正= v逆v正v逆tv0 平衡态Ⅰv ’逆> v ’正,平衡向逆向移动。升高温度原理初探: 温度改变,平衡常数改变,平衡发生移动课堂小结:浓度:c(反)↑或c(产) ↓,平衡向正向移动
c(反)↓或c(产) ↑,平衡向逆向移动
2. 温度:T ↑ ,平衡向吸热方向移动
T ↓ ,平衡向放热方向移动学以致用:魔术解密课后思考:
压强、催化剂是否影响化学平衡?
如果会影响化学平衡,如何影响?
课后作业:
校本练习(18)三、压强对化学平衡的影响写出下列反应的平衡常数表达式。试分析:增大压强(体积压缩为原来一半),平衡移动的方向。 增大压强,平衡向逆向移动
增大压强,平衡向正向移动
增大压强,平衡不移动N2O4 (g) 2NO2 (g)
2. N2 (g) +3H2 (g) 2NH3 (g)
3. FeO(s) + CO(g) Fe(s)+CO2 (g)
结论:增大压强,缩小容器体积,
平衡向气体体积减小的方向移动;
减小压强,增大容器体积,
平衡向气体体积增大的方向移动;
气体体积不变的反应,改变压强,平衡不移动。
课堂小结:1. 浓度:c(反)↑或c(产) ↓,平衡向正向移动
c(反)↓或c(产) ↑,平衡向逆向移动
2. 温度:T ↑ ,平衡向吸热方向移动
T ↓ ,平衡向放热方向移动
3. 压强: P ↑ ,平衡向减体积方向移动
P ↓ ,平衡向增体积方向移动
等体积反应,P改变,平衡不移动课后思考:
催化剂是否影响化学平衡?
如果会影响化学平衡,如何影响?
课后作业:
校本练习(18)四、催化剂对化学平衡的影响 催化剂使反应活化能降低,反应速率提高。但正逆反应速率提高的幅度相同,平衡不移动。t2v正= v逆v正v逆t1 v(mol.L-1.S-1)0 平衡状态Ⅰv ’正= v ’逆,平衡不移动。加入催化剂原理初探:速率-时间关系图小结一、 浓度:C(反)↑或C(产)↓,→
C(反)↓或C(产)↑,←
二、 压强:P↑(V容↓), →减体积;
P↓ (V容↑), →增体积;
体积不变的反应, P改变,不移动
三、 温度:T↑, →吸热;
T↓, →放热
四、 催化剂:V正=V逆↑,不移动想一想:反应A(g)+3B(g) 2C(g) △H<0 达到平衡后,将体系温度降低,正反应速率 ,逆反应速率 ,(填 “增大” 、 “减小” 或 “不变” )平衡 移动,(填 “正向” 、 “逆向” 或 “不” )
反应Fe3+ (aq) + SCN-(aq) Fe(SCN) 2+ 在一定温度下达到平衡使,c (Fe3+ )=0.04 mol/L c(SCN-)=0.1 mol/L , c[Fe(SCN) 2+]=0.68 mol/L
(1)该反应的平衡常数K为多少?
(2)加入固体KSCN后,平衡向哪个方向移动? C改变,
平衡发生移动改变外
界条件 K改变,
平衡发生移动
