【湖南师大附中内部资料】高一化学必修2课件:1.1 元素周期表1(新人教版)
文档属性
| 名称 | 【湖南师大附中内部资料】高一化学必修2课件:1.1 元素周期表1(新人教版) |  | |
| 格式 | rar | ||
| 文件大小 | 708.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-04-20 10:10:00 | ||
图片预览





文档简介
课件49张PPT。 高一年级 化学必修2
第一章 物质结构 元素周期律第一节 元素周期表
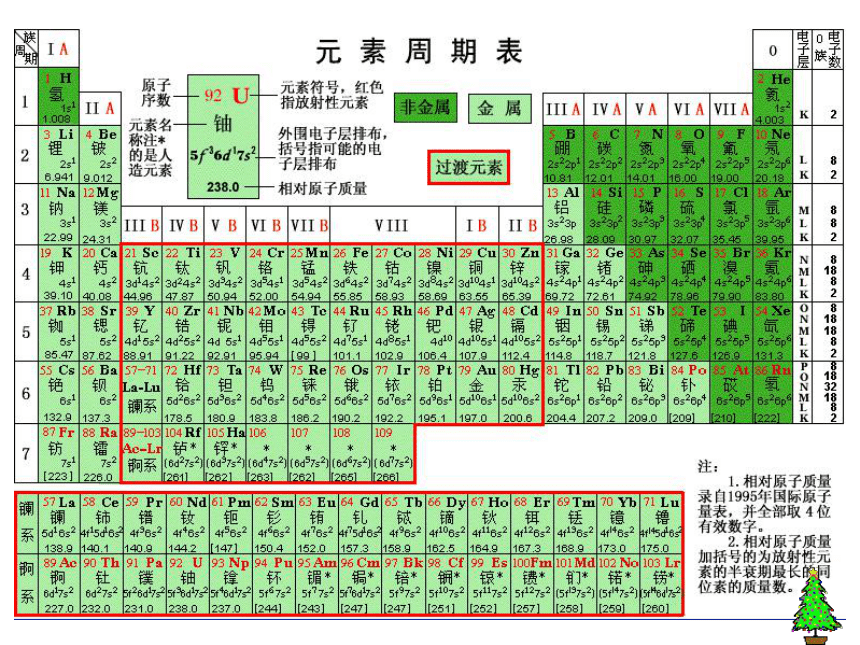
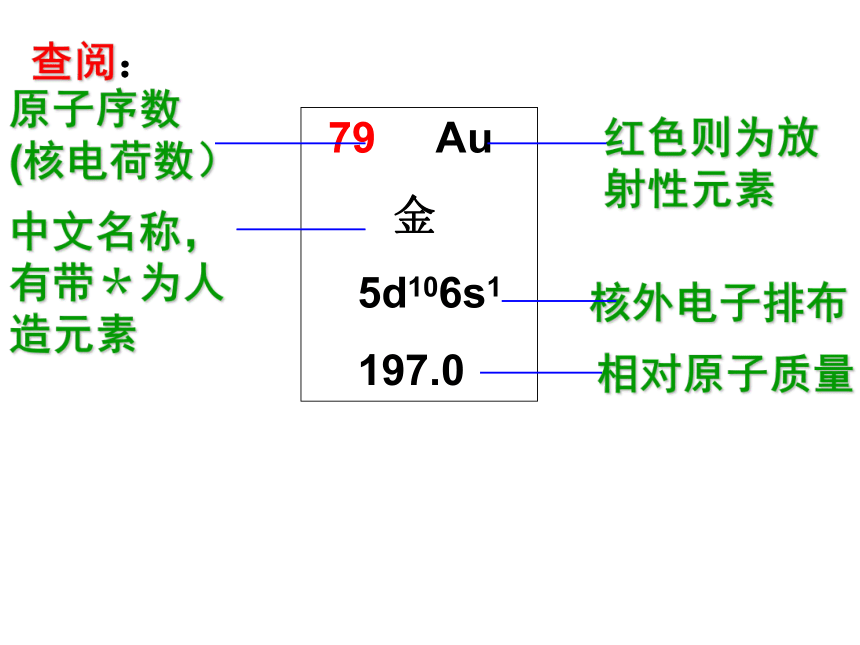
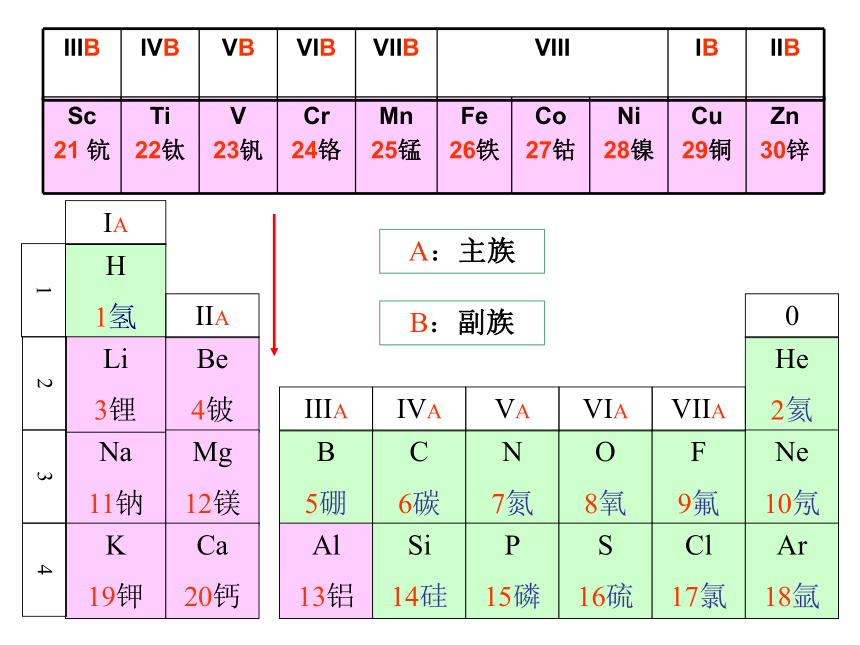
(第一课时)元素周期表的编排原则 根据元素周期律,把已知的一百多种元素中 的各种元素,按原子序数递增的顺序从左到右排成 ,再把不同横行中 的元素按电子层数递增的顺序由上而下排成 ,这样得到的一个表,叫做元素周期表。电子层数目相同横行最外层的电子数相同纵行查阅:
79 Au
金
5d106s1
197.0原子序数
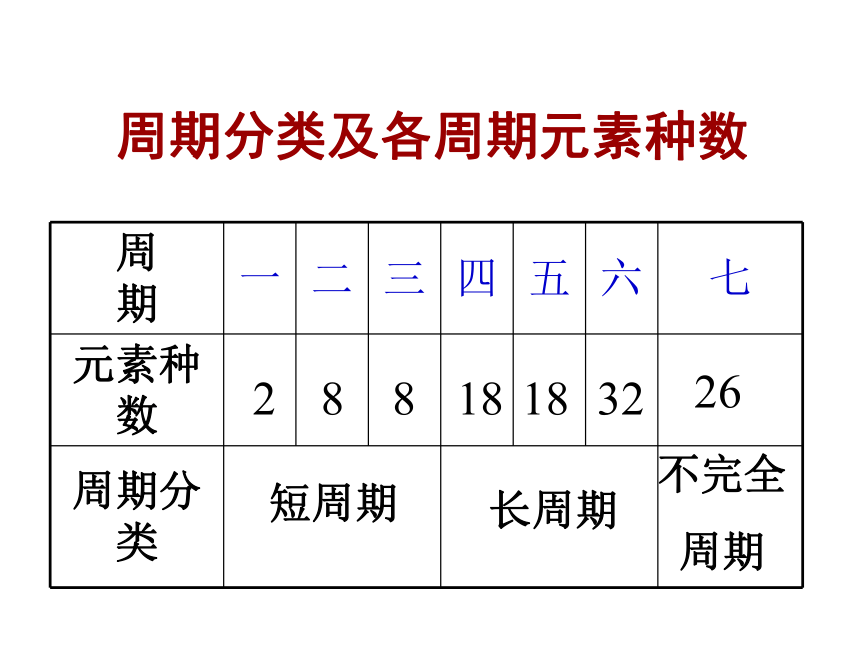
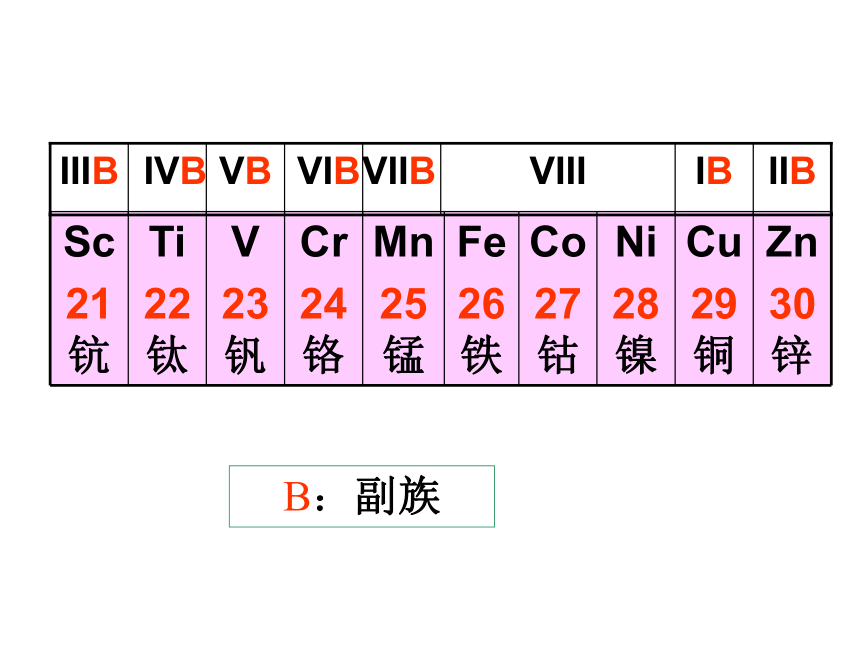
(核电荷数)红色则为放射性元素中文名称,有带*为人造元素核外电子排布相对原子质量一.元素周期表的结构(七横十八竖) 1.周期—横 具有相同的电子层数而又按照原子序数递增的顺序排列的一系列元素。周期分类及各周期元素种数28818183226不完全
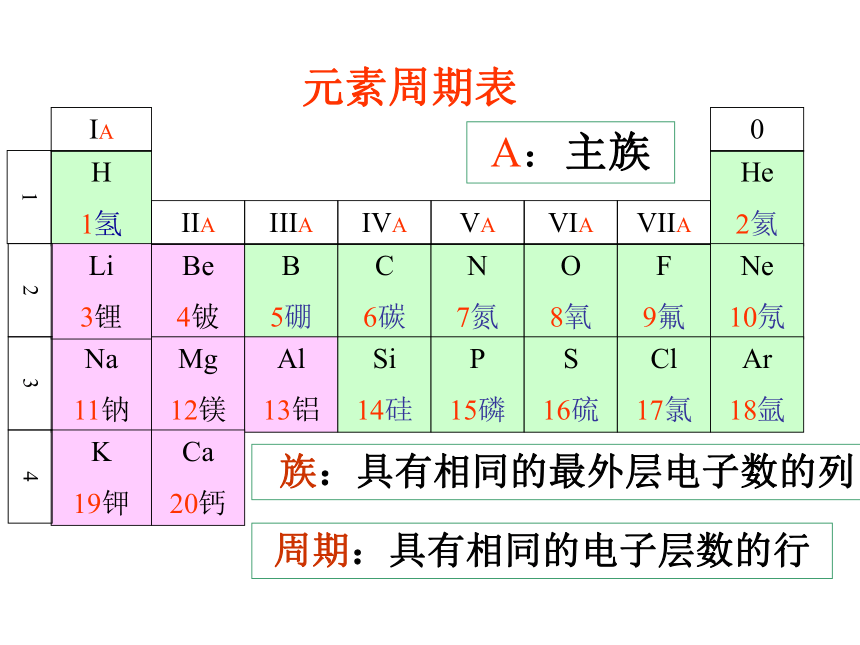
周期短周期长周期 具有相同的最外电子数,并按照电子层数递增的顺序排列的一系列元素。 2.族—竖IA~VIIA副族VIII族主族IB~VIIB
三个纵行
(8,9,10)零族惰性气体
元素族的分类族:具有相同的最外层电子数的列
IIBIBVIII
VIIB
VIB
VB
IVB
IIIB
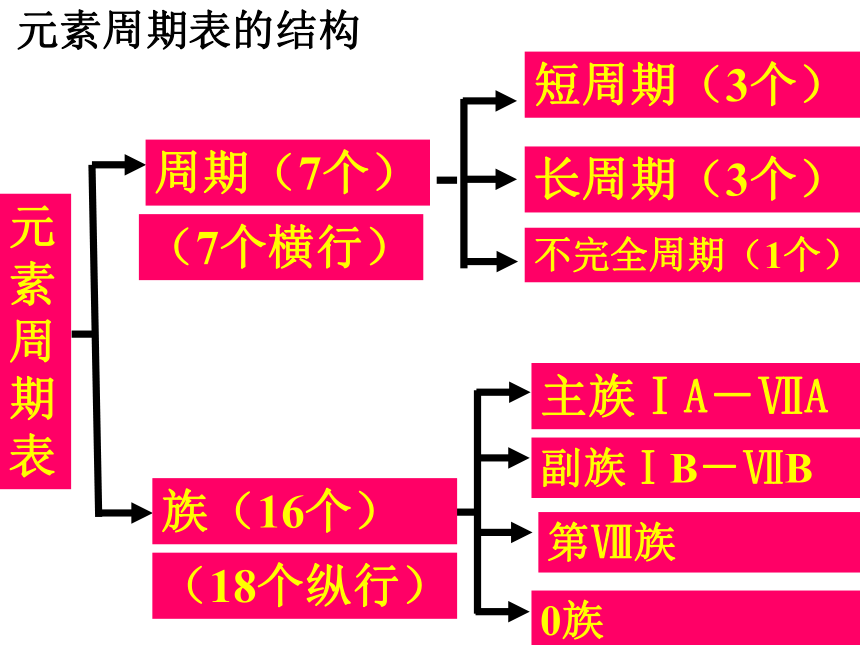
B:副族元素周期表的结构元素周期表长周期(3个) 短周期(3个) 不完全周期(1个) 0族 主族ⅠA-ⅦA 副族ⅠB-ⅦB 第Ⅷ族 周期(7个) 族(16个) (7个横行) (18个纵行) 元素周期表的结构元素周期表结构归纳:
七横十八竖
三长、三短、一不全;
七主、七副、八和零 (2)族:每一主族的元素最外层电子数相等,从上到下电子层数增加 。
主族序数=最外层电子数(1)周期:每一周期元素电子层数相同,从左到右原子序数递增。
周期序数=电子层数注意思考:Cl的位置的描述:第七主族VII族VIIA族第III周期第三周期第3周期第三周期VIIA族课堂练习1.已知某主族元素的原子结构示意图如下,判断其位于第几周期?第几族?X第三周期第IA族第五周期第VIIA族2.主族元素在周期表中的位置取决于该元素的( )
A. 相对原子质量和核外电子数
B. 电子层数和最外层电子数
C. 相对原子质量的最外层电子数
D. 电子层数的次外层电子数B二、元素周期表的应用
1.由原子序数推出元素在周期表中的位置:
1)原子序数少于18——熟记
2)原子序数多于18——
记住每周期最后一个元素的序号,当原子序数为n时,看落在哪两个序号之间,先推出n所在的周期,再推出其所在的族。 2881818322621018365486(118)3、推算原子序数为6、13、34、53、84的元素在周期表中的位置。23456IVAIIIAVIAVIIAVIA序差“左上右下”规律:元素周期表中上下相邻两元素的原子序数之差,取决于它们所在周期表中的位置,如果它们位于元素周期表ⅢB元素之左(或右),它们的原子序数之差就是上(或下)面的元素所在周期的元素种数。2.求元素周期表中上下相邻两元素的原子序数之差3、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)D4、下列各组中的元素用原子序数表示,其中都属于同一主族的一组元素是( )
(A)14、24、34
(B)26、31、35
(C)7、15、33
(D)11、17、18C族的别称 ⅠA称为 元素
ⅣA称为 元素
ⅤA称为 元素
ⅥA称为 元素
ⅦA称为 元素
零族称为 元素碱金属碳族氮族氧族卤族稀有气体二、元素周期表中的规律原子核外电子排布的周期性变化元素原子半径的周期性变化元素金属性和非金属性的递变非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强元素气态氢化物的热稳定性热稳定性逐渐增强热稳定性逐渐减弱热稳定性逐渐减弱热稳定性逐渐增强元素最高价氧化物对应水化物的酸碱性酸性逐渐增强碱性逐渐增强碱性逐渐增强酸性逐渐增强
1、镭是周期表中第七周期第ⅡA的元素,下列关于镭性质的描述中不正确的是( )
A、 在化合物中呈+2价
B、 碳酸盐难溶于水
C、 单质使水分解,放出氧气
D、 氢氧化物呈强碱性
C返回四、检测题2、A、B、C、D、E是周期表中同周期的五种主族元素, A、B的最高价氧化物的水化物都呈碱性,且碱性B﹥ A, C的气态氢化物的稳定性比D强, E是五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序为( )
A、ABCDE B、CDABE
C、 BADCE D、ECDBA返回C3、已知短周期元素
X、 Y 、Z在周期
表中的位置如右图
则它们分别是什么
元素?返回 X是氦 、Y是 氟、Z是硫。4、假设X为第ⅡA某元素的原子序数,那么同周期的第ⅢA元素的原子序数不可能为( )
A、 X +1 B、 X +11
C、 X +25 D、 X+8
返回D5、已知某主族元素的原子结构示意图,判断其在周期表中的位置第三周期ⅦA族第四周期ⅠA族返回6、某元素原子的最外层有两个电子,则有关该元素的说法正确的是( )
A、 一定是第 ⅡA 元素
B、 一定是金属元素
C、 最高价一定为+2价
D、 可能是金属元素,也可能不是金属元素D返回7、下列各种性质的比较正确的是 ( )
① 酸性:HClO4﹥ HBrO4
② 碱性: Mg(OH)2﹥Ba(OH)2
③ 非金属性: N﹤F
④ 还原性: Cl -﹤S2-
A、 ① ③ ④ B、 ① ②④
C、 ② ③ ④ D、 ① ② ③ ④A返回8、同周期的X、Y、Z三种元素已知它们的最高价氧化物的水化物是HXO4 、H2YO4、H3ZO4,则这三种元素气态氢化物的稳定性由强到弱的顺序是 。返回X ﹥ Y ﹥ Z研究性学习课题:
元素周期表的发展历程和未来展望三种不同的氢原子原子符号质子数中子数氢原子名称1H12H13H1101112氕 (H)氘 (D)氚 (T)三、同位素O : 8O 8O 8O
C : 6C 6C 6C
U : 92U 92U 92U
Cl : 17Cl 17Cl1617181213142342352363537核素同位素1.下列叙述正确的是( )A. 氢有三种同位素,即有三种氢原子.
B. 所有元素的原子核均由质子和中子构成.
C. 具有相同的核外电子数的粒子,总称为元素.
D. 1H是一种同位素3A2. 以下互为同位素的是( )
A. 金刚石和石墨
B. D2和H2
C. CO和CO2
D. 17Cl和17Cl3537D(1) 和 互为同位素.
(2) 和 质量数相等,但不能互称同位素.
(3) 和 中子数相等,但质子数不相等,所以不是同一种元素.3Li 7N 11Na 12Mg
6C 3Li24元素的相对原子质量
原子的相对原子质量(一种元素可以有多种原子)区分 17Cl 34.969 75.77%
17Cl 36.966 24.23%1.在元素周期表中查得到的相对原子质量是( )A.元素原子的平均质量
B.元素原子的相对质量
C.元素一个原子质量与碳-12原子质量1/12的比值
D.元素原子的平均质量与碳-12原子质量1/12的比值课堂练习D2. 92号元素U有三种核素,其中一种是U-235,关于U-235的说法正确的是( )A.它是一种新元素
B.核内有235个质子
C.它是U-236的一种同位素
D.该元素的相对原子质量是235课堂练习 C3.铜有两种天然同位素29Cu和29Cu,已知铜的相对原子质量是63.5,则29Cu的物质的量分数是多少?它的质量分数是多少?636563课堂练习
第一章 物质结构 元素周期律第一节 元素周期表
(第一课时)元素周期表的编排原则 根据元素周期律,把已知的一百多种元素中 的各种元素,按原子序数递增的顺序从左到右排成 ,再把不同横行中 的元素按电子层数递增的顺序由上而下排成 ,这样得到的一个表,叫做元素周期表。电子层数目相同横行最外层的电子数相同纵行查阅:
79 Au
金
5d106s1
197.0原子序数
(核电荷数)红色则为放射性元素中文名称,有带*为人造元素核外电子排布相对原子质量一.元素周期表的结构(七横十八竖) 1.周期—横 具有相同的电子层数而又按照原子序数递增的顺序排列的一系列元素。周期分类及各周期元素种数28818183226不完全
周期短周期长周期 具有相同的最外电子数,并按照电子层数递增的顺序排列的一系列元素。 2.族—竖IA~VIIA副族VIII族主族IB~VIIB
三个纵行
(8,9,10)零族惰性气体
元素族的分类族:具有相同的最外层电子数的列
IIBIBVIII
VIIB
VIB
VB
IVB
IIIB
B:副族元素周期表的结构元素周期表长周期(3个) 短周期(3个) 不完全周期(1个) 0族 主族ⅠA-ⅦA 副族ⅠB-ⅦB 第Ⅷ族 周期(7个) 族(16个) (7个横行) (18个纵行) 元素周期表的结构元素周期表结构归纳:
七横十八竖
三长、三短、一不全;
七主、七副、八和零 (2)族:每一主族的元素最外层电子数相等,从上到下电子层数增加 。
主族序数=最外层电子数(1)周期:每一周期元素电子层数相同,从左到右原子序数递增。
周期序数=电子层数注意思考:Cl的位置的描述:第七主族VII族VIIA族第III周期第三周期第3周期第三周期VIIA族课堂练习1.已知某主族元素的原子结构示意图如下,判断其位于第几周期?第几族?X第三周期第IA族第五周期第VIIA族2.主族元素在周期表中的位置取决于该元素的( )
A. 相对原子质量和核外电子数
B. 电子层数和最外层电子数
C. 相对原子质量的最外层电子数
D. 电子层数的次外层电子数B二、元素周期表的应用
1.由原子序数推出元素在周期表中的位置:
1)原子序数少于18——熟记
2)原子序数多于18——
记住每周期最后一个元素的序号,当原子序数为n时,看落在哪两个序号之间,先推出n所在的周期,再推出其所在的族。 2881818322621018365486(118)3、推算原子序数为6、13、34、53、84的元素在周期表中的位置。23456IVAIIIAVIAVIIAVIA序差“左上右下”规律:元素周期表中上下相邻两元素的原子序数之差,取决于它们所在周期表中的位置,如果它们位于元素周期表ⅢB元素之左(或右),它们的原子序数之差就是上(或下)面的元素所在周期的元素种数。2.求元素周期表中上下相邻两元素的原子序数之差3、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)D4、下列各组中的元素用原子序数表示,其中都属于同一主族的一组元素是( )
(A)14、24、34
(B)26、31、35
(C)7、15、33
(D)11、17、18C族的别称 ⅠA称为 元素
ⅣA称为 元素
ⅤA称为 元素
ⅥA称为 元素
ⅦA称为 元素
零族称为 元素碱金属碳族氮族氧族卤族稀有气体二、元素周期表中的规律原子核外电子排布的周期性变化元素原子半径的周期性变化元素金属性和非金属性的递变非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强元素气态氢化物的热稳定性热稳定性逐渐增强热稳定性逐渐减弱热稳定性逐渐减弱热稳定性逐渐增强元素最高价氧化物对应水化物的酸碱性酸性逐渐增强碱性逐渐增强碱性逐渐增强酸性逐渐增强
1、镭是周期表中第七周期第ⅡA的元素,下列关于镭性质的描述中不正确的是( )
A、 在化合物中呈+2价
B、 碳酸盐难溶于水
C、 单质使水分解,放出氧气
D、 氢氧化物呈强碱性
C返回四、检测题2、A、B、C、D、E是周期表中同周期的五种主族元素, A、B的最高价氧化物的水化物都呈碱性,且碱性B﹥ A, C的气态氢化物的稳定性比D强, E是五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序为( )
A、ABCDE B、CDABE
C、 BADCE D、ECDBA返回C3、已知短周期元素
X、 Y 、Z在周期
表中的位置如右图
则它们分别是什么
元素?返回 X是氦 、Y是 氟、Z是硫。4、假设X为第ⅡA某元素的原子序数,那么同周期的第ⅢA元素的原子序数不可能为( )
A、 X +1 B、 X +11
C、 X +25 D、 X+8
返回D5、已知某主族元素的原子结构示意图,判断其在周期表中的位置第三周期ⅦA族第四周期ⅠA族返回6、某元素原子的最外层有两个电子,则有关该元素的说法正确的是( )
A、 一定是第 ⅡA 元素
B、 一定是金属元素
C、 最高价一定为+2价
D、 可能是金属元素,也可能不是金属元素D返回7、下列各种性质的比较正确的是 ( )
① 酸性:HClO4﹥ HBrO4
② 碱性: Mg(OH)2﹥Ba(OH)2
③ 非金属性: N﹤F
④ 还原性: Cl -﹤S2-
A、 ① ③ ④ B、 ① ②④
C、 ② ③ ④ D、 ① ② ③ ④A返回8、同周期的X、Y、Z三种元素已知它们的最高价氧化物的水化物是HXO4 、H2YO4、H3ZO4,则这三种元素气态氢化物的稳定性由强到弱的顺序是 。返回X ﹥ Y ﹥ Z研究性学习课题:
元素周期表的发展历程和未来展望三种不同的氢原子原子符号质子数中子数氢原子名称1H12H13H1101112氕 (H)氘 (D)氚 (T)三、同位素O : 8O 8O 8O
C : 6C 6C 6C
U : 92U 92U 92U
Cl : 17Cl 17Cl1617181213142342352363537核素同位素1.下列叙述正确的是( )A. 氢有三种同位素,即有三种氢原子.
B. 所有元素的原子核均由质子和中子构成.
C. 具有相同的核外电子数的粒子,总称为元素.
D. 1H是一种同位素3A2. 以下互为同位素的是( )
A. 金刚石和石墨
B. D2和H2
C. CO和CO2
D. 17Cl和17Cl3537D(1) 和 互为同位素.
(2) 和 质量数相等,但不能互称同位素.
(3) 和 中子数相等,但质子数不相等,所以不是同一种元素.3Li 7N 11Na 12Mg
6C 3Li24元素的相对原子质量
原子的相对原子质量(一种元素可以有多种原子)区分 17Cl 34.969 75.77%
17Cl 36.966 24.23%1.在元素周期表中查得到的相对原子质量是( )A.元素原子的平均质量
B.元素原子的相对质量
C.元素一个原子质量与碳-12原子质量1/12的比值
D.元素原子的平均质量与碳-12原子质量1/12的比值课堂练习D2. 92号元素U有三种核素,其中一种是U-235,关于U-235的说法正确的是( )A.它是一种新元素
B.核内有235个质子
C.它是U-236的一种同位素
D.该元素的相对原子质量是235课堂练习 C3.铜有两种天然同位素29Cu和29Cu,已知铜的相对原子质量是63.5,则29Cu的物质的量分数是多少?它的质量分数是多少?636563课堂练习
