【湖南师大附中内部资料】高一化学必修2课件:1.1_元素周期表2(新人教版)
文档属性
| 名称 | 【湖南师大附中内部资料】高一化学必修2课件:1.1_元素周期表2(新人教版) |

|
|
| 格式 | rar | ||
| 文件大小 | 615.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-04-20 00:00:00 | ||
图片预览











文档简介
课件36张PPT。 高一年级 化学必修2
第一章 物质结构 元素周期律第一节 元素周期表
(第二课时)族的别称ⅠA称为 元素
ⅣA称为 元素
ⅤA称为 元素
ⅥA称为 元素
ⅦA称为 元素
零族称为 元素碱金属碳族氮族氧族卤族稀有气体二、元素的性质与原子结构 查阅元素周期表填写P5表格,从中发现碱金属的原子结构有何异同点?碱金属的原子结构示意图 1.碱金属原子结构的异同①相同点:碱金属元素原子结构的
相同, 都为 。
②递变性:从Li到Cs,碱金属元素
的原子结构中, 依次
增多。最外层电子数1个电子层数 2.碱金属元素单质化学性质的
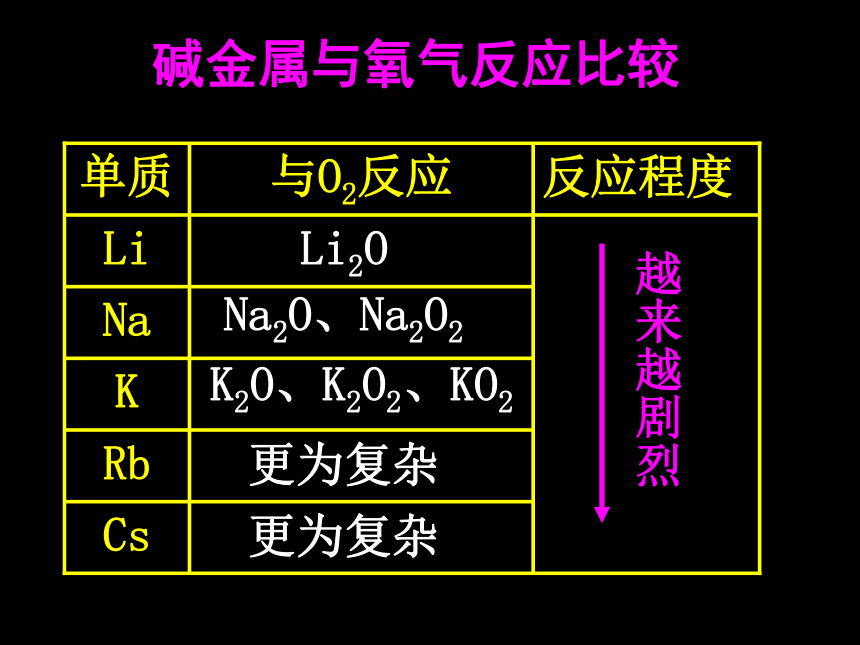
相似性和递变性 最外层上都只有一个电子,化学反应中易失去一个电子,形成+1价的阳离子,并能与氧气等非金属元素及水发生化学反应。 思考 取一小块钾,擦干表面的煤油后放在石棉网上加热,观察现象。同钠与氧气的反应比较。 探究活动1钠、钾化学性质比较黄淡黄紫浮熔游红(1)碱金属元素原子的最外层都有1个电子,它们的化学性质相似 ①与O2的反应 Δ 2Na + O2 = Na2O2结论更为复杂K2O、K2O2、KO2Li2O更为复杂Na2O、Na2O2碱金属与氧气反应比较探究活动2 在小烧杯中放入一些水,然后取绿豆大的钾,吸干表面的煤油,投入到小烧杯中,观察现象。 钠和水钾和水钠、钾化学性质比较黄淡黄紫浮浮熔熔游游红红(1)碱金属元素原子的最外层都有1个电子,它们的化学性质相似 ②与水的反应2Na + 2H2O = 2NaOH + H2↑2K + 2H2O = 2KOH + H2↑通式:2R +2H2O = 2ROH + H2↑结论碱金属与水反应比较剧烈 产生氢气更剧烈 产生氢气轻微爆炸遇水立即燃烧爆炸遇水立即燃烧爆炸(2)碱金属元素从上到下(Li 、Na、K、Rb、Cs),随着核电荷数的增加,碱金属元素原子的电子层数逐渐 ,原子核对 的引力逐渐减弱,原子失电子的能力逐渐 。 结论增多最外层电子增强 元素的金属性逐渐 ,与水和氧气的反应越来越 ,生成的氧化物越来越 。最高价氧化物对应水化物的碱性越来越 。增强剧烈复杂强练习:某碱金属3.9g与足量水反应,生成氢气0.1g,则该金属是什么? K3.元素金属性强弱判断依据:(1)根据金属单质与水或者与酸反应置换出氢的难易程度。置换出氢越容易,则金属性越强。 已知金属A可与冷水反应,金属B和热水才能反应,金属C和水不能反应,判断金属A、B、C金属性强弱如何?金属性 A > B > C 例:(2)根据金属元素最高价氧化物对应水化物碱性强弱。碱性越强,则原金属元素的金属性越强。 已知NaOH为强碱、Mg(OH)2为中强碱、 Al(OH)3为两性氢氧化物,则Na、Mg、Al的金属性强弱顺序如何? 例:金属性 Na > Mg > Al(1)根据金属单质与水或者与酸反应置换出氢的难易程度。置换出氢越容易,则金属性越强。(2)根据金属元素最高价氧化物对应水化物碱性强弱。碱性越强,则原金属元素的金属性越强。(3)可以根据对应阳离子的氧化性强弱判断。金属阳离子氧化性越弱,则其单质的还原性越强,对应元素的金属性越强。 氧化性 Al3+﹥Mg2+﹥Na+ ,则元素金属性顺序为 例:Na﹥Mg﹥Al碱金属的物理性质有何相似性和递变性?4.碱金属的物理性质的比较相
似
点递变颜色硬度密度熔沸点导电导热性密度变化熔沸点变化Li Na K Rb Cs均为银白色(Cs略带金色)柔软较小较低强逐渐增大(K特殊)单质的熔沸点逐渐降低 1.锂电池是一种高能电池。
锂有机化学中重要的催化剂。
锂制造氢弹不可缺少的材料。
锂是优质的高能燃料(已经
用于宇宙飞船、人造卫星和
超声速飞机)。 3.铷铯主要用于制备光电管、真空管。铯原子钟是目前最准确的计时仪器。2.钾的化合物最大用途是做钾肥。硝酸钾还用于做火药。5.碱金属元素的用途:课堂练习: 碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列预言错误的是:
A.在碱金属中它具有最大的原子半径
B.它的氢氧化物化学式为FrOH,是一种极强的碱
C.钫在空气中燃烧时,只生成化学式为Fr2O的
氧化物
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆 CF2 冷暗处爆炸 H2+F2====2HF HF很稳定 Cl2 光照或点燃 H2+Cl2=====2HCl HCl稳定Br2 高温 H2+Br2======2HBr HBr较不稳定I2 高温、持续加热 H2+I2======2HI HI很不稳定
缓慢进行 ②卤素与氢气的反应(1)反应的剧烈程度:越来越剧烈
卤素单质与H2化合的难易关系:F2 >Cl2> Br2> I 2(2)卤化氢的稳定性关系:HF > HCl > HBr > HI 结论: F Cl Br I 随着核电荷数的增多,原子半径的增大最外层7个电子易得一个电子,核电荷数递增电子层数递增原子半径依次增大得电子能力逐渐减弱原子结构性质决定具氧化性氧化性逐渐减弱卤素单质的化学性质1) 对比Cl2,写出Br2与 Na 、Fe 反应的化学方程式。 ① 与金属反应:F2 Cl2 Br2 的氧化性强,能把可变化合价的金属氧化成高价的金属卤化物,I2 的氧化能力最弱,跟铁反应只夺取铁的2个电子,生成FeI2。2)对比Cl2,写出F2 、Br2、I2与 H2 反应的化学方程式。它们发生反应的条件相同吗? I2 +Fe=FeI2Br2+2Na=2NaBr3Br2+2Fe=2FeBr3Br2+ H2O=====HBr+HBrO反应越来越难以发生2F2+2H2O=====4HF+O2 (特例)Cl2 +H2O=====HCl+HClO③卤素与水反应通式:X2 + H2O=====HX+HXO(X:Cl、Br、I)I2 +H2O=====HI+HIO3) 对比Cl2,写出Br2与 H2O 反应的化学方程式。 4)卤素间的相互置换 Cl2+ 2Br- = 2Cl-+Br2
Cl2+ 2I- = 2Cl-+I2
Br2+ 2I- = 2Br-+I2 思考:根据上述实验,排出Cl2、Br2、I2的氧化性强弱顺序及Cl-、Br-、I-的还原性强弱顺序结论: 氧化性:Cl2>Br2>I2
还原性:I->Br->Cl-小 结卤素原子结构的相似性,决定了单质化学性质的
相似性。与金属反应,生成卤化物。与氢气反应,生成卤化氢。与水反应,生成卤化氢和次卤酸。卤素原子结构的差异性,决定了单质化学性质的
差异性和递变性与氢反应的能力渐弱氢化物的稳定性渐弱与水反应的能力渐弱特性碘遇淀粉显蓝色。氟气和水的反应: 2F2 +2H2O=4HF+ O2 [本节课归纳与总结] 同一主族元素性质具有一定的相似性和递变性;同一主族,从上到下:原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,金属性逐渐 ,非金属性逐渐 ; 增大增强减弱增强减弱课堂练习: 现有下列几种物质的溶液KCl、KI、新制氯水、KBr、淀粉、AgNO3,不用其他试剂,怎样鉴别它们? 课堂练习: :砹(At)是卤族元素中位于碘后面的元素,试推测砹和砹的化合物最不可能具备性质
A.砹易溶于某些有机溶剂
B.砹化氢很稳定不易分解
C.砹是有色气体
D.砹化银不溶于水或稀HNO3BC卤族元素单质的物理性质的变化规律:
随原子序数的递增:
1.颜色: 浅黄绿色~黄绿色~深红棕 色~紫黑色 颜色逐渐加深
2.状态: 气态~液态~固态
3.熔沸点: 逐渐升高
4.密度: 逐渐增大
5.溶解性: 逐渐减小
元素非金属性强弱的比较
第一章 物质结构 元素周期律第一节 元素周期表
(第二课时)族的别称ⅠA称为 元素
ⅣA称为 元素
ⅤA称为 元素
ⅥA称为 元素
ⅦA称为 元素
零族称为 元素碱金属碳族氮族氧族卤族稀有气体二、元素的性质与原子结构 查阅元素周期表填写P5表格,从中发现碱金属的原子结构有何异同点?碱金属的原子结构示意图 1.碱金属原子结构的异同①相同点:碱金属元素原子结构的
相同, 都为 。
②递变性:从Li到Cs,碱金属元素
的原子结构中, 依次
增多。最外层电子数1个电子层数 2.碱金属元素单质化学性质的
相似性和递变性 最外层上都只有一个电子,化学反应中易失去一个电子,形成+1价的阳离子,并能与氧气等非金属元素及水发生化学反应。 思考 取一小块钾,擦干表面的煤油后放在石棉网上加热,观察现象。同钠与氧气的反应比较。 探究活动1钠、钾化学性质比较黄淡黄紫浮熔游红(1)碱金属元素原子的最外层都有1个电子,它们的化学性质相似 ①与O2的反应 Δ 2Na + O2 = Na2O2结论更为复杂K2O、K2O2、KO2Li2O更为复杂Na2O、Na2O2碱金属与氧气反应比较探究活动2 在小烧杯中放入一些水,然后取绿豆大的钾,吸干表面的煤油,投入到小烧杯中,观察现象。 钠和水钾和水钠、钾化学性质比较黄淡黄紫浮浮熔熔游游红红(1)碱金属元素原子的最外层都有1个电子,它们的化学性质相似 ②与水的反应2Na + 2H2O = 2NaOH + H2↑2K + 2H2O = 2KOH + H2↑通式:2R +2H2O = 2ROH + H2↑结论碱金属与水反应比较剧烈 产生氢气更剧烈 产生氢气轻微爆炸遇水立即燃烧爆炸遇水立即燃烧爆炸(2)碱金属元素从上到下(Li 、Na、K、Rb、Cs),随着核电荷数的增加,碱金属元素原子的电子层数逐渐 ,原子核对 的引力逐渐减弱,原子失电子的能力逐渐 。 结论增多最外层电子增强 元素的金属性逐渐 ,与水和氧气的反应越来越 ,生成的氧化物越来越 。最高价氧化物对应水化物的碱性越来越 。增强剧烈复杂强练习:某碱金属3.9g与足量水反应,生成氢气0.1g,则该金属是什么? K3.元素金属性强弱判断依据:(1)根据金属单质与水或者与酸反应置换出氢的难易程度。置换出氢越容易,则金属性越强。 已知金属A可与冷水反应,金属B和热水才能反应,金属C和水不能反应,判断金属A、B、C金属性强弱如何?金属性 A > B > C 例:(2)根据金属元素最高价氧化物对应水化物碱性强弱。碱性越强,则原金属元素的金属性越强。 已知NaOH为强碱、Mg(OH)2为中强碱、 Al(OH)3为两性氢氧化物,则Na、Mg、Al的金属性强弱顺序如何? 例:金属性 Na > Mg > Al(1)根据金属单质与水或者与酸反应置换出氢的难易程度。置换出氢越容易,则金属性越强。(2)根据金属元素最高价氧化物对应水化物碱性强弱。碱性越强,则原金属元素的金属性越强。(3)可以根据对应阳离子的氧化性强弱判断。金属阳离子氧化性越弱,则其单质的还原性越强,对应元素的金属性越强。 氧化性 Al3+﹥Mg2+﹥Na+ ,则元素金属性顺序为 例:Na﹥Mg﹥Al碱金属的物理性质有何相似性和递变性?4.碱金属的物理性质的比较相
似
点递变颜色硬度密度熔沸点导电导热性密度变化熔沸点变化Li Na K Rb Cs均为银白色(Cs略带金色)柔软较小较低强逐渐增大(K特殊)单质的熔沸点逐渐降低 1.锂电池是一种高能电池。
锂有机化学中重要的催化剂。
锂制造氢弹不可缺少的材料。
锂是优质的高能燃料(已经
用于宇宙飞船、人造卫星和
超声速飞机)。 3.铷铯主要用于制备光电管、真空管。铯原子钟是目前最准确的计时仪器。2.钾的化合物最大用途是做钾肥。硝酸钾还用于做火药。5.碱金属元素的用途:课堂练习: 碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列预言错误的是:
A.在碱金属中它具有最大的原子半径
B.它的氢氧化物化学式为FrOH,是一种极强的碱
C.钫在空气中燃烧时,只生成化学式为Fr2O的
氧化物
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆 CF2 冷暗处爆炸 H2+F2====2HF HF很稳定 Cl2 光照或点燃 H2+Cl2=====2HCl HCl稳定Br2 高温 H2+Br2======2HBr HBr较不稳定I2 高温、持续加热 H2+I2======2HI HI很不稳定
缓慢进行 ②卤素与氢气的反应(1)反应的剧烈程度:越来越剧烈
卤素单质与H2化合的难易关系:F2 >Cl2> Br2> I 2(2)卤化氢的稳定性关系:HF > HCl > HBr > HI 结论: F Cl Br I 随着核电荷数的增多,原子半径的增大最外层7个电子易得一个电子,核电荷数递增电子层数递增原子半径依次增大得电子能力逐渐减弱原子结构性质决定具氧化性氧化性逐渐减弱卤素单质的化学性质1) 对比Cl2,写出Br2与 Na 、Fe 反应的化学方程式。 ① 与金属反应:F2 Cl2 Br2 的氧化性强,能把可变化合价的金属氧化成高价的金属卤化物,I2 的氧化能力最弱,跟铁反应只夺取铁的2个电子,生成FeI2。2)对比Cl2,写出F2 、Br2、I2与 H2 反应的化学方程式。它们发生反应的条件相同吗? I2 +Fe=FeI2Br2+2Na=2NaBr3Br2+2Fe=2FeBr3Br2+ H2O=====HBr+HBrO反应越来越难以发生2F2+2H2O=====4HF+O2 (特例)Cl2 +H2O=====HCl+HClO③卤素与水反应通式:X2 + H2O=====HX+HXO(X:Cl、Br、I)I2 +H2O=====HI+HIO3) 对比Cl2,写出Br2与 H2O 反应的化学方程式。 4)卤素间的相互置换 Cl2+ 2Br- = 2Cl-+Br2
Cl2+ 2I- = 2Cl-+I2
Br2+ 2I- = 2Br-+I2 思考:根据上述实验,排出Cl2、Br2、I2的氧化性强弱顺序及Cl-、Br-、I-的还原性强弱顺序结论: 氧化性:Cl2>Br2>I2
还原性:I->Br->Cl-小 结卤素原子结构的相似性,决定了单质化学性质的
相似性。与金属反应,生成卤化物。与氢气反应,生成卤化氢。与水反应,生成卤化氢和次卤酸。卤素原子结构的差异性,决定了单质化学性质的
差异性和递变性与氢反应的能力渐弱氢化物的稳定性渐弱与水反应的能力渐弱特性碘遇淀粉显蓝色。氟气和水的反应: 2F2 +2H2O=4HF+ O2 [本节课归纳与总结] 同一主族元素性质具有一定的相似性和递变性;同一主族,从上到下:原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,金属性逐渐 ,非金属性逐渐 ; 增大增强减弱增强减弱课堂练习: 现有下列几种物质的溶液KCl、KI、新制氯水、KBr、淀粉、AgNO3,不用其他试剂,怎样鉴别它们? 课堂练习: :砹(At)是卤族元素中位于碘后面的元素,试推测砹和砹的化合物最不可能具备性质
A.砹易溶于某些有机溶剂
B.砹化氢很稳定不易分解
C.砹是有色气体
D.砹化银不溶于水或稀HNO3BC卤族元素单质的物理性质的变化规律:
随原子序数的递增:
1.颜色: 浅黄绿色~黄绿色~深红棕 色~紫黑色 颜色逐渐加深
2.状态: 气态~液态~固态
3.熔沸点: 逐渐升高
4.密度: 逐渐增大
5.溶解性: 逐渐减小
元素非金属性强弱的比较
