【湖南师大附中内部资料】高一化学必修2课件:1.1_元素周期表3(新人教版)
文档属性
| 名称 | 【湖南师大附中内部资料】高一化学必修2课件:1.1_元素周期表3(新人教版) |  | |
| 格式 | rar | ||
| 文件大小 | 409.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-04-20 10:17:00 | ||
图片预览




文档简介
课件15张PPT。 高一年级 化学必修2
第一章 物质结构 元素周期律第一节 元素周期表
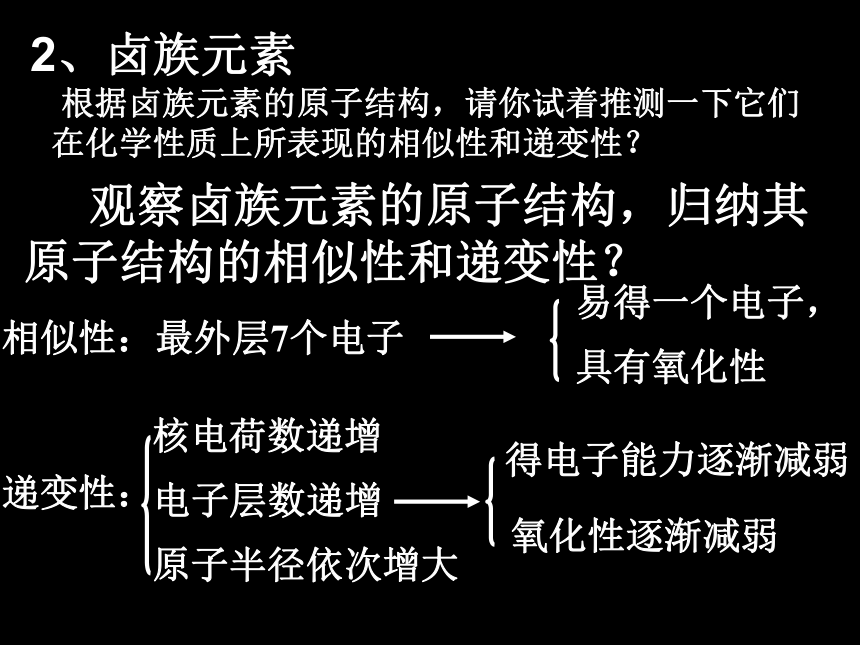
(第三课时) 观察卤族元素的原子结构,归纳其
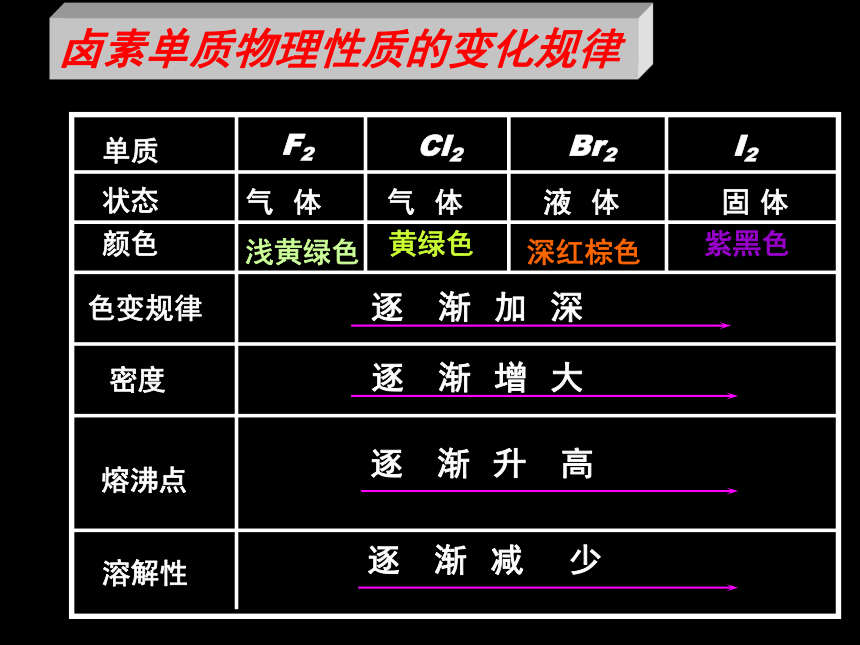
原子结构的相似性和递变性?2、卤族元素相似性:最外层7个电子递变性:核电荷数递增电子层数递增原子半径依次增大易得一个电子,具有氧化性得电子能力逐渐减弱氧化性逐渐减弱 根据卤族元素的原子结构,请你试着推测一下它们在化学性质上所表现的相似性和递变性?卤素单质物理性质的变化规律F2Br2I2Cl2单质密度熔沸点颜色状态色变规律溶解性卤素与金属的反应Br2+2Na=2NaBr
3Br2+2Fe=2FeBr3I2 +Fe=FeI2F2 暗处 H2+F2====2HF HF很稳定 Cl2 光照或点燃 H2+Cl2=====2HCl HCl稳定Br2 高温 H2+Br2======2HBr 较不稳定I2 高温、持 H2+I2======2HI HI很不稳定
续加热
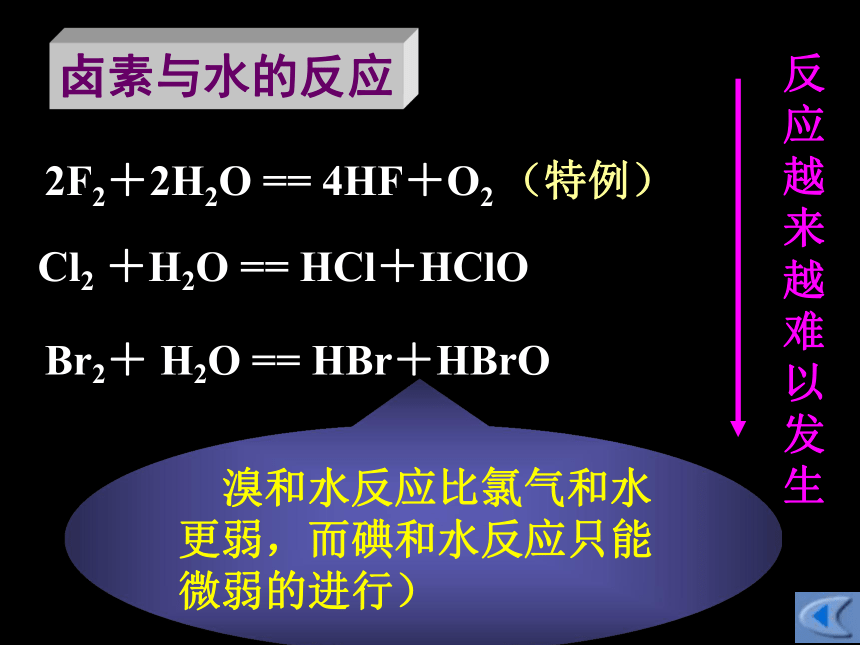
500℃光照卤素与氢气的反应或点燃方程式 反应条件名称Br2+ H2O == HBr+HBrO反应越来越难以发生2F2+2H2O == 4HF+O2 (特例)Cl2 +H2O == HCl+HClO卤素与水的反应 溴和水反应比氯气和水更弱,而碘和水反应只能微弱的进行)[实验4-9] 将少量新制的饱和氯水分别注入盛有NaBr 溶液和 KI 溶液的试管中,用力震荡后,再注入少量四氯化碳,震荡。观察四氯化碳层和水层颜色的变化。[实验4-10] 将少量溴水注入盛有KI 溶液的试管中,用力震荡后,再注入少量四氯化碳。观察四氯化碳层和水层颜色的变化。卤素单质间的置换反应1. Cl2+ 2Br- == 2Cl-+Br2
2. Cl2+ 2I- == 2Cl-+I2
3. Br2+ 2I- == 2Br-+I2 结论: 氧化性:Cl2>Br2>I2
还原性:I->Br->Cl-小 结卤素原子结构的相似性,决定了单质化学性质的相似性。与金属反应,生成卤化物。与水反应,生成氢卤酸和次卤酸。卤素原子结构的差异性,决定了单质化学性质的差异性和递变性与氢反应的能力渐弱氢化物的稳定性渐弱与水反应的能力渐弱与氢气反应,生成卤化氢。1、单质跟氢气反应生成气态氢化物的
难易;2、气态氢化物的稳定性强弱;3、元素最高价氧化物对应的水化物的
酸性强弱;4、置换反应。元素非金属性强弱判断依据:同主族元素性质的相似性和递变规律同主族元素的 相同,决定它们在性质上具有相似性。同主族元素中,由于从上到下电子层数依次增多,原子半径逐渐增大,原子核对外层电子吸引力逐渐减小,因此得到电子的能力逐渐 ,非金属性逐渐 。最外层电子数减弱减弱三、核 素质量数(A)=质子数(Z)+中子数(N)质量关系:元素:具有相同核电荷数(即质子数)
的一类原子的总称。核素:把具有一定数目的质子和一定数目的中子的一种原子称核素。
同位素:具有相同质子数、不同中子数的同种元素的不同原子互称为同位素。(一种元素可以有多种原子)(一种核素就是一种原子)(同种元素的各种同位素在周期表
中处在相同的位置)氢元素的各种核素? 11H、12H、13H ;
碳元素的各种核素? 612C、613C、614C ; ??????
氧元素的各种核素? 816O、817O、818O ; ??????
铀元素的各种核素? 92234U、92235U 、 92238U 。
第一章 物质结构 元素周期律第一节 元素周期表
(第三课时) 观察卤族元素的原子结构,归纳其
原子结构的相似性和递变性?2、卤族元素相似性:最外层7个电子递变性:核电荷数递增电子层数递增原子半径依次增大易得一个电子,具有氧化性得电子能力逐渐减弱氧化性逐渐减弱 根据卤族元素的原子结构,请你试着推测一下它们在化学性质上所表现的相似性和递变性?卤素单质物理性质的变化规律F2Br2I2Cl2单质密度熔沸点颜色状态色变规律溶解性卤素与金属的反应Br2+2Na=2NaBr
3Br2+2Fe=2FeBr3I2 +Fe=FeI2F2 暗处 H2+F2====2HF HF很稳定 Cl2 光照或点燃 H2+Cl2=====2HCl HCl稳定Br2 高温 H2+Br2======2HBr 较不稳定I2 高温、持 H2+I2======2HI HI很不稳定
续加热
500℃光照卤素与氢气的反应或点燃方程式 反应条件名称Br2+ H2O == HBr+HBrO反应越来越难以发生2F2+2H2O == 4HF+O2 (特例)Cl2 +H2O == HCl+HClO卤素与水的反应 溴和水反应比氯气和水更弱,而碘和水反应只能微弱的进行)[实验4-9] 将少量新制的饱和氯水分别注入盛有NaBr 溶液和 KI 溶液的试管中,用力震荡后,再注入少量四氯化碳,震荡。观察四氯化碳层和水层颜色的变化。[实验4-10] 将少量溴水注入盛有KI 溶液的试管中,用力震荡后,再注入少量四氯化碳。观察四氯化碳层和水层颜色的变化。卤素单质间的置换反应1. Cl2+ 2Br- == 2Cl-+Br2
2. Cl2+ 2I- == 2Cl-+I2
3. Br2+ 2I- == 2Br-+I2 结论: 氧化性:Cl2>Br2>I2
还原性:I->Br->Cl-小 结卤素原子结构的相似性,决定了单质化学性质的相似性。与金属反应,生成卤化物。与水反应,生成氢卤酸和次卤酸。卤素原子结构的差异性,决定了单质化学性质的差异性和递变性与氢反应的能力渐弱氢化物的稳定性渐弱与水反应的能力渐弱与氢气反应,生成卤化氢。1、单质跟氢气反应生成气态氢化物的
难易;2、气态氢化物的稳定性强弱;3、元素最高价氧化物对应的水化物的
酸性强弱;4、置换反应。元素非金属性强弱判断依据:同主族元素性质的相似性和递变规律同主族元素的 相同,决定它们在性质上具有相似性。同主族元素中,由于从上到下电子层数依次增多,原子半径逐渐增大,原子核对外层电子吸引力逐渐减小,因此得到电子的能力逐渐 ,非金属性逐渐 。最外层电子数减弱减弱三、核 素质量数(A)=质子数(Z)+中子数(N)质量关系:元素:具有相同核电荷数(即质子数)
的一类原子的总称。核素:把具有一定数目的质子和一定数目的中子的一种原子称核素。
同位素:具有相同质子数、不同中子数的同种元素的不同原子互称为同位素。(一种元素可以有多种原子)(一种核素就是一种原子)(同种元素的各种同位素在周期表
中处在相同的位置)氢元素的各种核素? 11H、12H、13H ;
碳元素的各种核素? 612C、613C、614C ; ??????
氧元素的各种核素? 816O、817O、818O ; ??????
铀元素的各种核素? 92234U、92235U 、 92238U 。
