氨气的性质
图片预览







文档简介
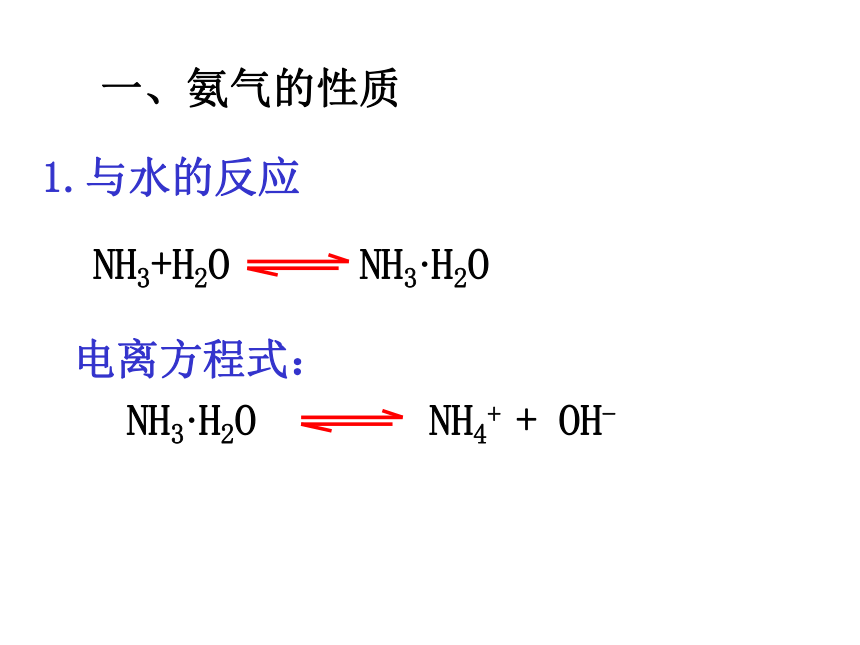
课件23张PPT。氮肥的生产和使用 庄稼一枝花,全靠粪当家 庄稼一枝花,全靠肥当家 1800年未使用化肥每公顷耕地生产0.73吨粮食1978年开始使用化肥每公顷耕地生产4.63吨粮食 如果不施化肥,中国只能养活2亿多人口,剩下11亿人就没饭吃。 哈伯波施氨的制法工业制法 在干燥的烧瓶内充满氨气,塞上带有玻璃管和胶头滴管(预先吸入少量水)的胶塞,组装实验装置。打开橡皮管上的止水夹,挤压胶头滴管,观察现象。实验现象:形成喷泉,溶液是红色结论:氨气极易溶于水观察与思考1形成条件:形成压强差溶液碱性一、氨气的性质1.与水的反应电离方程式:
分子:NH3、H2O、NH3·H2O
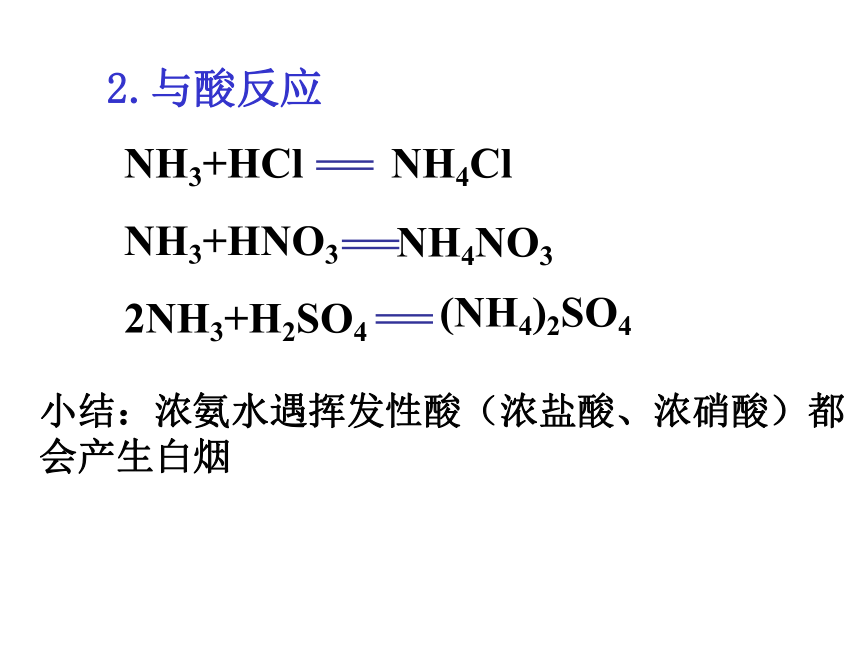
离子:OH-、NH4+ 、 H+NH3·H2O交流与讨论1.氨水中有哪些微粒呢?2.除水分子之外,最多的微粒是什么?观察与思考2在一支洁净的试管中滴加几滴氨水,将湿润的红色石蕊试纸(或PH试纸)粘在玻璃棒上靠近试管口,观察试纸颜色变化情况。实验现象:结论:试纸变蓝氨水易挥发,呈碱性分别在两根玻璃棒上滴几滴浓氨水和浓盐酸,观察现象。实验现象:结论:观察与思考3产生大量白烟氨气是碱性气体NH3+HCl
NH3+HNO3
2NH3+H2SO4 NH4ClNH4NO3(NH4)2SO4小结:浓氨水遇挥发性酸(浓盐酸、浓硝酸)都会产生白烟2.与酸反应(此反应为氨的催化氧化,工业制硝酸的重要反应)3.氨的催化氧化——还原性2NO + O2 == 2NO23NO2 + H2 O == 2HNO3 + NO4.氨气的物理性质无色刺激性气味的气体,
极易溶于水(1:700),
密度比空气小,
易液化(液氨作制冷剂)铵态氮肥:硫铵(肥田粉)、硝铵、碳铵、氯铵
硝态氮肥:硝酸盐
尿素:CO(NH2)2(NH4)2SO4NH4NO3NH4HCO3NH4ClCO(NH2)2 白色、易溶于水的晶体二、铵盐活动与探究 取少量氯化铵(NH4Cl)晶体,放入试管中,在酒精灯火焰上加热,观察发生的现象。实验现象:结论:试管底部固体减少,中部增加氯化铵受热分解为氨气和HCl二、铵盐1.受热分解(不稳定性) 取少量氯化铵(NH4Cl)与少量混合Ca(OH)2后放入试管中,在酒精灯上微热,用湿润的红色石蕊试纸检验生成的气体,观察发生的现象。活动与探究实验现象:结论:试纸变蓝与碱共热会产生氨气——实验室制氨气2.与碱反应△ ① 湿润的红色石蕊试纸②用玻璃棒蘸取浓盐酸1.铵盐检验 将铵盐和强碱溶液共热,在试管口放一湿润的红色石蕊试纸,变蓝则白色晶体中含NH4+交流与讨论2.检验氨气是否收集满的方法?如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是( )
A、a为HCl气体,b为H2O
B、 a为CO2气体,b为浓NaOH溶液
C、a为Cl2气体,b为饱和NaCl溶液
D、a为Cl2气体,b为浓NaOH溶液C问题解决1、下列关于氨性质的叙述中正确的是( )
A、氨气可用排水法收集
B、氨水呈碱性
C、氨气和酸相遇都能产生白烟
D、在反应NH3+H+=NH4+中,氨失去电子被氧化B问题解决2、某同学在实验室中发现了一瓶有刺激性气味的
气体,根据气体的判断可能是氨气,但不知是否确实是氨气,下列提供的方法中,你认为能帮他检验是否为氨气的方法是( )
A、将湿润的红色石蕊试纸放在瓶口
B、将干燥的红色石蕊试纸放在瓶口
C、用蘸有浓盐酸的玻璃棒靠近瓶口
D、将湿润的蓝色石蕊试纸放在瓶口AC问题解决3、 在8NH3+3Cl2==N2+6NH4Cl反应中,若有2molN2生成,发生氧化还原的NH3物质的量是( )
A、16mol NH3 B、8mol NH3
C、4mol NH3 D、3mol NH3 C问题解决4、在同温同压下,相同体积的烧瓶分别充满氨气和氯化氢气体,做喷泉实验后,水都充满烧瓶,烧瓶中所得溶液的物质的量浓度之比是( )
A、1:0.45 B、1:1
C、1:0.29 D、4.5:2.9B问题解决5、常温、常压下能大量共存,并能用浓硫酸干燥的气体是( )
A、NH3、HCl B、O2、H2、SO2
C、NH3、N2、H2 D、O2、CO2、H2SB问题解决
分子:NH3、H2O、NH3·H2O
离子:OH-、NH4+ 、 H+NH3·H2O交流与讨论1.氨水中有哪些微粒呢?2.除水分子之外,最多的微粒是什么?观察与思考2在一支洁净的试管中滴加几滴氨水,将湿润的红色石蕊试纸(或PH试纸)粘在玻璃棒上靠近试管口,观察试纸颜色变化情况。实验现象:结论:试纸变蓝氨水易挥发,呈碱性分别在两根玻璃棒上滴几滴浓氨水和浓盐酸,观察现象。实验现象:结论:观察与思考3产生大量白烟氨气是碱性气体NH3+HCl
NH3+HNO3
2NH3+H2SO4 NH4ClNH4NO3(NH4)2SO4小结:浓氨水遇挥发性酸(浓盐酸、浓硝酸)都会产生白烟2.与酸反应(此反应为氨的催化氧化,工业制硝酸的重要反应)3.氨的催化氧化——还原性2NO + O2 == 2NO23NO2 + H2 O == 2HNO3 + NO4.氨气的物理性质无色刺激性气味的气体,
极易溶于水(1:700),
密度比空气小,
易液化(液氨作制冷剂)铵态氮肥:硫铵(肥田粉)、硝铵、碳铵、氯铵
硝态氮肥:硝酸盐
尿素:CO(NH2)2(NH4)2SO4NH4NO3NH4HCO3NH4ClCO(NH2)2 白色、易溶于水的晶体二、铵盐活动与探究 取少量氯化铵(NH4Cl)晶体,放入试管中,在酒精灯火焰上加热,观察发生的现象。实验现象:结论:试管底部固体减少,中部增加氯化铵受热分解为氨气和HCl二、铵盐1.受热分解(不稳定性) 取少量氯化铵(NH4Cl)与少量混合Ca(OH)2后放入试管中,在酒精灯上微热,用湿润的红色石蕊试纸检验生成的气体,观察发生的现象。活动与探究实验现象:结论:试纸变蓝与碱共热会产生氨气——实验室制氨气2.与碱反应△ ① 湿润的红色石蕊试纸②用玻璃棒蘸取浓盐酸1.铵盐检验 将铵盐和强碱溶液共热,在试管口放一湿润的红色石蕊试纸,变蓝则白色晶体中含NH4+交流与讨论2.检验氨气是否收集满的方法?如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是( )
A、a为HCl气体,b为H2O
B、 a为CO2气体,b为浓NaOH溶液
C、a为Cl2气体,b为饱和NaCl溶液
D、a为Cl2气体,b为浓NaOH溶液C问题解决1、下列关于氨性质的叙述中正确的是( )
A、氨气可用排水法收集
B、氨水呈碱性
C、氨气和酸相遇都能产生白烟
D、在反应NH3+H+=NH4+中,氨失去电子被氧化B问题解决2、某同学在实验室中发现了一瓶有刺激性气味的
气体,根据气体的判断可能是氨气,但不知是否确实是氨气,下列提供的方法中,你认为能帮他检验是否为氨气的方法是( )
A、将湿润的红色石蕊试纸放在瓶口
B、将干燥的红色石蕊试纸放在瓶口
C、用蘸有浓盐酸的玻璃棒靠近瓶口
D、将湿润的蓝色石蕊试纸放在瓶口AC问题解决3、 在8NH3+3Cl2==N2+6NH4Cl反应中,若有2molN2生成,发生氧化还原的NH3物质的量是( )
A、16mol NH3 B、8mol NH3
C、4mol NH3 D、3mol NH3 C问题解决4、在同温同压下,相同体积的烧瓶分别充满氨气和氯化氢气体,做喷泉实验后,水都充满烧瓶,烧瓶中所得溶液的物质的量浓度之比是( )
A、1:0.45 B、1:1
C、1:0.29 D、4.5:2.9B问题解决5、常温、常压下能大量共存,并能用浓硫酸干燥的气体是( )
A、NH3、HCl B、O2、H2、SO2
C、NH3、N2、H2 D、O2、CO2、H2SB问题解决
