化学键(第二课时)
图片预览



文档简介
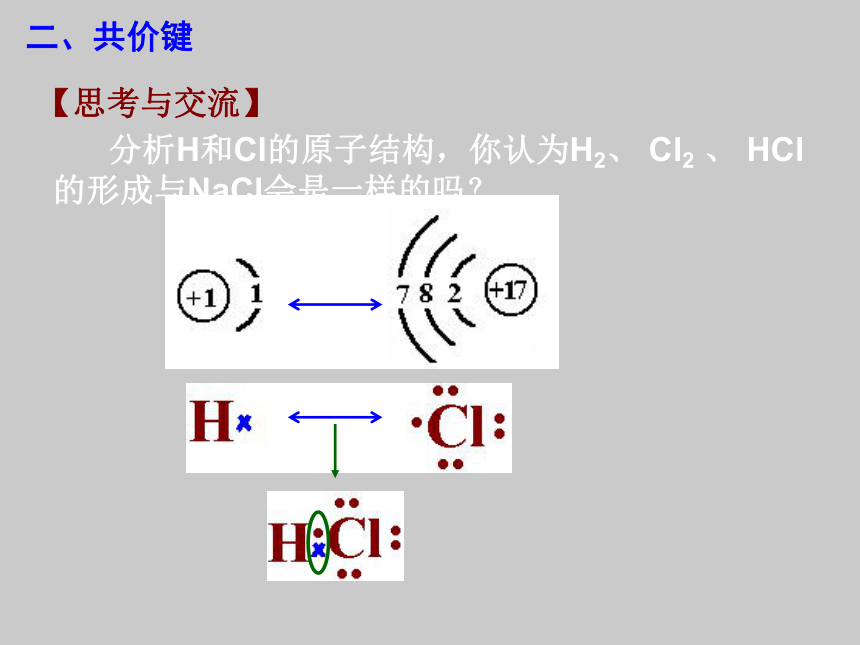
课件13张PPT。化学键 【思考与交流】 分析H和Cl的原子结构,你认为H2、 Cl2 、 HCl的形成与NaCl会是一样的吗? 二、共价键二、共价键
1、定义:原子间通过 共用电子对 所形成的相互作用。3、形成特征:有电子的偏移共用,没有电子失得2.成键规律:同种或不同种 非金属 元素原子结合(稀有
元素除外);部分不活泼金属元素原子与非
金属元素原子,如AlCl3 4.成键粒子:原子5、成键结果:形成共价化合物或单质7、表示:
6、共价化合物:以共用电子对 形成分子的化合物。电子式结构式:①分子
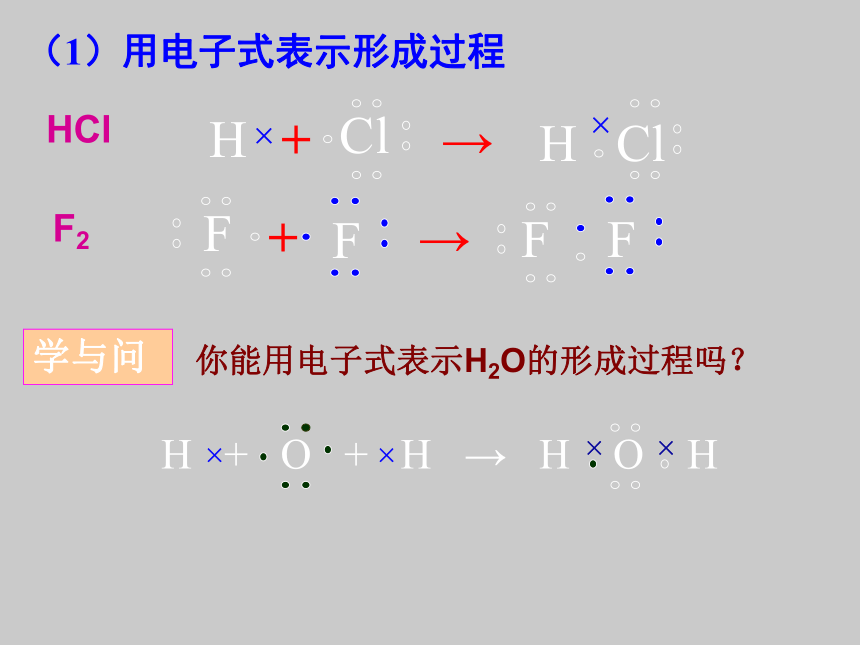
②共价化合物的形成过程用一根短线“ ”表示一对共用电子对的式子HClF2+→+→(1)用电子式表示形成过程学与问你能用电子式表示H2O的形成过程吗?(2)结构式
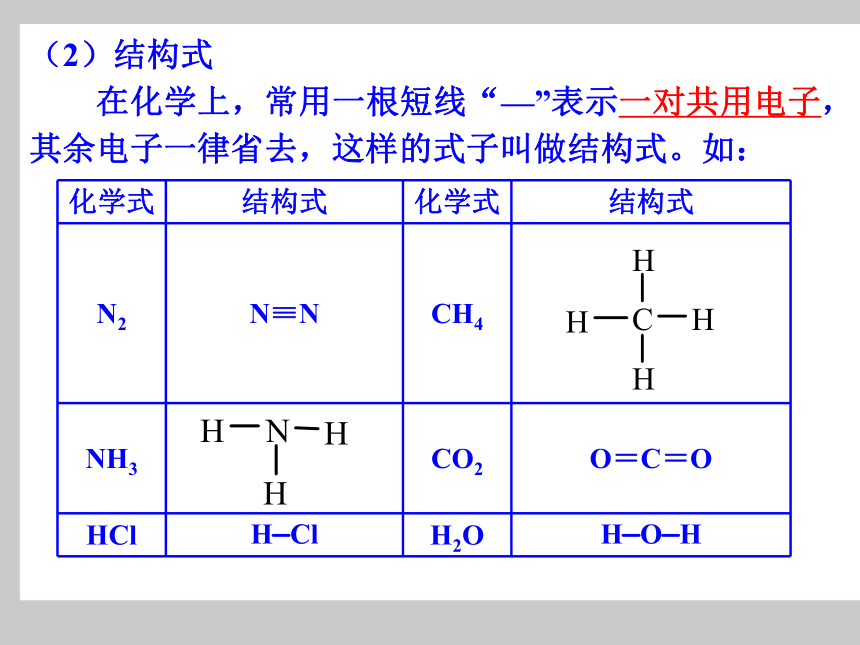
在化学上,常用一根短线“—”表示一对共用电子,其余电子一律省去,这样的式子叫做结构式。如: 下列叙述中,不正确的是( )
A.共价化合物中不可能含有离子键;
B.硫酸分子中有H+和SO42-两种离子;
C.某元素原子的最外层只有一个电子,它跟其
它元素可能形成离子键,也可能形成共价键;
D.离子键和共价键的实质都是电性的相互作用.
B【思考与交流】含有共价键的化合物一定是共价化合物
全部由非金属元素组成的化合物一定是共价化合物
在气态单质分子里一定有共价键
H2和HCl的分子里都有1个共价键,这两者共价键的性质完全一样吗?
错,如 NH4Cl 等铵盐 错,如:NaOH Na2SO4 错,He、Ne等稀有气体【学与问】 不完全一样。
在H2分子里成键的两个原子相同,吸引电子对能力一样,共用电子对不偏移,两个原子均不显电性;而HCl的分子中,Cl原子的吸引电子对能力强于H原子,共用电子对偏向Cl 而偏离于H ,使Cl略显负电性, H略显正电性。同种不同种相同不同不偏移偏向吸引电子对强的不显电吸引电子对强的显负电性
吸引电子对弱的显正电性Cl2、O2、H2HCl、NH3、CO2、H2O1、下列含有极性键的离子化合物是( )练习巩固8、极性键和非极性键 A.Na2O2 B.NaOH C.HNO3 D.NaClB离子键、共价键的比较9.化学键定义:使 离子相结合或 原子 间相结合的作用力. 化学键离子键共价键非极性键极性键H2和Cl2分子旧键断裂成原子 新键形成
(HCl分子) H2和Cl2作用生成HCl的反应过程: 一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。10、化学反应本质 在下列化学反应中,既有离子键、极性键断裂,又有离子键、极性键形成的是( )
A.Na2O+H2O=2NaOH
B.SO2+H2O=H2SO3
C.Cl2+H2O=HCl+HClO
D.4Li+O2 2Li2O
A【思考与交流】11.分子间作用力(范德华力)(1)分子间作用力比化学键弱得多;(2)对物质的熔、沸点等有影响;(3)一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点也越高。(1)NH3、H2O和HF的分子间存在着一种比分子间作用力稍强的相互作用,叫做氢键。
(2)氢键比化学键弱,不属于化学键,可以把分子间的氢键看做是一种较强的分子间作用力。
(3)氢键的存在可使物质的熔、沸点升高。
(4)冰中氢键的存在使冰的结构中有空隙,造成其密度低于液态水。12.氢键
1、定义:原子间通过 共用电子对 所形成的相互作用。3、形成特征:有电子的偏移共用,没有电子失得2.成键规律:同种或不同种 非金属 元素原子结合(稀有
元素除外);部分不活泼金属元素原子与非
金属元素原子,如AlCl3 4.成键粒子:原子5、成键结果:形成共价化合物或单质7、表示:
6、共价化合物:以共用电子对 形成分子的化合物。电子式结构式:①分子
②共价化合物的形成过程用一根短线“ ”表示一对共用电子对的式子HClF2+→+→(1)用电子式表示形成过程学与问你能用电子式表示H2O的形成过程吗?(2)结构式
在化学上,常用一根短线“—”表示一对共用电子,其余电子一律省去,这样的式子叫做结构式。如: 下列叙述中,不正确的是( )
A.共价化合物中不可能含有离子键;
B.硫酸分子中有H+和SO42-两种离子;
C.某元素原子的最外层只有一个电子,它跟其
它元素可能形成离子键,也可能形成共价键;
D.离子键和共价键的实质都是电性的相互作用.
B【思考与交流】含有共价键的化合物一定是共价化合物
全部由非金属元素组成的化合物一定是共价化合物
在气态单质分子里一定有共价键
H2和HCl的分子里都有1个共价键,这两者共价键的性质完全一样吗?
错,如 NH4Cl 等铵盐 错,如:NaOH Na2SO4 错,He、Ne等稀有气体【学与问】 不完全一样。
在H2分子里成键的两个原子相同,吸引电子对能力一样,共用电子对不偏移,两个原子均不显电性;而HCl的分子中,Cl原子的吸引电子对能力强于H原子,共用电子对偏向Cl 而偏离于H ,使Cl略显负电性, H略显正电性。同种不同种相同不同不偏移偏向吸引电子对强的不显电吸引电子对强的显负电性
吸引电子对弱的显正电性Cl2、O2、H2HCl、NH3、CO2、H2O1、下列含有极性键的离子化合物是( )练习巩固8、极性键和非极性键 A.Na2O2 B.NaOH C.HNO3 D.NaClB离子键、共价键的比较9.化学键定义:使 离子相结合或 原子 间相结合的作用力. 化学键离子键共价键非极性键极性键H2和Cl2分子旧键断裂成原子 新键形成
(HCl分子) H2和Cl2作用生成HCl的反应过程: 一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。10、化学反应本质 在下列化学反应中,既有离子键、极性键断裂,又有离子键、极性键形成的是( )
A.Na2O+H2O=2NaOH
B.SO2+H2O=H2SO3
C.Cl2+H2O=HCl+HClO
D.4Li+O2 2Li2O
A【思考与交流】11.分子间作用力(范德华力)(1)分子间作用力比化学键弱得多;(2)对物质的熔、沸点等有影响;(3)一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点也越高。(1)NH3、H2O和HF的分子间存在着一种比分子间作用力稍强的相互作用,叫做氢键。
(2)氢键比化学键弱,不属于化学键,可以把分子间的氢键看做是一种较强的分子间作用力。
(3)氢键的存在可使物质的熔、沸点升高。
(4)冰中氢键的存在使冰的结构中有空隙,造成其密度低于液态水。12.氢键
