温州市直十校联盟2010学年第二学期期中试卷
文档属性
| 名称 | 温州市直十校联盟2010学年第二学期期中试卷 |  | |
| 格式 | rar | ||
| 文件大小 | 117.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-04-25 10:07:00 | ||
图片预览



文档简介
温州市直十校联盟2010学年第二学期期中试卷
高一化学学科
完卷时间:90分钟; 满分:100分
相对原子质量 H 1 C 12 O 16 Na 23 Cl 35.5 K 39 S 32 N14
Ⅰ卷 (共48分)
一、选择题(每小题只有一个正确选项,每小题2分,共48分)
1.科学家根据理论推算,周期表可能推到第218号元素。164号元素582X半衰期将是以亿年计算,性质与铅相类似,核却蕴藏着巨大的核能,能量将比氢弹爆发的能量还大千万倍,但却没有原子弹,氢弹那种对人类造成的雪崩式辅射的威胁。关于一个该元素原子582X中质子数、中子数、电子数之和是
A.382 B.582 C.746 D.800
2.未来人类最理想的燃料是
A.无烟煤 B.石油 C.天然气 D.氢气
3.下列原子最易形成阴离子的是
A. Cl? B. F C. Na?? ? D. K
4.在下列元素中,不属于主族元素的是
A.氢 B.铁 C.钙 D.碘
5.元素性质呈现周期性变化的根本原因是
A.元素的相对原子质量递增,量变引起质变 B.元素的原子半径呈周期性变化
C.元素原子的核外电子排布呈周期性变化 D.元素的化合价呈周期性变化
6.下列物质中,既有离子键,又有共价键的是
A.CaCl2?? ?? B.Na2O????? C.H2O??? ? D.NH4Cl
7.下列递变规律正确的是
A.HClO4、H2SO4、H3PO4的酸性依次增强 B.HCl、HBr 、HI的稳定性依次增强
C.钠、镁、铝的还原性依次减弱 D.N、O、F原子半径逐渐增大
8.下列电子式中,正确的是
A. ∶N∶∶∶N∶ B. C. D. Na+[∶Cl∶] -
9.下列变化中,不需要破坏化学键的是
A.氯化氢溶于水 B.加热氯酸钾使其分解
C.碘升华 D.氯化钠溶于水
10.某元素X的气态氢化物化学式为H2X,则X的最高价氧化物的水化物的化学式可能为
A.H2XO3 B.HXO3 C.H3XO4 D.H2XO4
11.下列事实不能用来判断金属性强弱的是
A.金属间在溶液中发生置换反应
B.1 mol金属单质在反应中失去电子的多少
C.金属元素的最高价氧化物的水化物的碱性强弱
D.金属单质与水或酸置换出氢气的难易
12.57号镧元素(La)是一种活泼性比铁还强的金属元素,La的氧化物的化学式为La2O3,La(OH)3是不溶于水的碱,La的氯化物、硝酸盐均易溶于水,下列各组物质中不能直接反应得到LaCl3的是
A.La2O3+HCl B.La+Cl2
C.La(OH)3+HCl D.La(NO3)3+HCl
13.原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1。下列有关元素X的说法中错误的是
A.元素X能形成化学式为X(OH)3的碱
B.元素X可能形成化学式为KXO3的含氧酸钾盐
C.元素X原子的最外层电子数和核电荷数肯定为奇数
D.元素X能与某些金属元素形成化合物
14.在2A+B 3C+4D反应中,表示该反应速率最快的是
A.v(A)=0.5mol·L-1· s-1 B.v(B)=0.3 mol·L-1· s-1
C.v(C)=0.8 mol·L-1· s-1 D.v(D)=1 mol·L-1· s-1
15.将2molS02和1molO2放入一个容器中,在一定的条件下反应到达平衡状态,此时,容器存在的各物质的量中,其中不可能的是:
①0molS02 ②1mol S02 ③2mol S03 ④0.3molO2 ⑤0.1molSO3 ⑥1molO2
A. ②⑤⑥ B. ①③⑥ C. ③④⑥ D. ②④⑤
16.根据方程式: 4P(红磷s) === P4(白磷s) △H=+17kJ·mol-1,下列推论正确的是
A.当lmol白磷转变成红磷时放出17kJ热量
B.当4g红磷转变成白磷时吸收17kJ热量
C.正反应是一个放热反应
D.发生了物理变化,吸收的热量用于克服分子间作用力
17.下列属于直接利用太阳辐射能的方式的是
①光-热转换 ②光-电转换 ③光-化学能转换 ④光-生物质能转换
A.①②③ B.①③④ C.①②④ D.①②③④
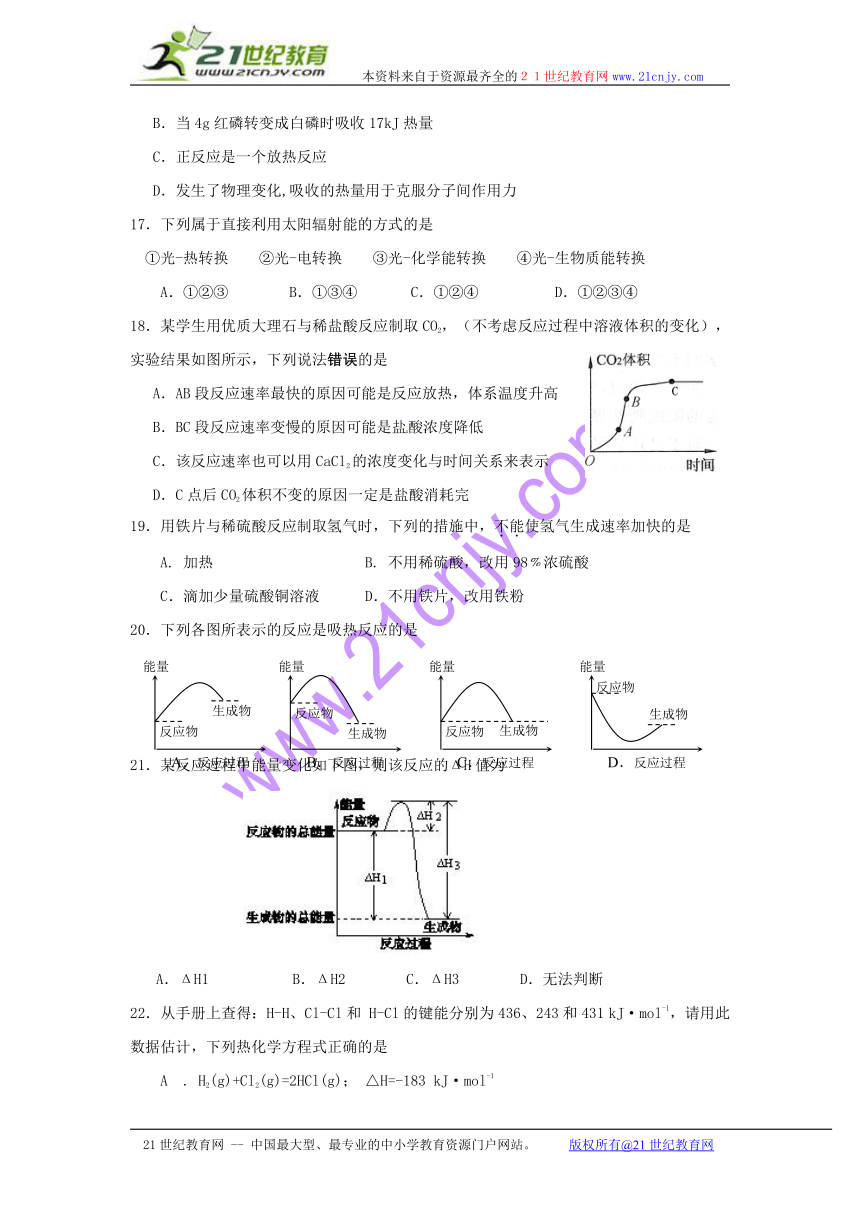
18.某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积的变化),实验结果如图所示,下列说法错误的是
A.AB段反应速率最快的原因可能是反应放热,体系温度升高
B.BC段反应速率变慢的原因可能是盐酸浓度降低
C.该反应速率也可以用CaCl2的浓度变化与时间关系来表示
D.C点后CO2体积不变的原因一定是盐酸消耗完
19.用铁片与稀硫酸反应制取氢气时,下列的措施中,不能使氢气生成速率加快的是
A. 加热 B. 不用稀硫酸,改用98﹪浓硫酸
C.滴加少量硫酸铜溶液 D.不用铁片,改用铁粉
20.下列各图所表示的反应是吸热反应的是
21.某反应过程中能量变化如下图,则该反应的ΔH值为
A.ΔH1 B.ΔH2 C.ΔH3 D.无法判断
22.从手册上查得:H-H、Cl-Cl和 H-Cl的键能分别为436、243和431 kJ·mol-1,请用此数据估计,下列热化学方程式正确的是
A?. H2(g)+Cl2(g)=2HCl(g); △H=-183 kJ·mol-1????
B?.?H2(g)+Cl2(g)=2HCl(g); △H=+183kJ·mol-1???
C?. H2(g)+Cl2(g)=2HCl(g);△H=-91.5kJ·mol-1?????
D?. H2(g)+Cl2(g)=2HCl(g);△H=+91.5kJ·mol-1?
23.下列装置中能构成原电池的是
24.下列叙述中不正确的是
A.电解池的阳极上发生氧化反应,阴极上发生还原反应
B.原电池的正极上发生氧化反应,负极上发生还原反应
C.电镀时,电镀池里的阳极材料发生氧化反应
D.用原电池做电源进行电解时,电子从原电池负极流向电解池阴极
II卷(共52分)
二、填空题(共22分)
25(6分).下列各组物质属于同分异构体的是 ,属于同素异形体的是 , 属于同位素的是 。(填序号)
① 红磷与白磷 ②12C和14C ③干冰与二氧化碳 ④ NH4CNO与CO(NH2)2
⑤S2与S8 ⑥ 235U与238U ⑦乙醇与二甲醚 ⑧冰与水
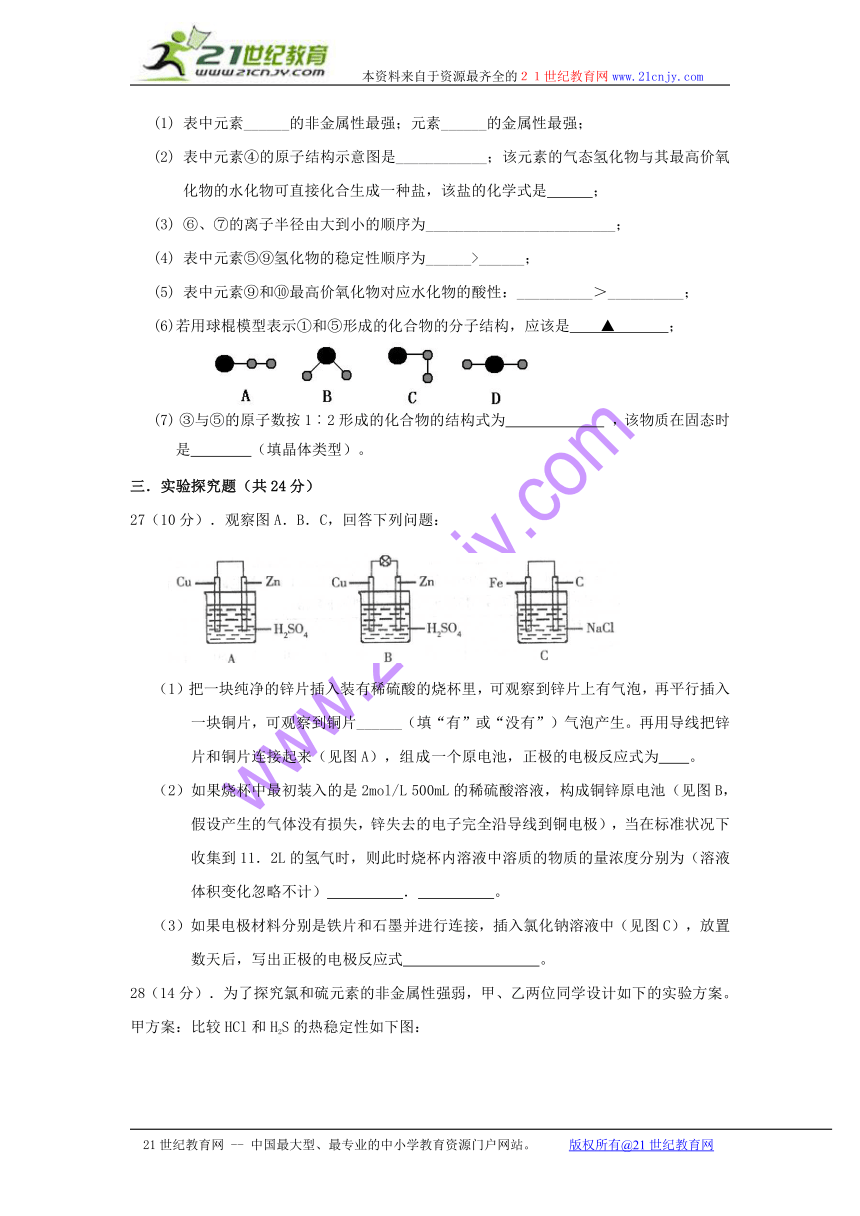
26(16). 下表为元素周期表中的一部分,表中列出10种元素在周期表中的位置,都用化学用语回答下列问题
族 周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
一
①
二
②
③
④
⑤
⑥
三
⑦
⑧
⑨
⑩
(1) 表中元素______的非金属性最强;元素______的金属性最强;
(2) 表中元素④的原子结构示意图是____________;该元素的气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐,该盐的化学式是 ;
(3) ⑥、⑦的离子半径由大到小的顺序为_________________________;
(4) 表中元素⑤⑨氢化物的稳定性顺序为______>______;
(5) 表中元素⑨和⑩最高价氧化物对应水化物的酸性:__________>__________;
(6)若用球棍模型表示①和⑤形成的化合物的分子结构,应该是 ▲ ;
(7) ③与⑤的原子数按1︰2形成的化合物的结构式为 ,该物质在固态时是 (填晶体类型)。
三.实验探究题(共24分)
27(10分).观察图A.B.C,回答下列问题:
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片______(填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为 。
(2)如果烧杯中最初装入的是2mol/L 500mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线到铜电极),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计) . 。
(3)如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,写出正极的电极反应式 。
28(14分).为了探究氯和硫元素的非金属性强弱,甲、乙两位同学设计如下的实验方案。 甲方案:比较HCl和H2S的热稳定性如下图:
(1)若(I)和(II)相连接,检查气密性的方法是先 ,然后用酒精灯微热D管,F中的导管有气泡产生,停止微热后,F中的导管有形成一段水柱。
(2)若(I)和(II)相连接,打开K,从A中通入HCl,并加热,发现F中的溶液没有变蓝,说明 ,E瓶的作用是 。
(3)若(I)和(III)相连接,从A中先通入H2S,然后才能加热,发现E瓶有淡黄色物质产生,说明 ,F瓶中NaOH作用是 。
(4)甲的方案可以得出结论是:氯的非金属性 (小于、大于)硫非金属性。乙同学的方案是在盛有Na2S溶液的试管中通入少量的氯气也可以得出上述结论,该反应的离子方程式为 。
四、计算题:(共6分)
29(6分).t℃时,将3molA和1molB气体通入容积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)xC(g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol·L-1。请计算:
(1)从反应开始到平衡状态,生成C的平均反应速率;
(2)反应达到平衡状态时A的浓度;
(3)求x的值。
温州市直十校联盟2010学年第二学期期中试卷
高一化学学科答题卷
一、选择题(每小题只有一个正确选项,每小题2分,共48分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
题号
13
14
15
16
17
18
19
20
21
22
23
24
答案
二、填空题(共22分)
25(6分).
, , 。(填序号)
26(16分).
(1) ______;______;(2) ____________;
(3) _____________________。(4) ______>______;
(5) __________>_______ ___。 (6) 。
(7) ____________; 。
三.实验探究题(共24分)
27(10分).
(1)______; 。
(2) . 。
(3) 。
28(14分).
(1)
(2) , 。
(3) , 。
(4) (小于、大于)。 。
四、计算题:(共6分)
29(6分).
(1)
(2)
(3)
温州市直十校联盟2010学年第二学期期中试卷
高一化学学科答案与评分标准
一、选择题(每小题只有一个正确选项,每小题2分,共48分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
C
D
B
B
C
D
C
B
C
D
B
D
题号
13
14
15
16
17
18
19
20
21
22
23
24
答案
A
D
B
C
D
D
B
A
A
A
C
B
二、填空题(共22分)
25(6分).④⑦; ①⑤; ②⑥; (答对一个给一分)
26(16分).
(1) F(1分);Na(1分); (2) 结构示意图(略)(1分);NH4NO3(1分)
(3) F—>Na+(2分) (4)H2O>H2S(2分); (5) HClO4>H2SO4 (2分)
(6)B(2分) (7)结构式(略)(2分),分子晶体。(2分)
三.实验探究题(共24分)
27.(10分).
(1)没有(2分) 2H++2e-=H2↑(2分)
(2)c(H2SO4)=1mol/L(2分) c(ZnSO4)=1mol/L(2分)
(3)O2+2H2O+4e-=4OH-(2分)
28.(14分)
(1)夹紧止水夹K,在F中加水浸没导管(每点1分,不分先后,共2分)
(2)HCl很难分解(2分), 防止倒吸 (2分)
(3) H2S易分解(2分) , 尾气吸收 (2分)
(4)大于 (2分) S2—+Cl2=2 Cl—+S↓ (2分)
四、计算题:(共6分)
29.(6分)(1) 0.2mol·L-1·min-1 (2分)
(2)1.2mol·L-1(2分)
(3) x=4(2分)
温州市直十校联盟考试命题双向细目表
(2010学年第2学期期中考试 化学学科高一年级)
命题人 王德祥 审题人 叶海双 2011年4月4日
题号
知识点
题型
学习水平
分数
期望难度
1
原子结构
选择题
了解
2
基础
2
能源
选择题
识记
2
基础
3
元素的非金属性
选择题
识记
2
基础
4
元素周期表
选择题
识记
2
基础
5
元素周期律的本质
选择题
识记
2
基础
6
化学键的判断
选择题
了解
2
基础
7
元素周期律
选择题
了解
2
基础
8
电子式
选择题
识记
2
基础
9
化学键
选择题
理解
2
中等
10
化合价的应用
选择题
识记
2
基础
11
元素金属性的判断
选择题
理解
2
中等
12
未知元素性质的推断
选择题
理解
2
中等
13
元素性质的推断
选择题
理解
2
较难
14
化学反应速率
选择题
识记
2
基础
15
化学平衡基础
选择题
了解
2
基础
16
热化学方程式概念
选择题
了解
2
基础
17
能量的转化
选择题
了解
2
基础
18
反应速率与图像
选择题
理解
2
中等
19
影响反应速率的因素
选择题
运用
2
较难
20
吸热反应的能量图
选择题
了解
2
基础
21
反应能量变化图
选择题
了解
2
基础
22
热化学方程式书写
选择题
了解
2
中等
23
原电池装置识别
选择题
识记
2
基础
24
电化学综合
选择题
理解、运用
2
中等、较难
25
“五同”概念辨析
填空题
识记
6
基础
26
元素周期表的综合应用
填空题
识记、理解
16
基础、中等
27
原电池的实验
实验题
识记、理解
10
基础、中等、较难
28
探究非金属性强弱的实验
实验题
理解
14
中等、较难
29
有关化学反应速率与平衡的计算
计算题
了解
6
基础、中等
高一化学学科
完卷时间:90分钟; 满分:100分
相对原子质量 H 1 C 12 O 16 Na 23 Cl 35.5 K 39 S 32 N14
Ⅰ卷 (共48分)
一、选择题(每小题只有一个正确选项,每小题2分,共48分)
1.科学家根据理论推算,周期表可能推到第218号元素。164号元素582X半衰期将是以亿年计算,性质与铅相类似,核却蕴藏着巨大的核能,能量将比氢弹爆发的能量还大千万倍,但却没有原子弹,氢弹那种对人类造成的雪崩式辅射的威胁。关于一个该元素原子582X中质子数、中子数、电子数之和是
A.382 B.582 C.746 D.800
2.未来人类最理想的燃料是
A.无烟煤 B.石油 C.天然气 D.氢气
3.下列原子最易形成阴离子的是
A. Cl? B. F C. Na?? ? D. K
4.在下列元素中,不属于主族元素的是
A.氢 B.铁 C.钙 D.碘
5.元素性质呈现周期性变化的根本原因是
A.元素的相对原子质量递增,量变引起质变 B.元素的原子半径呈周期性变化
C.元素原子的核外电子排布呈周期性变化 D.元素的化合价呈周期性变化
6.下列物质中,既有离子键,又有共价键的是
A.CaCl2?? ?? B.Na2O????? C.H2O??? ? D.NH4Cl
7.下列递变规律正确的是
A.HClO4、H2SO4、H3PO4的酸性依次增强 B.HCl、HBr 、HI的稳定性依次增强
C.钠、镁、铝的还原性依次减弱 D.N、O、F原子半径逐渐增大
8.下列电子式中,正确的是
A. ∶N∶∶∶N∶ B. C. D. Na+[∶Cl∶] -
9.下列变化中,不需要破坏化学键的是
A.氯化氢溶于水 B.加热氯酸钾使其分解
C.碘升华 D.氯化钠溶于水
10.某元素X的气态氢化物化学式为H2X,则X的最高价氧化物的水化物的化学式可能为
A.H2XO3 B.HXO3 C.H3XO4 D.H2XO4
11.下列事实不能用来判断金属性强弱的是
A.金属间在溶液中发生置换反应
B.1 mol金属单质在反应中失去电子的多少
C.金属元素的最高价氧化物的水化物的碱性强弱
D.金属单质与水或酸置换出氢气的难易
12.57号镧元素(La)是一种活泼性比铁还强的金属元素,La的氧化物的化学式为La2O3,La(OH)3是不溶于水的碱,La的氯化物、硝酸盐均易溶于水,下列各组物质中不能直接反应得到LaCl3的是
A.La2O3+HCl B.La+Cl2
C.La(OH)3+HCl D.La(NO3)3+HCl
13.原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1。下列有关元素X的说法中错误的是
A.元素X能形成化学式为X(OH)3的碱
B.元素X可能形成化学式为KXO3的含氧酸钾盐
C.元素X原子的最外层电子数和核电荷数肯定为奇数
D.元素X能与某些金属元素形成化合物
14.在2A+B 3C+4D反应中,表示该反应速率最快的是
A.v(A)=0.5mol·L-1· s-1 B.v(B)=0.3 mol·L-1· s-1
C.v(C)=0.8 mol·L-1· s-1 D.v(D)=1 mol·L-1· s-1
15.将2molS02和1molO2放入一个容器中,在一定的条件下反应到达平衡状态,此时,容器存在的各物质的量中,其中不可能的是:
①0molS02 ②1mol S02 ③2mol S03 ④0.3molO2 ⑤0.1molSO3 ⑥1molO2
A. ②⑤⑥ B. ①③⑥ C. ③④⑥ D. ②④⑤
16.根据方程式: 4P(红磷s) === P4(白磷s) △H=+17kJ·mol-1,下列推论正确的是
A.当lmol白磷转变成红磷时放出17kJ热量
B.当4g红磷转变成白磷时吸收17kJ热量
C.正反应是一个放热反应
D.发生了物理变化,吸收的热量用于克服分子间作用力
17.下列属于直接利用太阳辐射能的方式的是
①光-热转换 ②光-电转换 ③光-化学能转换 ④光-生物质能转换
A.①②③ B.①③④ C.①②④ D.①②③④
18.某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积的变化),实验结果如图所示,下列说法错误的是
A.AB段反应速率最快的原因可能是反应放热,体系温度升高
B.BC段反应速率变慢的原因可能是盐酸浓度降低
C.该反应速率也可以用CaCl2的浓度变化与时间关系来表示
D.C点后CO2体积不变的原因一定是盐酸消耗完
19.用铁片与稀硫酸反应制取氢气时,下列的措施中,不能使氢气生成速率加快的是
A. 加热 B. 不用稀硫酸,改用98﹪浓硫酸
C.滴加少量硫酸铜溶液 D.不用铁片,改用铁粉
20.下列各图所表示的反应是吸热反应的是
21.某反应过程中能量变化如下图,则该反应的ΔH值为
A.ΔH1 B.ΔH2 C.ΔH3 D.无法判断
22.从手册上查得:H-H、Cl-Cl和 H-Cl的键能分别为436、243和431 kJ·mol-1,请用此数据估计,下列热化学方程式正确的是
A?. H2(g)+Cl2(g)=2HCl(g); △H=-183 kJ·mol-1????
B?.?H2(g)+Cl2(g)=2HCl(g); △H=+183kJ·mol-1???
C?. H2(g)+Cl2(g)=2HCl(g);△H=-91.5kJ·mol-1?????
D?. H2(g)+Cl2(g)=2HCl(g);△H=+91.5kJ·mol-1?
23.下列装置中能构成原电池的是
24.下列叙述中不正确的是
A.电解池的阳极上发生氧化反应,阴极上发生还原反应
B.原电池的正极上发生氧化反应,负极上发生还原反应
C.电镀时,电镀池里的阳极材料发生氧化反应
D.用原电池做电源进行电解时,电子从原电池负极流向电解池阴极
II卷(共52分)
二、填空题(共22分)
25(6分).下列各组物质属于同分异构体的是 ,属于同素异形体的是 , 属于同位素的是 。(填序号)
① 红磷与白磷 ②12C和14C ③干冰与二氧化碳 ④ NH4CNO与CO(NH2)2
⑤S2与S8 ⑥ 235U与238U ⑦乙醇与二甲醚 ⑧冰与水
26(16). 下表为元素周期表中的一部分,表中列出10种元素在周期表中的位置,都用化学用语回答下列问题
族 周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
一
①
二
②
③
④
⑤
⑥
三
⑦
⑧
⑨
⑩
(1) 表中元素______的非金属性最强;元素______的金属性最强;
(2) 表中元素④的原子结构示意图是____________;该元素的气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐,该盐的化学式是 ;
(3) ⑥、⑦的离子半径由大到小的顺序为_________________________;
(4) 表中元素⑤⑨氢化物的稳定性顺序为______>______;
(5) 表中元素⑨和⑩最高价氧化物对应水化物的酸性:__________>__________;
(6)若用球棍模型表示①和⑤形成的化合物的分子结构,应该是 ▲ ;
(7) ③与⑤的原子数按1︰2形成的化合物的结构式为 ,该物质在固态时是 (填晶体类型)。
三.实验探究题(共24分)
27(10分).观察图A.B.C,回答下列问题:
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片______(填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为 。
(2)如果烧杯中最初装入的是2mol/L 500mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线到铜电极),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计) . 。
(3)如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,写出正极的电极反应式 。
28(14分).为了探究氯和硫元素的非金属性强弱,甲、乙两位同学设计如下的实验方案。 甲方案:比较HCl和H2S的热稳定性如下图:
(1)若(I)和(II)相连接,检查气密性的方法是先 ,然后用酒精灯微热D管,F中的导管有气泡产生,停止微热后,F中的导管有形成一段水柱。
(2)若(I)和(II)相连接,打开K,从A中通入HCl,并加热,发现F中的溶液没有变蓝,说明 ,E瓶的作用是 。
(3)若(I)和(III)相连接,从A中先通入H2S,然后才能加热,发现E瓶有淡黄色物质产生,说明 ,F瓶中NaOH作用是 。
(4)甲的方案可以得出结论是:氯的非金属性 (小于、大于)硫非金属性。乙同学的方案是在盛有Na2S溶液的试管中通入少量的氯气也可以得出上述结论,该反应的离子方程式为 。
四、计算题:(共6分)
29(6分).t℃时,将3molA和1molB气体通入容积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)xC(g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol·L-1。请计算:
(1)从反应开始到平衡状态,生成C的平均反应速率;
(2)反应达到平衡状态时A的浓度;
(3)求x的值。
温州市直十校联盟2010学年第二学期期中试卷
高一化学学科答题卷
一、选择题(每小题只有一个正确选项,每小题2分,共48分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
题号
13
14
15
16
17
18
19
20
21
22
23
24
答案
二、填空题(共22分)
25(6分).
, , 。(填序号)
26(16分).
(1) ______;______;(2) ____________;
(3) _____________________。(4) ______>______;
(5) __________>_______ ___。 (6) 。
(7) ____________; 。
三.实验探究题(共24分)
27(10分).
(1)______; 。
(2) . 。
(3) 。
28(14分).
(1)
(2) , 。
(3) , 。
(4) (小于、大于)。 。
四、计算题:(共6分)
29(6分).
(1)
(2)
(3)
温州市直十校联盟2010学年第二学期期中试卷
高一化学学科答案与评分标准
一、选择题(每小题只有一个正确选项,每小题2分,共48分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
C
D
B
B
C
D
C
B
C
D
B
D
题号
13
14
15
16
17
18
19
20
21
22
23
24
答案
A
D
B
C
D
D
B
A
A
A
C
B
二、填空题(共22分)
25(6分).④⑦; ①⑤; ②⑥; (答对一个给一分)
26(16分).
(1) F(1分);Na(1分); (2) 结构示意图(略)(1分);NH4NO3(1分)
(3) F—>Na+(2分) (4)H2O>H2S(2分); (5) HClO4>H2SO4 (2分)
(6)B(2分) (7)结构式(略)(2分),分子晶体。(2分)
三.实验探究题(共24分)
27.(10分).
(1)没有(2分) 2H++2e-=H2↑(2分)
(2)c(H2SO4)=1mol/L(2分) c(ZnSO4)=1mol/L(2分)
(3)O2+2H2O+4e-=4OH-(2分)
28.(14分)
(1)夹紧止水夹K,在F中加水浸没导管(每点1分,不分先后,共2分)
(2)HCl很难分解(2分), 防止倒吸 (2分)
(3) H2S易分解(2分) , 尾气吸收 (2分)
(4)大于 (2分) S2—+Cl2=2 Cl—+S↓ (2分)
四、计算题:(共6分)
29.(6分)(1) 0.2mol·L-1·min-1 (2分)
(2)1.2mol·L-1(2分)
(3) x=4(2分)
温州市直十校联盟考试命题双向细目表
(2010学年第2学期期中考试 化学学科高一年级)
命题人 王德祥 审题人 叶海双 2011年4月4日
题号
知识点
题型
学习水平
分数
期望难度
1
原子结构
选择题
了解
2
基础
2
能源
选择题
识记
2
基础
3
元素的非金属性
选择题
识记
2
基础
4
元素周期表
选择题
识记
2
基础
5
元素周期律的本质
选择题
识记
2
基础
6
化学键的判断
选择题
了解
2
基础
7
元素周期律
选择题
了解
2
基础
8
电子式
选择题
识记
2
基础
9
化学键
选择题
理解
2
中等
10
化合价的应用
选择题
识记
2
基础
11
元素金属性的判断
选择题
理解
2
中等
12
未知元素性质的推断
选择题
理解
2
中等
13
元素性质的推断
选择题
理解
2
较难
14
化学反应速率
选择题
识记
2
基础
15
化学平衡基础
选择题
了解
2
基础
16
热化学方程式概念
选择题
了解
2
基础
17
能量的转化
选择题
了解
2
基础
18
反应速率与图像
选择题
理解
2
中等
19
影响反应速率的因素
选择题
运用
2
较难
20
吸热反应的能量图
选择题
了解
2
基础
21
反应能量变化图
选择题
了解
2
基础
22
热化学方程式书写
选择题
了解
2
中等
23
原电池装置识别
选择题
识记
2
基础
24
电化学综合
选择题
理解、运用
2
中等、较难
25
“五同”概念辨析
填空题
识记
6
基础
26
元素周期表的综合应用
填空题
识记、理解
16
基础、中等
27
原电池的实验
实验题
识记、理解
10
基础、中等、较难
28
探究非金属性强弱的实验
实验题
理解
14
中等、较难
29
有关化学反应速率与平衡的计算
计算题
了解
6
基础、中等
同课章节目录
