元素周期律1
图片预览










文档简介
课件54张PPT。(1)一、原子核外电子的排布 1.电子层的划分 一、原子核外电子的排布 1.电子层的划分 电子层(用n表示) 1、2、3、4……电子层符号 K、L、M、N……一、原子核外电子的排布 1.电子层的划分 电子层(用n表示) 1、2、3、4……电子层符号 K、L、M、N……离核距离 近 远能量高低 低 高一、原子核外电子的排布 2. 核外电子的排布规律2. 核外电子的排布规律 (1) 各电子层最多容纳的电子数是2n2(n
表示电子层)
(2) 最外层电子数不超过8个(K层是最外
层时,最多不超过2个);次外层电子数目不
超过18个,倒数第三层不超过32个。
(3) 核外电子总是尽先排布在能量最低
的电子层,然后由里向外从能量低的电子层
逐步向能量高的电子层排布(即排满K层再排
L层,排满L层才排M层)。[练习]
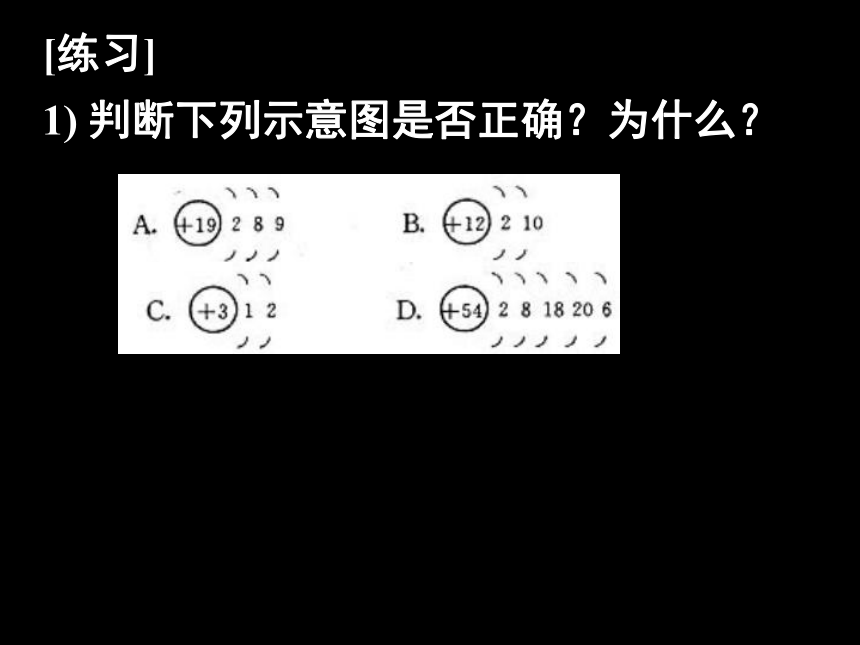
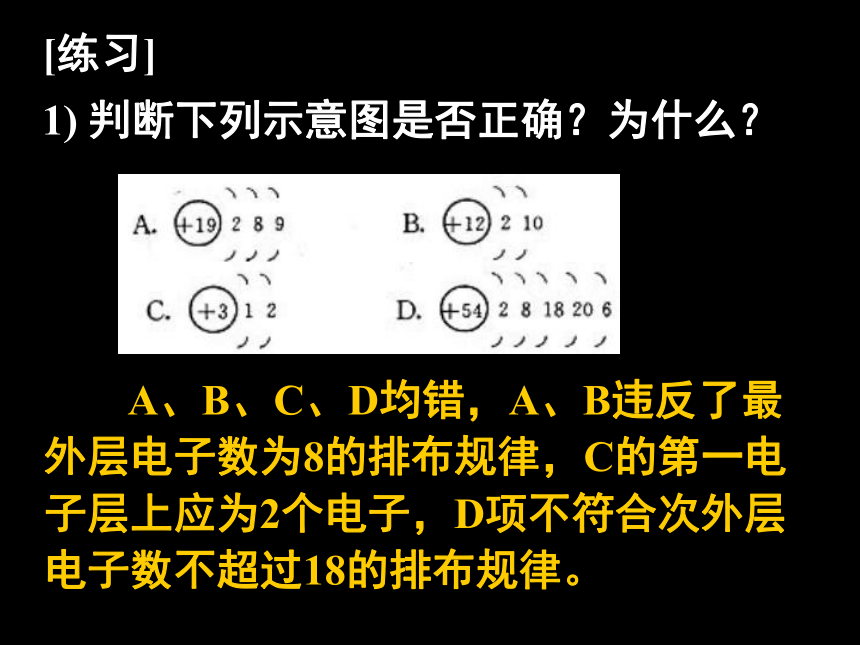
1) 判断下列示意图是否正确?为什么?[练习]
1) 判断下列示意图是否正确?为什么? A、B、C、D均错,A、B违反了最外层电子数为8的排布规律,C的第一电子层上应为2个电子,D项不符合次外层电子数不超过18的排布规律。 2. 用1-18号元素的原子回答下列问题:
(1)最外层有2个电子的是:( ) (2)最外层电子数等于次外层电子数的有( )
(3)最外层电子数是次外层电子数2倍的是:( ) (4)最外层电子数是最内层电子数一半的是: ( ) (5)最外层电子数是内层电子数一半的是:( ) (6)电子层数与最外层电子数相等的是:( )试一试:写出符合下列条件的短周期元素,画出A, B, C, D的原子结构示意图 A. 元素原子最外层电子数为次外层电子数的3倍; B. 元素M层电子是L层电子的1/2; C. 元素原子的L层电子数与K层电子数之差是电子层数的2.5倍. D. 元素原子次外层电子数是最外层电子数的1/4Mg2+ F- Br- Ca2+3. 离子结构示意图1) 写出下列离子的离子结构示意图:Mg2+ F- Br- Ca2+3. 离子结构示意图1) 写出下列离子的离子结构示意图: (1) 当质子数(核电荷数) =核外电子数时,该粒子是 _______,______ 电性。 (2) 当质子数(核电荷数)>核外电子数时,该粒子是 _____ 离子,带 ______ 电荷。 (3) 当质子数(核电荷数)<核外电子数时,该粒子是 ______ 离子,带 _______ 电荷。2) 填空 (1) 当质子数(核电荷数) =核外电子数时,该粒子是 _______,______ 电性。 (2) 当质子数(核电荷数)>核外电子数时,该粒子是 _____ 离子,带 ______ 电荷。 (3) 当质子数(核电荷数)<核外电子数时,该粒子是 ______ 离子,带 _______ 电荷。原子不显2) 填空 (1) 当质子数(核电荷数) =核外电子数时,该粒子是 _______,______ 电性。 (2) 当质子数(核电荷数)>核外电子数时,该粒子是 _____ 离子,带 ______ 电荷。 (3) 当质子数(核电荷数)<核外电子数时,该粒子是 ______ 离子,带 _______ 电荷。原子不显阳正2) 填空 (1) 当质子数(核电荷数) =核外电子数时,该粒子是 _______,______ 电性。 (2) 当质子数(核电荷数)>核外电子数时,该粒子是 _____ 离子,带 ______ 电荷。 (3) 当质子数(核电荷数)<核外电子数时,该粒子是 ______ 离子,带 _______ 电荷。原子不显阳正阴负2) 填空 [参考练习] 1. 若aAn+与bB2-两种离子的核外电子 层结构相同,则a的数值为( ) A. b+n+2 B. b+n-2 C. b-n-2 D. b-n+2 2. 某元素的核电荷数是电子层数的5 倍,其质子数是最外层电子数的3倍,该 元素的原子结构示意图为_____________[参考练习] 1. 若aAn+与bB2-两种离子的核外电子 层结构相同,则a的数值为( ) A. b+n+2 B. b+n-2 C. b-n-2 D. b-n+2 2. 某元素的核电荷数是电子层数的5 倍,其质子数是最外层电子数的3倍,该 元素的原子结构示意图为_____________A[参考练习] 1. 若aAn+与bB2-两种离子的核外电子 层结构相同,则a的数值为( ) A. b+n+2 B. b+n-2 C. b-n-2 D. b-n+2 2. 某元素的核电荷数是电子层数的5 倍,其质子数是最外层电子数的3倍,该 元素的原子结构示意图为_____________A 请阅读1-18号元素核外电子的排布,找出每一周期最外层电子的排布规律。123882123882周期性周期性 在元素周期表中找出原子半径最大的元素和原子半径最小的元素。 2. 当电子层数相同时,核内质子数越 小, 半径越大, 如: Na>Mg; F->Na+小结微粒半径的比较方法: 1. 先比较电子层数,电子层数越多,半径越大, 如:S>C 3. 阴离子半径>其原子半径, 如: Cl- >Cl元素的主要化合价及实例+10元素的主要化合价及实例+10H2OHe元素的主要化合价及实例+10H2OHe+1+2+3+4,
-4+5,
-3-2-10元素的主要化合价及实例+10H2OHe+1+2+3+4,
-4+5,
-3-2-10Li2OBeCl2BF3CO2
CH4HNO3
NH3H2OHFNe元素的主要化合价及实例周期性+1+1+5-4-10+1+7-4-1000 1. 在下列元素中,最高正化合价数值最大的是 A. Na B. P C. Cl D. Ar 2. 某元素最高价氧化物水化物的化学式为H2RO4,则其氢化物的化学式为 A. HR B. H2R C. RH3 D. RH4 1. 在下列元素中,最高正化合价数值最大的是 A. Na B. P C. Cl D. Ar 2. 某元素最高价氧化物水化物的化学式为H2RO4,则其氢化物的化学式为 A. HR B. H2R C. RH3 D. RH4 1. 在下列元素中,最高正化合价数值最大的是 A. Na B. P C. Cl D. Ar 2. 某元素最高价氧化物水化物的化学式为H2RO4,则其氢化物的化学式为 A. HR B. H2R C. RH3 D. RH4小结:随着原子序数的递增 元素原子的核外电子排布呈现周期性变化 元素原子半径呈现周期性变化 元素化合价呈现周期性变化 元素的性质随着元素原子序数的递增而呈周期性变化,这个规律叫元素周期律。***课堂练习******课堂练习***B C 2. 原子序数从3~10的元素,随着核电荷数的递增而逐渐增大的是( ) A.电子层数 B.电子数 C.原子半径 D.化合价 3. 元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( ) A. XY2 B. X2Y3 C. X3Y2 D. X2Y 2. 原子序数从3~10的元素,随着核电荷数的递增而逐渐增大的是( ) A.电子层数 B.电子数 C.原子半径 D.化合价 3. 元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( ) A. XY2 B. X2Y3 C. X3Y2 D. X2Y 2. 原子序数从3~10的元素,随着核电荷数的递增而逐渐增大的是( ) A.电子层数 B.电子数 C.原子半径 D.化合价 3. 元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( ) A. XY2 B. X2Y3 C. X3Y2 D. X2Y+51+517+517S2->Y- 5. 今有甲、乙、丙、丁四种元素。已知:甲元素是自然界中含量最多的元素;乙元素为金属元素,它的原子核外K层、L层电子数之和等于M、N层电子数之和;丙元素的单质及其化合物的焰色反应都显黄色;氢气在丁元素单质中燃烧火焰呈苍白色。 试推断并写出甲、乙、丙、丁四种元素的名称和符号; 5. 今有甲、乙、丙、丁四种元素。已知:甲元素是自然界中含量最多的元素;乙元素为金属元素,它的原子核外K层、L层电子数之和等于M、N层电子数之和;丙元素的单质及其化合物的焰色反应都显黄色;氢气在丁元素单质中燃烧火焰呈苍白色。 试推断并写出甲、乙、丙、丁四种元素的名称和符号; 甲为氧元素,O;乙为钙元素,Ca;丙为钠元素,Na;丁为氯元素,Cl; 6. 已知X、Y均为1~18号之间的元素,X、Y可形成化合物X2Y和X2Y2,又知Y的原子序数小于X的原子序数,则两种元素的原子序数之和为( ) A.19 B.18 C. 27 D. 9 6. 已知X、Y均为1~18号之间的元素,X、Y可形成化合物X2Y和X2Y2,又知Y的原子序数小于X的原子序数,则两种元素的原子序数之和为( ) A.19 B.18 C. 27 D. 9
(1)最外层有2个电子的是:( ) (2)最外层电子数等于次外层电子数的有( )
(3)最外层电子数是次外层电子数2倍的是:( ) (4)最外层电子数是最内层电子数一半的是: ( ) (5)最外层电子数是内层电子数一半的是:( ) (6)电子层数与最外层电子数相等的是:( )试一试:写出符合下列条件的短周期元素,画出A, B, C, D的原子结构示意图 A. 元素原子最外层电子数为次外层电子数的3倍; B. 元素M层电子是L层电子的1/2; C. 元素原子的L层电子数与K层电子数之差是电子层数的2.5倍. D. 元素原子次外层电子数是最外层电子数的1/4Mg2+ F- Br- Ca2+3. 离子结构示意图1) 写出下列离子的离子结构示意图:Mg2+ F- Br- Ca2+3. 离子结构示意图1) 写出下列离子的离子结构示意图: (1) 当质子数(核电荷数) =核外电子数时,该粒子是 _______,______ 电性。 (2) 当质子数(核电荷数)>核外电子数时,该粒子是 _____ 离子,带 ______ 电荷。 (3) 当质子数(核电荷数)<核外电子数时,该粒子是 ______ 离子,带 _______ 电荷。2) 填空 (1) 当质子数(核电荷数) =核外电子数时,该粒子是 _______,______ 电性。 (2) 当质子数(核电荷数)>核外电子数时,该粒子是 _____ 离子,带 ______ 电荷。 (3) 当质子数(核电荷数)<核外电子数时,该粒子是 ______ 离子,带 _______ 电荷。原子不显2) 填空 (1) 当质子数(核电荷数) =核外电子数时,该粒子是 _______,______ 电性。 (2) 当质子数(核电荷数)>核外电子数时,该粒子是 _____ 离子,带 ______ 电荷。 (3) 当质子数(核电荷数)<核外电子数时,该粒子是 ______ 离子,带 _______ 电荷。原子不显阳正2) 填空 (1) 当质子数(核电荷数) =核外电子数时,该粒子是 _______,______ 电性。 (2) 当质子数(核电荷数)>核外电子数时,该粒子是 _____ 离子,带 ______ 电荷。 (3) 当质子数(核电荷数)<核外电子数时,该粒子是 ______ 离子,带 _______ 电荷。原子不显阳正阴负2) 填空 [参考练习] 1. 若aAn+与bB2-两种离子的核外电子 层结构相同,则a的数值为( ) A. b+n+2 B. b+n-2 C. b-n-2 D. b-n+2 2. 某元素的核电荷数是电子层数的5 倍,其质子数是最外层电子数的3倍,该 元素的原子结构示意图为_____________[参考练习] 1. 若aAn+与bB2-两种离子的核外电子 层结构相同,则a的数值为( ) A. b+n+2 B. b+n-2 C. b-n-2 D. b-n+2 2. 某元素的核电荷数是电子层数的5 倍,其质子数是最外层电子数的3倍,该 元素的原子结构示意图为_____________A[参考练习] 1. 若aAn+与bB2-两种离子的核外电子 层结构相同,则a的数值为( ) A. b+n+2 B. b+n-2 C. b-n-2 D. b-n+2 2. 某元素的核电荷数是电子层数的5 倍,其质子数是最外层电子数的3倍,该 元素的原子结构示意图为_____________A 请阅读1-18号元素核外电子的排布,找出每一周期最外层电子的排布规律。123882123882周期性周期性 在元素周期表中找出原子半径最大的元素和原子半径最小的元素。 2. 当电子层数相同时,核内质子数越 小, 半径越大, 如: Na>Mg; F->Na+小结微粒半径的比较方法: 1. 先比较电子层数,电子层数越多,半径越大, 如:S>C 3. 阴离子半径>其原子半径, 如: Cl- >Cl元素的主要化合价及实例+10元素的主要化合价及实例+10H2OHe元素的主要化合价及实例+10H2OHe+1+2+3+4,
-4+5,
-3-2-10元素的主要化合价及实例+10H2OHe+1+2+3+4,
-4+5,
-3-2-10Li2OBeCl2BF3CO2
CH4HNO3
NH3H2OHFNe元素的主要化合价及实例周期性+1+1+5-4-10+1+7-4-1000 1. 在下列元素中,最高正化合价数值最大的是 A. Na B. P C. Cl D. Ar 2. 某元素最高价氧化物水化物的化学式为H2RO4,则其氢化物的化学式为 A. HR B. H2R C. RH3 D. RH4 1. 在下列元素中,最高正化合价数值最大的是 A. Na B. P C. Cl D. Ar 2. 某元素最高价氧化物水化物的化学式为H2RO4,则其氢化物的化学式为 A. HR B. H2R C. RH3 D. RH4 1. 在下列元素中,最高正化合价数值最大的是 A. Na B. P C. Cl D. Ar 2. 某元素最高价氧化物水化物的化学式为H2RO4,则其氢化物的化学式为 A. HR B. H2R C. RH3 D. RH4小结:随着原子序数的递增 元素原子的核外电子排布呈现周期性变化 元素原子半径呈现周期性变化 元素化合价呈现周期性变化 元素的性质随着元素原子序数的递增而呈周期性变化,这个规律叫元素周期律。***课堂练习******课堂练习***B C 2. 原子序数从3~10的元素,随着核电荷数的递增而逐渐增大的是( ) A.电子层数 B.电子数 C.原子半径 D.化合价 3. 元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( ) A. XY2 B. X2Y3 C. X3Y2 D. X2Y 2. 原子序数从3~10的元素,随着核电荷数的递增而逐渐增大的是( ) A.电子层数 B.电子数 C.原子半径 D.化合价 3. 元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( ) A. XY2 B. X2Y3 C. X3Y2 D. X2Y 2. 原子序数从3~10的元素,随着核电荷数的递增而逐渐增大的是( ) A.电子层数 B.电子数 C.原子半径 D.化合价 3. 元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( ) A. XY2 B. X2Y3 C. X3Y2 D. X2Y+51+517+517S2->Y- 5. 今有甲、乙、丙、丁四种元素。已知:甲元素是自然界中含量最多的元素;乙元素为金属元素,它的原子核外K层、L层电子数之和等于M、N层电子数之和;丙元素的单质及其化合物的焰色反应都显黄色;氢气在丁元素单质中燃烧火焰呈苍白色。 试推断并写出甲、乙、丙、丁四种元素的名称和符号; 5. 今有甲、乙、丙、丁四种元素。已知:甲元素是自然界中含量最多的元素;乙元素为金属元素,它的原子核外K层、L层电子数之和等于M、N层电子数之和;丙元素的单质及其化合物的焰色反应都显黄色;氢气在丁元素单质中燃烧火焰呈苍白色。 试推断并写出甲、乙、丙、丁四种元素的名称和符号; 甲为氧元素,O;乙为钙元素,Ca;丙为钠元素,Na;丁为氯元素,Cl; 6. 已知X、Y均为1~18号之间的元素,X、Y可形成化合物X2Y和X2Y2,又知Y的原子序数小于X的原子序数,则两种元素的原子序数之和为( ) A.19 B.18 C. 27 D. 9 6. 已知X、Y均为1~18号之间的元素,X、Y可形成化合物X2Y和X2Y2,又知Y的原子序数小于X的原子序数,则两种元素的原子序数之和为( ) A.19 B.18 C. 27 D. 9
