硫酸
图片预览










文档简介
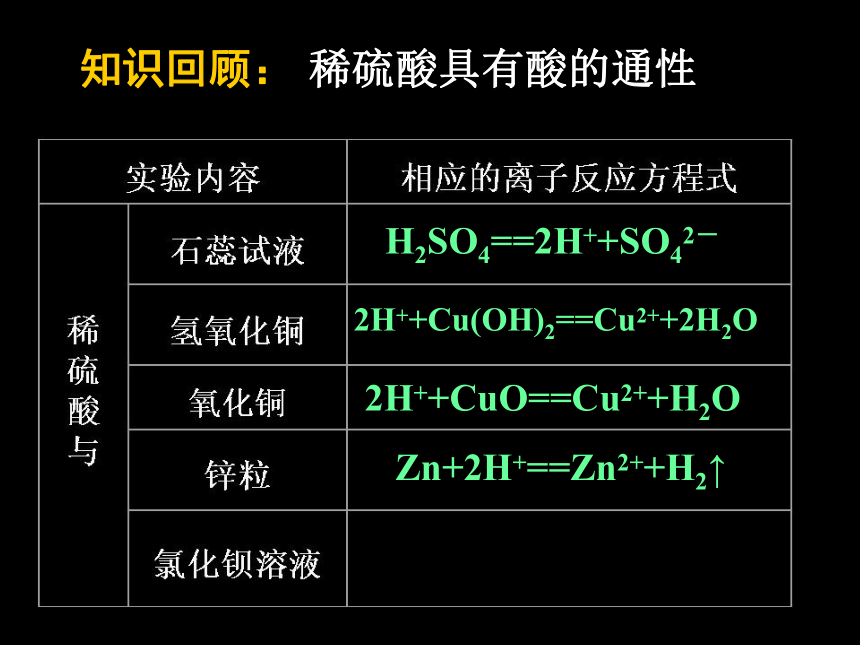
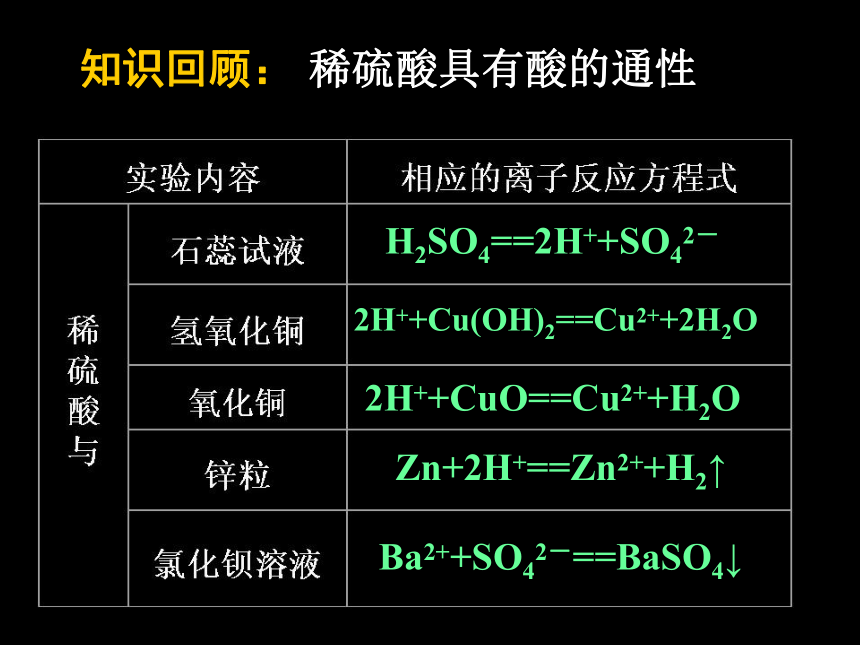
课件41张PPT。一、物理性质 纯硫酸是一种无色油状、难挥发的 液体。易溶于水,能以任意比与水混溶、溶解时大量放热。一、物理性质 纯硫酸是一种无色油状、难挥发的 液体。易溶于水,能以任意比与水混溶、溶解时大量放热。 质量分数为98%的浓硫酸,密度为1.84g/cm3,物质的量浓度为18.4mol/L。一、物理性质 纯硫酸是一种无色油状、难挥发的 液体。易溶于水,能以任意比与水混溶、溶解时大量放热。在稀释浓硫酸时,注意哪些问题? 质量分数为98%的浓硫酸,密度为1.84g/cm3,物质的量浓度为18.4mol/L。一、物理性质 纯硫酸是一种无色油状、难挥发的 液体。易溶于水,能以任意比与水混溶、溶解时大量放热。在稀释浓硫酸时,注意哪些问题? 质量分数为98%的浓硫酸,密度为1.84g/cm3,物质的量浓度为18.4mol/L。 应将浓硫酸紧靠玻璃棒,沿着容器壁缓慢地注入水中,并不断搅拌,让热量散失,防止飞溅。知识回顾:稀硫酸具有酸的通性H2SO4==2H++SO42-知识回顾:稀硫酸具有酸的通性H2SO4==2H++SO42-2H++Cu(OH)2==Cu2++2H2O知识回顾:稀硫酸具有酸的通性H2SO4==2H++SO42-2H++Cu(OH)2==Cu2++2H2O2H++CuO==Cu2++H2O知识回顾:稀硫酸具有酸的通性H2SO4==2H++SO42-2H++Cu(OH)2==Cu2++2H2O2H++CuO==Cu2++H2OZn+2H+==Zn2++H2↑知识回顾:稀硫酸具有酸的通性H2SO4==2H++SO42-2H++Cu(OH)2==Cu2++2H2O2H++CuO==Cu2++H2OBa2++SO42-==BaSO4↓Zn+2H+==Zn2++H2↑知识回顾:稀硫酸具有酸的通性二、浓硫酸的特性二、浓硫酸的特性思考: 浓硫酸是高沸点、难挥发性酸。将其敞口放置,其浓度和质量会发生怎样的改变?二、浓硫酸的特性思考: 浓硫酸是高沸点、难挥发性酸。将其敞口放置,其浓度和质量会发生怎样的改变?
答: 浓硫酸具有吸水性(所以是常用的干燥剂),能吸收空气中的水份,因此浓度会变小,质量会增加。【实验】 在试管中分别加入少量的木屑,再加入少量的浓硫酸,观察现象。【实验】 在试管中分别加入少量的木屑,再加入少量的浓硫酸,观察现象。现象:木屑变黑。【实验】 在试管中分别加入少量的木屑,再加入少量的浓硫酸,观察现象。现象:结论:木屑变黑。 木屑中的氢、氧元素按2:1组成比脱去,余下碳单质。此脱水过程称为炭化。【实验】 在小烧杯中放入20g蔗糖(C12H22O11),用1ml水调成糊状再加入15ml浓硫酸,用玻璃体搅拌,观察物质的颜色,体积变化,并闻气味。【实验】 在小烧杯中放入20g蔗糖(C12H22O11),用1ml水调成糊状再加入15ml浓硫酸,用玻璃体搅拌,观察物质的颜色,体积变化,并闻气味。现象: ①生成了黑色固体;
②体积膨胀,呈疏松多孔状; ③有刺激性气味的气体生成; ④有大量蒸汽冒出。【实验】 在小烧杯中放入20g蔗糖(C12H22O11),用1ml水调成糊状再加入15ml浓硫酸,用玻璃体搅拌,观察物质的颜色,体积变化,并闻气味。现象: ①生成了黑色固体;
②体积膨胀,呈疏松多孔状; ③有刺激性气味的气体生成; ④有大量蒸汽冒出。根据实验现象,推测: 可能发生了哪些化学反应? 浓硫酸体现了哪些化学性质? 反应后的产物是什么?结论: ①蔗糖变黑说明有炭生成; ②“体积膨胀,呈疏松多孔状”说明有大量气体产生; ③有大量水蒸气产生,证明反应为剧烈的放热反应; ④刺激性气味的气体有可能是SO2; ⑤经检验气体为CO2和SO2的混合气体。结论: ①蔗糖变黑说明有炭生成; ②“体积膨胀,呈疏松多孔状”说明有大量气体产生; ③有大量水蒸气产生,证明反应为剧烈的放热反应; ④刺激性气味的气体有可能是SO2; ⑤经检验气体为CO2和SO2的混合气体。浓硫酸表现为脱水性和强氧化性。反应的化学方程式: 浓硫酸表现强氧化性的方程式为: 2H2SO4(浓)+C==CO2↑+SO2↑+2H2O?浓硫酸的强氧化性H2SO4→S浓硫酸的强氧化性+6+4H2SO4→S浓硫酸的强氧化性氧化大多数金属:+6+4H2SO4→S浓硫酸的强氧化性氧化大多数金属:+6+4【实验】与铜的反应:现象: ①有刺激性气味的气体产生,该气体使紫色石蕊试液变红,使品红溶液褪色; ②溶液逐渐加深,变黄、变黑; ③将冷却后的溶液倒入盛水的试管中,溶液变成蓝色。现象: ①有刺激性气味的气体产生,该气体使紫色石蕊试液变红,使品红溶液褪色; ②溶液逐渐加深,变黄、变黑; ③将冷却后的溶液倒入盛水的试管中,溶液变成蓝色。解释: Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O?浓硫酸与金属反应小结 A、加热条件下,浓H2SO4可氧化绝大多数金属(Au、Pt等除外),但不产生H2,而是产生SO2。 金属单质+浓硫酸—?硫酸盐+SO2?+H2O?浓硫酸与金属反应小结 A、加热条件下,浓H2SO4可氧化绝大多数金属(Au、Pt等除外),但不产生H2,而是产生SO2。 金属单质+浓硫酸—?硫酸盐+SO2?+H2O B、常温下,浓H2SO4可使Fe、Al钝化;?浓硫酸与金属反应小结 A、加热条件下,浓H2SO4可氧化绝大多数金属(Au、Pt等除外),但不产生H2,而是产生SO2。 金属单质+浓硫酸—?硫酸盐+SO2?+H2O B、常温下,浓H2SO4可使Fe、Al钝化; C、浓H2SO4与金属反应表现酸性和强氧化性。?课时小结:一、物理性质:颜色、状态、沸点、密度、溶解性。 二、浓硫酸的特性(酸性为其通性)1、吸水性(作干燥剂) 2、脱水性 3、强氧化性下列现象体现了硫酸的哪些性质? (1)把浓硫酸滴入放在蒸发皿里的蔗糖,蔗糖就会炭化变黑。 (2)把浓硫酸露置在空气里,质量会增加。 (3)把锌粒放入稀硫酸里,会产生氢气。 (4)把炭放入浓硫酸里并加热。下列现象体现了硫酸的哪些性质? (1)把浓硫酸滴入放在蒸发皿里的蔗糖,蔗糖就会炭化变黑。 (2)把浓硫酸露置在空气里,质量会增加。 (3)把锌粒放入稀硫酸里,会产生氢气。 (4)把炭放入浓硫酸里并加热。(脱水性)下列现象体现了硫酸的哪些性质? (1)把浓硫酸滴入放在蒸发皿里的蔗糖,蔗糖就会炭化变黑。 (2)把浓硫酸露置在空气里,质量会增加。 (3)把锌粒放入稀硫酸里,会产生氢气。 (4)把炭放入浓硫酸里并加热。(脱水性)(吸水性)下列现象体现了硫酸的哪些性质? (1)把浓硫酸滴入放在蒸发皿里的蔗糖,蔗糖就会炭化变黑。 (2)把浓硫酸露置在空气里,质量会增加。 (3)把锌粒放入稀硫酸里,会产生氢气。 (4)把炭放入浓硫酸里并加热。(脱水性)(吸水性)(酸性)下列现象体现了硫酸的哪些性质? (1)把浓硫酸滴入放在蒸发皿里的蔗糖,蔗糖就会炭化变黑。 (2)把浓硫酸露置在空气里,质量会增加。 (3)把锌粒放入稀硫酸里,会产生氢气。 (4)把炭放入浓硫酸里并加热。(脱水性)(吸水性)(酸性)(强氧化性) 5、往浓盐酸中加入浓硫酸可以制得HCl气体; 6、用铝或铁制容器可以贮存和运输浓硫酸(但不能贮存和运输稀硫酸)。 5、往浓盐酸中加入浓硫酸可以制得HCl气体; (吸水性、高沸点、难挥发性和浓盐酸的低沸点、易挥发性) 6、用铝或铁制容器可以贮存和运输浓硫酸(但不能贮存和运输稀硫酸)。 5、往浓盐酸中加入浓硫酸可以制得HCl气体; (吸水性、高沸点、难挥发性和浓盐酸的低沸点、易挥发性) 6、用铝或铁制容器可以贮存和运输浓硫酸(但不能贮存和运输稀硫酸)。 (强氧化性)
②体积膨胀,呈疏松多孔状; ③有刺激性气味的气体生成; ④有大量蒸汽冒出。【实验】 在小烧杯中放入20g蔗糖(C12H22O11),用1ml水调成糊状再加入15ml浓硫酸,用玻璃体搅拌,观察物质的颜色,体积变化,并闻气味。现象: ①生成了黑色固体;
②体积膨胀,呈疏松多孔状; ③有刺激性气味的气体生成; ④有大量蒸汽冒出。根据实验现象,推测: 可能发生了哪些化学反应? 浓硫酸体现了哪些化学性质? 反应后的产物是什么?结论: ①蔗糖变黑说明有炭生成; ②“体积膨胀,呈疏松多孔状”说明有大量气体产生; ③有大量水蒸气产生,证明反应为剧烈的放热反应; ④刺激性气味的气体有可能是SO2; ⑤经检验气体为CO2和SO2的混合气体。结论: ①蔗糖变黑说明有炭生成; ②“体积膨胀,呈疏松多孔状”说明有大量气体产生; ③有大量水蒸气产生,证明反应为剧烈的放热反应; ④刺激性气味的气体有可能是SO2; ⑤经检验气体为CO2和SO2的混合气体。浓硫酸表现为脱水性和强氧化性。反应的化学方程式: 浓硫酸表现强氧化性的方程式为: 2H2SO4(浓)+C==CO2↑+SO2↑+2H2O?浓硫酸的强氧化性H2SO4→S浓硫酸的强氧化性+6+4H2SO4→S浓硫酸的强氧化性氧化大多数金属:+6+4H2SO4→S浓硫酸的强氧化性氧化大多数金属:+6+4【实验】与铜的反应:现象: ①有刺激性气味的气体产生,该气体使紫色石蕊试液变红,使品红溶液褪色; ②溶液逐渐加深,变黄、变黑; ③将冷却后的溶液倒入盛水的试管中,溶液变成蓝色。现象: ①有刺激性气味的气体产生,该气体使紫色石蕊试液变红,使品红溶液褪色; ②溶液逐渐加深,变黄、变黑; ③将冷却后的溶液倒入盛水的试管中,溶液变成蓝色。解释: Cu+2H2SO4(浓)==CuSO4+SO2↑+2H2O?浓硫酸与金属反应小结 A、加热条件下,浓H2SO4可氧化绝大多数金属(Au、Pt等除外),但不产生H2,而是产生SO2。 金属单质+浓硫酸—?硫酸盐+SO2?+H2O?浓硫酸与金属反应小结 A、加热条件下,浓H2SO4可氧化绝大多数金属(Au、Pt等除外),但不产生H2,而是产生SO2。 金属单质+浓硫酸—?硫酸盐+SO2?+H2O B、常温下,浓H2SO4可使Fe、Al钝化;?浓硫酸与金属反应小结 A、加热条件下,浓H2SO4可氧化绝大多数金属(Au、Pt等除外),但不产生H2,而是产生SO2。 金属单质+浓硫酸—?硫酸盐+SO2?+H2O B、常温下,浓H2SO4可使Fe、Al钝化; C、浓H2SO4与金属反应表现酸性和强氧化性。?课时小结:一、物理性质:颜色、状态、沸点、密度、溶解性。 二、浓硫酸的特性(酸性为其通性)1、吸水性(作干燥剂) 2、脱水性 3、强氧化性下列现象体现了硫酸的哪些性质? (1)把浓硫酸滴入放在蒸发皿里的蔗糖,蔗糖就会炭化变黑。 (2)把浓硫酸露置在空气里,质量会增加。 (3)把锌粒放入稀硫酸里,会产生氢气。 (4)把炭放入浓硫酸里并加热。下列现象体现了硫酸的哪些性质? (1)把浓硫酸滴入放在蒸发皿里的蔗糖,蔗糖就会炭化变黑。 (2)把浓硫酸露置在空气里,质量会增加。 (3)把锌粒放入稀硫酸里,会产生氢气。 (4)把炭放入浓硫酸里并加热。(脱水性)下列现象体现了硫酸的哪些性质? (1)把浓硫酸滴入放在蒸发皿里的蔗糖,蔗糖就会炭化变黑。 (2)把浓硫酸露置在空气里,质量会增加。 (3)把锌粒放入稀硫酸里,会产生氢气。 (4)把炭放入浓硫酸里并加热。(脱水性)(吸水性)下列现象体现了硫酸的哪些性质? (1)把浓硫酸滴入放在蒸发皿里的蔗糖,蔗糖就会炭化变黑。 (2)把浓硫酸露置在空气里,质量会增加。 (3)把锌粒放入稀硫酸里,会产生氢气。 (4)把炭放入浓硫酸里并加热。(脱水性)(吸水性)(酸性)下列现象体现了硫酸的哪些性质? (1)把浓硫酸滴入放在蒸发皿里的蔗糖,蔗糖就会炭化变黑。 (2)把浓硫酸露置在空气里,质量会增加。 (3)把锌粒放入稀硫酸里,会产生氢气。 (4)把炭放入浓硫酸里并加热。(脱水性)(吸水性)(酸性)(强氧化性) 5、往浓盐酸中加入浓硫酸可以制得HCl气体; 6、用铝或铁制容器可以贮存和运输浓硫酸(但不能贮存和运输稀硫酸)。 5、往浓盐酸中加入浓硫酸可以制得HCl气体; (吸水性、高沸点、难挥发性和浓盐酸的低沸点、易挥发性) 6、用铝或铁制容器可以贮存和运输浓硫酸(但不能贮存和运输稀硫酸)。 5、往浓盐酸中加入浓硫酸可以制得HCl气体; (吸水性、高沸点、难挥发性和浓盐酸的低沸点、易挥发性) 6、用铝或铁制容器可以贮存和运输浓硫酸(但不能贮存和运输稀硫酸)。 (强氧化性)
