2018-2019学年苏教版化学1专题4第一单元含硫化合物的性质和应用之硫酸的制备和性质教学课件(29张)
文档属性
| 名称 | 2018-2019学年苏教版化学1专题4第一单元含硫化合物的性质和应用之硫酸的制备和性质教学课件(29张) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-01-21 00:00:00 | ||
图片预览








文档简介
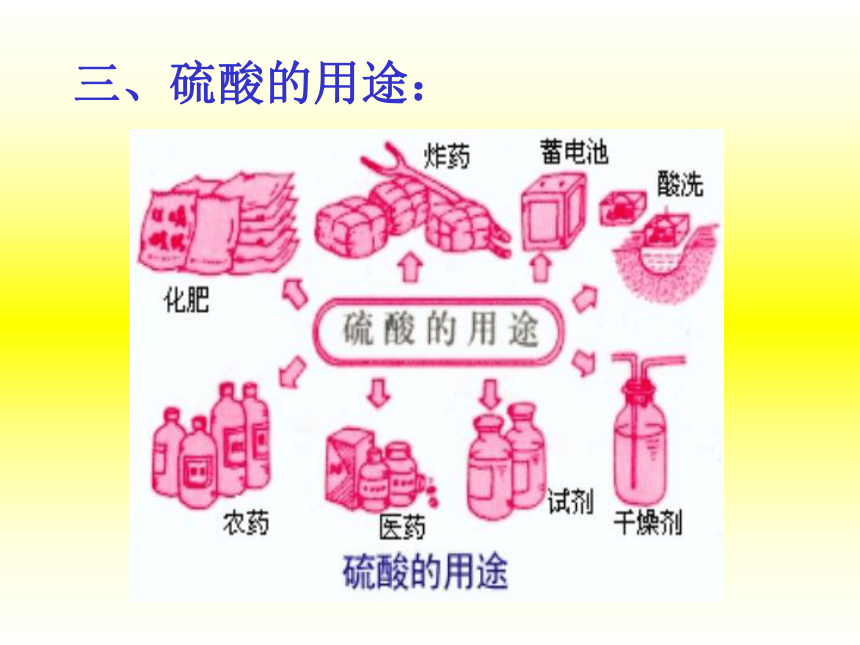
课件29张PPT。硫酸的制备和性质一、物理性质: 无色、油状液体、难挥发 易溶于水,以任意比与水混溶、溶解时大量放热思考:在稀释浓硫酸时,应该注意哪些地方? 将浓硫酸沿着容器壁缓慢的注入水中,并不断搅拌,让热量散失。 知识回顾:稀硫酸具有酸的通性Cu(OH)2 CuO Zn 酸碱指示剂稀H2SO4CuSO4+H2OCuSO4+H2OZnSO4+H2石蕊二、浓硫酸特性思考:浓硫酸敞口放置,是怎样变质的?用途:干燥剂1、吸水性2、脱水性:思考:浓硫酸的吸水性与脱水性有什么不同? 3、强氧化性:思考:在这个反应中,硫酸起了什么作用?CuO+H2SO4==CuSO4+H2O(1)与金属反应体现氧化性体现酸性思考:浓硫酸在加热时能氧化铜,那么能氧化其他金属吗?浓H2SO4 常温下,浓硫酸能使Fe、Al表面形成致密的氧化膜,称为钝化。加热:能与大多数金属(Au、Pt除外)反应常温:能与活泼金属反应(注意:不生成H2)看图想问题图片(2)与非金属反应:问:氧化产物与还原产物的物质的量之比想一想:为什么蔗糖脱水后变得疏松多孔?问:设计一个实验检验反应产生的气体成分?演示图片(3)与化合物反应:思考:能用浓硫酸干燥H2S气体吗?浓硫酸能干燥:
H2 O2 N2 CO CO2 CH4 SO2 HCl Cl2浓硫酸不能干燥:
H2S HBr HI NH3H2S + H2SO4 = S + SO2 + 2H2O注意:三、硫酸的用途:思考题
下列现象体现了硫酸的哪些性质?
(1) 把浓硫酸滴入放在蒸发皿里的蔗糖上,
蔗糖就会炭化变黑
(2) 把浓硫酸露置在空气里,
质量会增加。
(3) 把锌粒放入稀硫酸里,会产生氢气。
(4) 把铜片放入浓硫酸里并加热,
产生SO2。
(5) 利用浓硫酸和食盐固体反应,
HCl气体。
脱水性吸水性酸性强氧化性、酸性难挥发性练习: 1、在常温下,下列物质可盛放在铁制的容器中的是( )
A.?? 盐酸 B.稀硫酸
C. 浓硫酸 D.硫酸铜溶液 2、浓硫酸能与碳,硫等非金属单质反应,因为它是( )
A.?? 强氧化剂 B.不挥发性酸
C. 强酸 D.脱水剂 3、下列物质久置在敞口容器中质量会增加的是( )
A.?? 浓硫酸 B.浓盐酸
C. 碳酸钠晶体 D.氯化钠结束①拿起试剂瓶,掂一掂重者为浓硫酸,因为浓硫酸的密度大。 ②将试剂瓶提起,摇动,呈油状、粘稠的是浓硫酸,因为浓硫酸是无色、粘稠的油状液体。 ③分别将瓶盖打开,瓶口无酸雾的是浓硫酸,因为浓硫酸不具有挥发性。 演示:
浓硫酸使硫酸铜晶体(CuSO4·5H2O)从蓝变白演示:蔗糖与浓硫酸作用思考:为什么要滴加几滴水?演示:Cu与浓硫酸反应石灰水检验水检验SO2除去SO2检验CO2一、硫酸的制取接触法制造硫酸的生产过程造气接触氧化SO3的吸收1. 造气( 二氧化硫的制取和净化)沸腾炉原料粉碎空气焙烧硫铁矿的炉子为何叫沸腾炉?硫铁矿为什么要粉碎?粉碎后增大固体与空气的接触面积,使反应更充分,提高原料利用率 。燃烧硫铁矿为什么不要多加燃料?硫铁矿燃烧反应是放热的。沸腾炉1. 造气( 二氧化硫的制取和净化)炉气成分:SO2、O2、N2、水蒸气以及一些杂质,如As、Se等的化合物和矿尘等等。为什么要净化炉气?矿尘和杂质会引起催化剂中毒,水蒸气会腐蚀设备。催化剂中毒是指杂质和矿尘使催化剂减弱或失去催化作用的现象。净化后气体成份是: SO2、O2、N2沸腾炉接触室沸腾炉<600C4500C8500C催化剂热交换器2、 接触氧化(SO2氧化成SO3)接触室
SO3、SO2、O2、N2反应是可逆反应,不能实现完全转化。接触室中热交换器的作用是什么?热交换器中冷热气体的流向是相反的,冷却生成气(SO3、 SO2、O2、N2),预热原料气(SO2、O2、N2),这种方式能够节约能源从接触室出来的气体成分是什么?为什么仍有SO2、O2存在?3.三氧化硫的吸收吸收塔热交换 5000C1500C98.3%H2SO4尾气吸收SO3为什么不用水和稀硫酸而用98.3%的浓硫酸?用水或稀硫酸吸收SO3因放出大量的热,易形成酸雾,不利于气体三氧化硫的吸收。吸收塔浓硫酸为什么必须从塔顶喷下?98.3%的浓硫酸从塔顶淋下,气体由下往上,流向相反,充分接触,吸收更完全。 尾气含有什么成分?如何处理?4、尾气处理尾气的组成:SO2,O2,N2①碱法: Na2CO3Na2CO3+SO2===Na2SO3+CO2②氨酸法: NH3·H2O2NH3·H2O+SO2===(NH4)2SO3+H2O小结:接触法制硫酸的“五个三”1、三个阶段造气 接触氧化 吸收2、三个装置沸腾炉 接触室 吸收塔3、三个反应4、三种原料硫铁矿 空气 98.3%的浓硫酸5、三个原理高温燃烧 催化氧化 吸收4FeS2+11O2=2Fe2O3+8SO2(高温)SO3+H2O=H2SO42SO2+O2 2SO3(催化剂、高温)谢谢观赏!
H2 O2 N2 CO CO2 CH4 SO2 HCl Cl2浓硫酸不能干燥:
H2S HBr HI NH3H2S + H2SO4 = S + SO2 + 2H2O注意:三、硫酸的用途:思考题
下列现象体现了硫酸的哪些性质?
(1) 把浓硫酸滴入放在蒸发皿里的蔗糖上,
蔗糖就会炭化变黑
(2) 把浓硫酸露置在空气里,
质量会增加。
(3) 把锌粒放入稀硫酸里,会产生氢气。
(4) 把铜片放入浓硫酸里并加热,
产生SO2。
(5) 利用浓硫酸和食盐固体反应,
HCl气体。
脱水性吸水性酸性强氧化性、酸性难挥发性练习: 1、在常温下,下列物质可盛放在铁制的容器中的是( )
A.?? 盐酸 B.稀硫酸
C. 浓硫酸 D.硫酸铜溶液 2、浓硫酸能与碳,硫等非金属单质反应,因为它是( )
A.?? 强氧化剂 B.不挥发性酸
C. 强酸 D.脱水剂 3、下列物质久置在敞口容器中质量会增加的是( )
A.?? 浓硫酸 B.浓盐酸
C. 碳酸钠晶体 D.氯化钠结束①拿起试剂瓶,掂一掂重者为浓硫酸,因为浓硫酸的密度大。 ②将试剂瓶提起,摇动,呈油状、粘稠的是浓硫酸,因为浓硫酸是无色、粘稠的油状液体。 ③分别将瓶盖打开,瓶口无酸雾的是浓硫酸,因为浓硫酸不具有挥发性。 演示:
浓硫酸使硫酸铜晶体(CuSO4·5H2O)从蓝变白演示:蔗糖与浓硫酸作用思考:为什么要滴加几滴水?演示:Cu与浓硫酸反应石灰水检验水检验SO2除去SO2检验CO2一、硫酸的制取接触法制造硫酸的生产过程造气接触氧化SO3的吸收1. 造气( 二氧化硫的制取和净化)沸腾炉原料粉碎空气焙烧硫铁矿的炉子为何叫沸腾炉?硫铁矿为什么要粉碎?粉碎后增大固体与空气的接触面积,使反应更充分,提高原料利用率 。燃烧硫铁矿为什么不要多加燃料?硫铁矿燃烧反应是放热的。沸腾炉1. 造气( 二氧化硫的制取和净化)炉气成分:SO2、O2、N2、水蒸气以及一些杂质,如As、Se等的化合物和矿尘等等。为什么要净化炉气?矿尘和杂质会引起催化剂中毒,水蒸气会腐蚀设备。催化剂中毒是指杂质和矿尘使催化剂减弱或失去催化作用的现象。净化后气体成份是: SO2、O2、N2沸腾炉接触室沸腾炉<600C4500C8500C催化剂热交换器2、 接触氧化(SO2氧化成SO3)接触室
SO3、SO2、O2、N2反应是可逆反应,不能实现完全转化。接触室中热交换器的作用是什么?热交换器中冷热气体的流向是相反的,冷却生成气(SO3、 SO2、O2、N2),预热原料气(SO2、O2、N2),这种方式能够节约能源从接触室出来的气体成分是什么?为什么仍有SO2、O2存在?3.三氧化硫的吸收吸收塔热交换 5000C1500C98.3%H2SO4尾气吸收SO3为什么不用水和稀硫酸而用98.3%的浓硫酸?用水或稀硫酸吸收SO3因放出大量的热,易形成酸雾,不利于气体三氧化硫的吸收。吸收塔浓硫酸为什么必须从塔顶喷下?98.3%的浓硫酸从塔顶淋下,气体由下往上,流向相反,充分接触,吸收更完全。 尾气含有什么成分?如何处理?4、尾气处理尾气的组成:SO2,O2,N2①碱法: Na2CO3Na2CO3+SO2===Na2SO3+CO2②氨酸法: NH3·H2O2NH3·H2O+SO2===(NH4)2SO3+H2O小结:接触法制硫酸的“五个三”1、三个阶段造气 接触氧化 吸收2、三个装置沸腾炉 接触室 吸收塔3、三个反应4、三种原料硫铁矿 空气 98.3%的浓硫酸5、三个原理高温燃烧 催化氧化 吸收4FeS2+11O2=2Fe2O3+8SO2(高温)SO3+H2O=H2SO42SO2+O2 2SO3(催化剂、高温)谢谢观赏!
