6.2化学平衡 同步导学案(含答案)
图片预览



文档简介
6.1.2化学平衡
一. 上节回顾
1.化学反应速率的表示方法:单位时间内反应物 浓度的较少 或生成物 浓度的增加。
计算公式:v=,单位:mol/(L·s)或mol/(L·min)。
影响化学反应速率的因素有:反应物本身的性质、浓度、温度、压强、催化剂、其他因素等。
二、本节内容
(一).可逆反应
1. 在同一条件下,既可以向正反应方向进行,又可以向逆反应方向进行的反应。
2. 表示:用“ ”连接反应物和生成物。
3. 特点:在一定条件下,可逆反应有一定的限度,反应物不能完全转化为生成物。
【练习1】 2H2+O2→2H2O和2H2O→2H2↑+O2↑属于可逆反应吗?
二者不属于可逆反应,因为可逆反应是在相同条件下进行的。
【练习2】 把3 mol H2和1 mol N2充入密闭容器中反应,最终可以生成2 mol NH3吗?
H2和N2反应生成NH3是一个可逆反应,可逆反应不能进行到底,故不能生成2 mol NH3。
【练习3】 在密闭容器中, H2和 N2反应发生合成氨,反应一段时间后,容器中存在的物质有哪些?
N2、H2、NH3
【例题1】在一定量的密闭容器中进行反应:2SO2(g)+O2(g) ?2SO3(g)。已知反应过程中某一时刻SO2、 O2、SO3的浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L,当反应达到平衡时,可能存在的数据是( )
A.SO2为0.4 mol/L,O2为0.2 mol/L B.SO2为0.25 mol/L
C.SO2、SO3均为0.15 mol/L D.SO3为0.40 mol/L
【答案】 B
【思路点拨】 本题考查对可逆反应的特征的理解,解答时,应注意两点:
(1)可逆反应既可向正反应方向进行,同时又可向逆反应方向进行;
(2)可逆反应不能进行到底,只能反应到一定程度达到平衡状态,平衡时各物质的物质的量都大于零。
【解析】 对于本题,若反应从题给某一时刻开始向正反应方向进行并达平衡,此时SO3的浓度应小于0.40 mol/L;若反应从题给某一时刻开始向逆反应方向进行并达平衡,此时SO2的浓度应小于0.4 mol/L,O2的浓度应小于0.2 mol/L;由反应的量的关系可知c(SO2)+c(SO3)=0.4 mol/L,因此两者不可能同时为0.15 mol/L。
(二).化学平衡
定义: 在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。
①前提条件:一定条件(T、P、V) ②研究对象:密闭容器的可逆反应
③平衡本质:v正=v逆≠0 ④平衡标志:各物质的浓度不变
(1)化学平衡的建立
①在温度保持300℃时的密闭容器内,放入一定量的氢气和碘蒸气,则氢气和碘化合生成碘化氢,使容器中碘蒸气的紫色逐渐变淡,但不会成无色。达到平衡时,容器内氢气,碘及碘化氢,其正逆反应速率随时间的变化如图1所示:
a.反应开始时:v(正)最大,v(逆)为零。
b.反应进行时:反应物浓度减小→v(正)逐渐变小。
生成物由无到有逐渐增多→v(逆)从零开始逐渐增大。
c.反应达到平衡时,v(正) = v(逆),反应混合物各组分的浓度不再发生变化。
②在同一温度等条件下,只放入无色的碘化氢气体时,则碘化氢可以分解为氢气和碘,因而达到平衡时,容器内气体呈淡紫色。其正逆反应速率随时间的变化如图2所示:
(2)化学平衡的特征
①逆:化学平衡状态只对可逆反应而言。
②等:正反应速率和逆反应速率相等,即v正=v逆≠0。
③定:外界条件一定,各组分成分的含量保持不变;
④动:化学平衡是一种动态平衡,即v正=v逆≠0,所以。
⑤变:外界条件发生变化时,v正≠v逆则化学平衡就会发生移动。
(3)化学平衡的实质:v正= v逆。
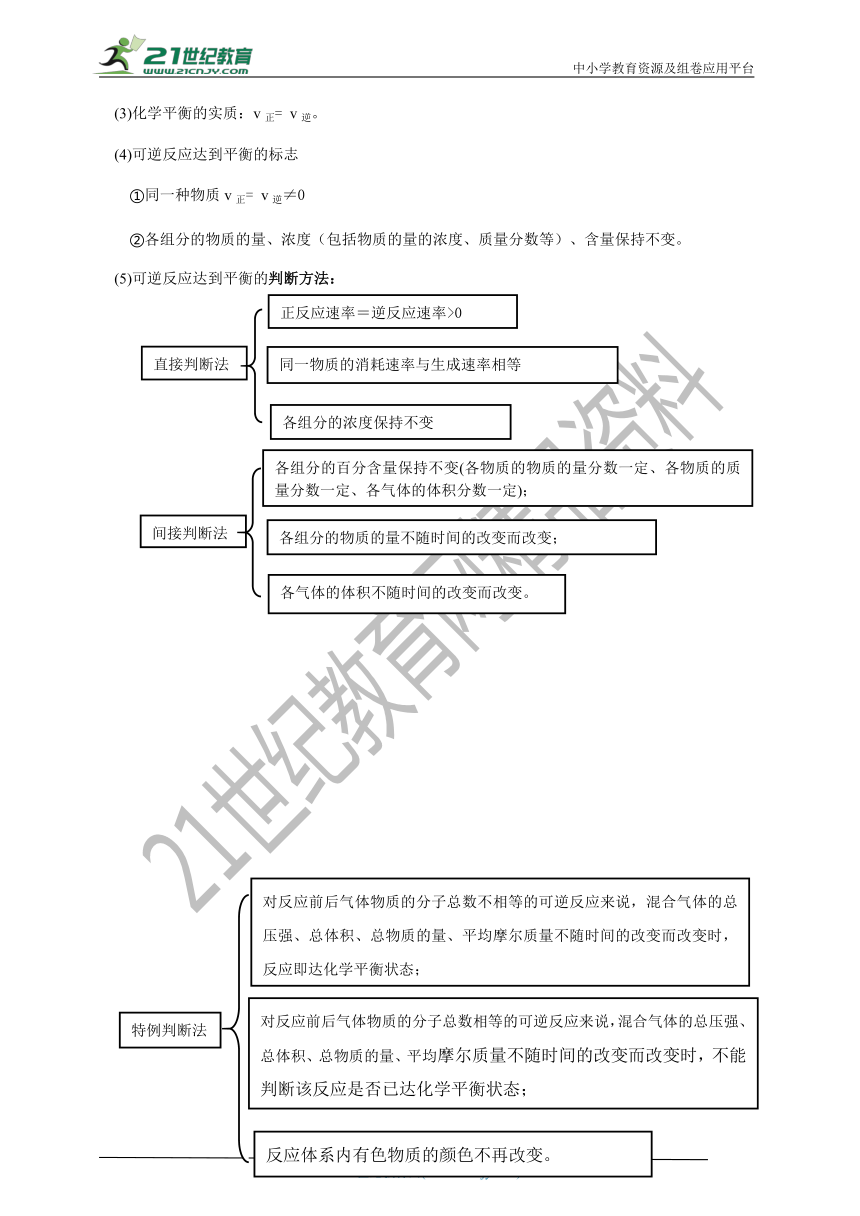
(4)可逆反应达到平衡的标志
①同一种物质v正= v逆≠0
②各组分的物质的量、浓度(包括物质的量的浓度、质量分数等)、含量保持不变。
(5)可逆反应达到平衡的判断方法:
无论用什么方法判断可逆反应是否达到平衡状态,都要以本质特征或现象特征为依据来展开分析和判断。也就是说,判断可逆反应是否达到平衡状态的根本标志是v(正)=v(逆),其余的判断方法都是从这个方法的基础上衍生出来的。
【例题2】 在一定温度下,可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是 ( )
( A)C生成的速率与C分解的速率相等
(B)单位时间生成n mol A,同时生成3n mol B
(C)A、B、C的浓度不再变化
(D)A、B、C的分子数比为1:3:2
【答案】AC
【解析】A选项 C生成的速率是正反应速率,C分解的速率是逆反应速率,两者相等说明正、逆反应速率相等;B选项 生成A与生成B均为逆反应速率,没有表达正逆反应速率的关系;C选项 化学平衡的概念;D选项 假设开始投入2 mol A、6mol B进行反应,当有1mol A和3 mol B反应生成了2 mol C时,A、B、C的分子数比为1:3:2,但并不一定达到平衡状态。
【练习4】 当可逆反应2SO2+O22SO3达到平衡后,通18O2气体后再次达到平衡时,18O存在于 (?? ) A.SO3,O3?????????? B. SO2,SO3 C. SO2,SO3,O2????????? ? D. SO2,O2
答案:C。
解析:18O2的加入定会与SO2结合生成含18O的SO3,同时含18O的SO3又会分解得到含18O的SO2和O2,因此,18O可存在于SO2、O2、SO3这三种物质中。
【练习5】可逆反应2NO22NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO
②单位时间内生成n mol O2的同时生成2n mol NO2
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
A.①④ B.②④ C.①③④ D.①②③④⑤
答案:选B。
解析:本题的关键是根据所给条件判断出v(正)=v(逆)。①中生成n mol O2的同时生成2n mol NO,都是正反应速率,不能作为判断依据;②中生成n mol O2为正反应速率,同时生成2n mol NO2为逆反应速率,且符合化学计量数之比,正确;③不能作为判断依据;④中NO2为红棕色气体,颜色不再发生变化,说明其浓度不再发生变化,说明反应平衡了;⑤中该体系混合气体的密度为一恒定的数值,不变,所以不能作为判断达到平衡的标志。
(三)影响化学平衡的因素
1.化学平衡的移动
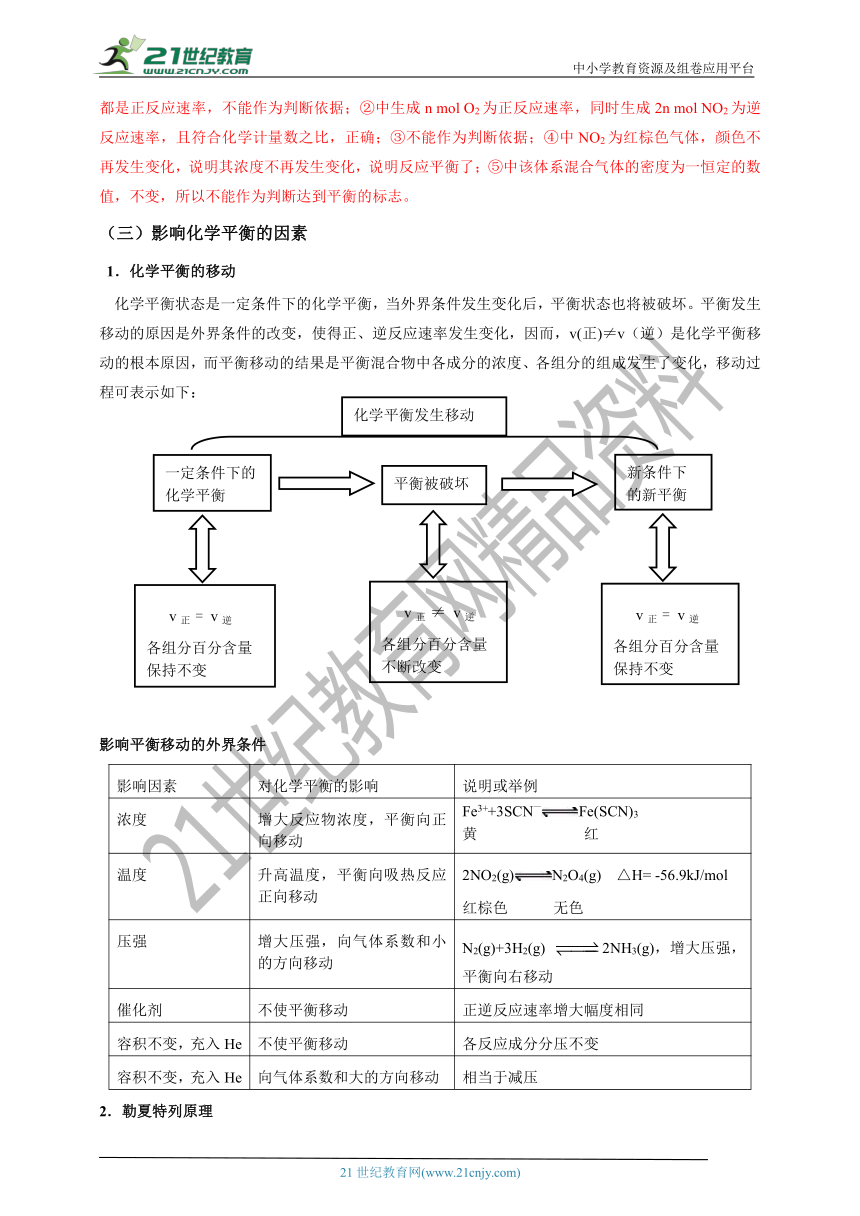
化学平衡状态是一定条件下的化学平衡,当外界条件发生变化后,平衡状态也将被破坏。平衡发生移动的原因是外界条件的改变,使得正、逆反应速率发生变化,因而,v(正)≠v(逆)是化学平衡移动的根本原因,而平衡移动的结果是平衡混合物中各成分的浓度、各组分的组成发生了变化,移动过程可表示如下:
影响平衡移动的外界条件
影响因素
对化学平衡的影响
说明或举例
浓度
增大反应物浓度,平衡向正向移动
Fe3++3SCN—Fe(SCN)3
黄 红
温度
升高温度,平衡向吸热反应正向移动
2NO2(g)N2O4(g) △H= -56.9kJ/mol
红棕色 无色
压强
增大压强,向气体系数和小的方向移动
N2(g)+3H2(g) 2NH3(g),增大压强,平衡向右移动
催化剂
不使平衡移动
正逆反应速率增大幅度相同
容积不变,充入He
不使平衡移动
各反应成分分压不变
容积不变,充入He
向气体系数和大的方向移动
相当于减压
2.勒夏特列原理
如果改变影响平衡的一个条件(如浓度、压强和温度等),平衡就向着能够减弱这种改变的方向移动。
勒夏特列原理又称平衡移动原理,它不仅适用于化学平衡的体系,也适用于溶解平衡等动态平衡体系。
【例题3】可逆反应mA(固)+nB(g) eC(g)+fD(g) 反应过程中,当其他条件不变时,C的体积分数((C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是 ( )
A.达到平衡后,若使用催化剂,C的体积分数将增大
B.当平衡后,若温度升高,化学平衡向逆反应方向移动
C.化学方程式中,n>e+f
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
【答案】B
【解析】A选项 由于使用催化剂,并不影响化学平衡的移动,所以A错误。
B选项 从图(1)可判断出T1与T2的大小关系。在其他条件不变时,T升高,反应速率变大,达到平衡时间越短。由此可知,T2>T1,并且温度较高时((C)变小,说明升高温度时,平衡向逆反应方向移动,所以该正反应是放热反应。B选项是正确的。
C选项从图(2)可判断出P1与P2大小关系。在其他条件不变时,P越大,达到平衡的时间就越短,由此可知P2>P1。从图中可知,压强增大时((C)变小,说明增大压强平衡向逆反应方向移动,逆反应方向是气体体积减小方向,即n<e+f,C项错误。
在化学平衡中,增大或减小固体物质的质量不影响化学平衡的移动。因此D项错误。
【练习6】下列不能用勒夏特列原理解释的是( )
A. 用加压的方法促进CO2在水中的溶解 B. 合成氨工业用铁触媒作催化剂
C. 红棕色的NO2加压后颜色先变深再变浅 D. 实验室用排饱和食盐水的方法收集氯气
答案:B
解析:A.加压能使CO2在水中的溶解向着CO2溶解的方向进行,可用平衡移动原理解释,故A错误;
B.催化剂不影响化学平衡,故不能用勒夏特列原理解释,故B正确;
C.加压二氧化氮的浓度增大,平衡向生成四氧化二氮的方向移动,故加压后颜色先变深后变浅,但仍比原来的颜色深,可以勒夏特列原理解释,故C错误;
D.新制的氯水中存在平衡:Cl2+H2O ?H++Cl-+HClO,在饱和食盐水中氯离子浓度较大,可抑制氯气和水的反应,减小氯气的溶解度,可用勒夏特列原理解释,故D错误;
(四)有关化学平衡的计算
①反应物的转化率=×100%;
②生成物的产率=×100%;
③某组分的体积分数=×100%;
④反应物A的转化率:α(A)=×100%;
⑤反应平衡后A的百分含量=×100%。
【例题4】一定条件下,可逆反应A2(g) + B2(g) 2 C(g)达到平衡时,各物质的平衡浓度为:c(A2)= 0.5mol/L;c(B2)= 0.1mol/L; c(C)= 1.6mol/L。
若用a、b、c分别表示A2、B2、C的初始浓度(mol/L),则:
(1)a、b应满足的关系是 ;
(2)a的取值范围是 。
【答案】(1)a = b +0.4 (2) 0.4≤ b ≤1.3
【解析】解决此类题的方法:(1)确定反应物或生成物的起始加入量。
(2)确定反应过程中各物质的变化量。 (3)确定平衡时各物质的平衡量。
(4)依据题干中的条件建立等式关系进行解答
(1)设转化过程中,A2(g)转化浓度为xmol/L,则B2(g)转化浓度也为xmol/L。平衡浓度: a–x = 0.5 b–x = 0.1 则有:a = b +0.4
(2)考虑两种极端情况:①A2、B2为起始物质;②A2、C为起始物质。
A2(g) + B2(g) 2 C(g)
物质的平衡浓度(mol/L) 0.5 0.1 1.6
①A2、B2为起始物质 0.5+0.8 0.1+0.8 0
②A2、C为起始物质 0.5-0.1 0 1.6+0.2
故a的取值范围为0.4≤ b ≤1.3。
(五)化学平衡常数
1、定义:在一定温度下,当一个可逆反应达到平衡状态时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数叫做该反应的化学平衡常数(简称平衡常数)。 用符号K表示,化学平衡常数的大小可以表示反应所能进行的程度。
2、化学平衡常数的表示
例:CO + H2O(g)CO2+H2
注意事项:
(1)平衡常数表达式与反应方程式的书写有关。
化学方程式中各物质的物理状态应当注明。
化学方程式右方的物质写在分子上,左方的物质写在分母上。其指数等于它在化学方程式中的系数。
平衡常数只与温度有关,与反应物和生成物的浓度无关。 (5)表示平衡常数时,固体纯液体的浓度看为1,不列入平衡表达式中。 (6)平衡常数越大,生成物浓度越大,反应物浓度越小,故反应向右进行的越完全。反应物的转化率也越大。
【练习7】下列关于平衡常数K的说法中,正确的是 (? ) A.在任何条件下,化学平衡常数是一个恒定值????? B.改变反应物浓度或生成物浓度都会改变平衡常数K C.平衡常数K只与温度有关,与反应物浓度、压强无关 D.从平衡常数K的大小不能推断一个反应进行的程度
答案:C。
解析:A、化学平衡常数只受温度影响,同一反应温度不同,平衡常数不同,故A错误; B、同一反应,平化学衡常数只受温度影响,与反应物的浓度无关,故B错误; C、同一反应,平化学衡常数只受温度影响,与反应物浓度、体系的压强无关,故C正确; D、平衡常数越大,说明可逆反应进行的程度越大,故D错误。
课堂练习
1. 下列反应属于可逆反应的是 ( )
NH4Cl受热分解,在试管口又生成NH4Cl
(B) 2H2 +O22H2O,2H2O2H2↑+O2↑
(C) 2HIH2 + I2,H2 + l2 2HI
(D)工业上用SO2制SO3的反应
2. 对于可逆反应N2+3H22NH3,下列能表示反应处于化学平衡状态是 ( )
A.N2、H2、NH3的浓度相等 B.N2、H2、NH3的浓度不再发生变化
C.反应停止 D.N2、H2、NH3在容器中共存
3. 对于可逆反应2HI(g) H2 (g) + I2 (g)的平衡体系,改变外界条件后,下列叙述中说明平衡一定发生了移动的是 ( )
(A)混合体系的压强增大为原平衡体系的2倍
(B)混合体系气体颜色加深
(C)混合体系中H2的体积分数为原平衡体系中H2体积分数的80%
(D)混合气体的平均摩尔质量发生了改变
4. 下列事实不能用勒夏特列原理解释的是( )
夏天,打开啤酒瓶时会在瓶口逸出气体
B.浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体
C.压缩氢气与碘蒸气反应的平衡混合气体,颜色变深
D.将盛有二氧化氮和四氧化二氮混合气体的密闭容器置于冷水中,混合气体颜色变浅
5.在一定温度下,反应1/2H2(g)+1/2X2(g) HX(g)的平衡常数为10。则反应2HX(g) ?H2(g)+X2(g)的平衡常数为 (?? ? ) A.??0.01?????? ? B.? 1??????? C. 10??????? D. 100
6. 把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:
3A(g)+B(g) 2C(g)+ xD(g)经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/L?min,下列说法中错误的是 ( )
A.x = 2 B. B的转化率为20%
C. 平衡时A的浓度为0.8mol/L D. 恒温达平衡时容器内压强为开始时的85%
1.【答案】 CD
【分析】A、B两项中的两反应条件不同,不属于可逆反应;c项中的反应可表示为2HIH2 + I2;D项中的反应为2SO2 + O22SO3。
2.答案:B。
解析:A、因反应平衡时各物质的浓度不变,但不是说各自的浓度相等,故A错误; B、因达到平衡时,正逆反应速率相等,各种物质的浓度不再发生变化,故B正确; C、因反应达到平衡时,正逆反应速率相等,但反应并没有停止,故C错误; D、反该反应为可逆反应,无论是否达到平衡状态,各种物质都共存,故D错误。 3.【答案】CD
【解析】对原平衡体系加压,平衡不移动,A项错误。B项叙述不能说明平衡发生了移动。C项叙述说明平衡发生了移动,如向平衡体系中通入一定量的I2(g)。D项也可以说明平衡发生了移动,如向平衡体系中通入H2 (g)。
4. 答案:C
解析:A、气体的溶解度随着温度的升高而减小,随压强的增大而增大,汽水或啤酒中含有大量的二氧化碳,当打开瓶盖时,压强减小,气体的溶解度变小,所以二氧化碳气体冒出,不能用勒夏特利原理解释,故A正确; B、浓氨水中存在平衡NH3+H2ONH3·H2ONH4++OH-,加入氢氧化钠固体时,平衡会向逆向移动,会产生较多的刺激性气味的气体,能用勒夏特利原理解释,故B错误; C、氢气与碘蒸气反应的平衡中,前后气体系数和是相等的,压强对平衡无影响,压缩气体,碘单质的浓度增大,颜色加深,不能用勒夏特利原理解释,故C正确; D、二氧化氮和四氧化二氮混合气体的密闭容器置于冷水中,化学平衡向着生成四氧化二氮的方向进行,颜色变浅,能用勒夏特利原理解释,故D错误。
5.答案:A。
解析:1/2H2(g)+1/2X2(g) HX(g) ①
2HX(g) ?H2(g)+X2(g) ②
所以K2=0.01。
6.答案:C、D
【解析】本题是一道有关化学平衡的基础计算题,解题的关键是弄清各量的含义。
因n(D)=ν(D)*V*t=0.1mol/L?min*(4L)*(5min)=2mol, n(C):n(D)=2mol:2mol=1:1,所以x=2。
3A(气)+B(气) 2C(气)+2D(气)
起始量(mol) 6 5 0 0
变化量(mol) 3 1 2 2
平衡量(mol) 3 4 2 2
B的转化率为:
平衡时A的浓度:
,所以
四、课堂小结
五、 课后作业
1. 可逆反应N2和H2合成NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是 ( )
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
2. 压强变化不会使下列化学反应的平衡发生移动的是 ( )
①H2(g)+I2(g) 2HI(g) ②3H2(g)+N2(g) 2NH3(g)
③2SO2(g)+O2(g) 2SO3(g) ④FeO(s)+CO (g) CO(g) +Fe(s)
A.②③ B.②④ C.①③ D.①④
3.从植物花中可提取一种简写为HIn的有机物,它在水溶液中因存在下列平衡:
HIn(溶液,红色)H+(溶液)+In-(溶液,黄色) 而用作酸碱指示剂。往该溶液中加入Na2O2
粉末,则溶液颜色为( )
A 、黄色变浅 B、红色变深 C 、 黄色变深 D 、 褪为无色
4. 对于反应2A(g)+xB(g) 4C(g)达到平衡时,C的浓度为1.2mol/L,当其它条件不变,把体积扩大1倍时,测得C的浓度为0.7mol/L,则x的值为 ( )
A.1 B.2 C.3 D.4
5. 恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
(1)若反应进行到某时刻t时,n(N2)=13 mol,n(NH3)=6 mol,计算a的值。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n始∶n平=________。
(4)原混合气体中,a∶b=________。
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)=________。
1. 答案:C
解析:因化学反应达到平衡时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质)。
2. 答案:A。
解析:A和D选项,反应中气体的计量数之和反应前后相等,压强改变,正逆反应速率改变的倍数相等,平衡不移动; B和C选项,反应中气体的计量数之和反应前后不相等,正反应是气体体积减小的反应,增大压强,V正>V逆,平衡右移,反之左移。
3. 答案:D
解析:过氧化钠溶于水生成强碱氢氧化钠,溶液显碱性,指示剂先变黄,然后又因为过氧化钠的强氧化性使指示剂褪色,变为无色。
4. 答案:A。
解析:其它条件不变,把体积扩大1倍时,假定平衡不移动,C的浓度为0.6mol/L,实际C的浓度为0.7mol/L,大于0.6mol/L,说明条件扩大,降低压强平衡向生成C的方向移动,降低压强平衡向气体体积增大的方向移动,则:x+2<4,且x为整数,故x=1,故选A.
5. 【解析】 (1)由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1∶2。
设反应掉的N2的物质的量为x mol,则x∶6=1∶2,解之x=3 则a=13+3=16。
(2)平衡时NH3的物质的量为(716.8 L/22.4 L·mol-1)×25%=8 mol。
(3)可利用差量法计算:假设气体总物质的量减少y,
所以原混合气体的总的物质的量为716.8 L/22.4 L·mol-1+8 mol=40 mol。原混合气体与平衡混合气体总物质的量之比为40∶32=5∶4。
(4)前面已经计算出来原混合气体中a=16,所以H2的物质的量b=40-16=24
所以a∶b=16∶24=2∶3。
