课题1 生活中常见的盐(第二课时)课件
图片预览










文档简介
课件50张PPT。课题1 生活中常见的盐 碳酸钠、碳酸氢钠和碳酸钙是几种比较重要的盐。 1、碳酸钠(Na2CO3) 碳酸钠俗称纯碱、苏打,是白色粉末状物质,易溶于水,水溶液显碱性。1)因为其水溶液呈碱性,故称纯碱;所以, 纯碱不是碱,而是盐2)用途:
碳酸钠是化学工业的重要产品之一,它广泛用于制造玻璃,利用碱性制肥皂,造纸、纺织品等。 我国制碱工业的先驱——侯德榜 在中国化学工业史上,有一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的大厦,这位先驱者就是被称为“国宝”的侯德榜。 侯德榜一生在化工技术上有巨大贡献。创立了中国人自己的制碱工艺——侯氏制碱法。NH3+CO2+H2O = NH4HCO3 NH4HCO3+NaCl = NaHCO3↓+NH4Cl2、碳酸氢钠(NaHCO3) 碳酸氢钠俗称小苏打,细小白色晶体,较易溶于水。
碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一。在医疗上,它是治疗胃酸过多症的一种药剂。 3、碳酸钙(CaCO3) 石灰石、大理石的主要成分都是碳酸钙,它们都是重要的建筑材料。天安门前的华表、人民大会堂的不少柱子都是用大理石做的。 石灰石也是建筑上常用的石料。
石灰石是制生石灰的原料
( CaCO3 CaO+ CO2↑)
碳酸钙还可用作补钙剂。天安门前的华表补钙剂2.碳酸钙
1)洁白纯净的碳酸钙岩石叫汉白玉。
2)含杂质而有花纹的碳酸钙叫大理石。
3)质地致密的碳酸钙岩石叫石灰石。
CaCO3鸡蛋壳、贝
壳-主要成分 碳酸钙的用途石灰石——建筑、保健品、日用品的原材料。大理石——建筑材料。石灰石纯碱
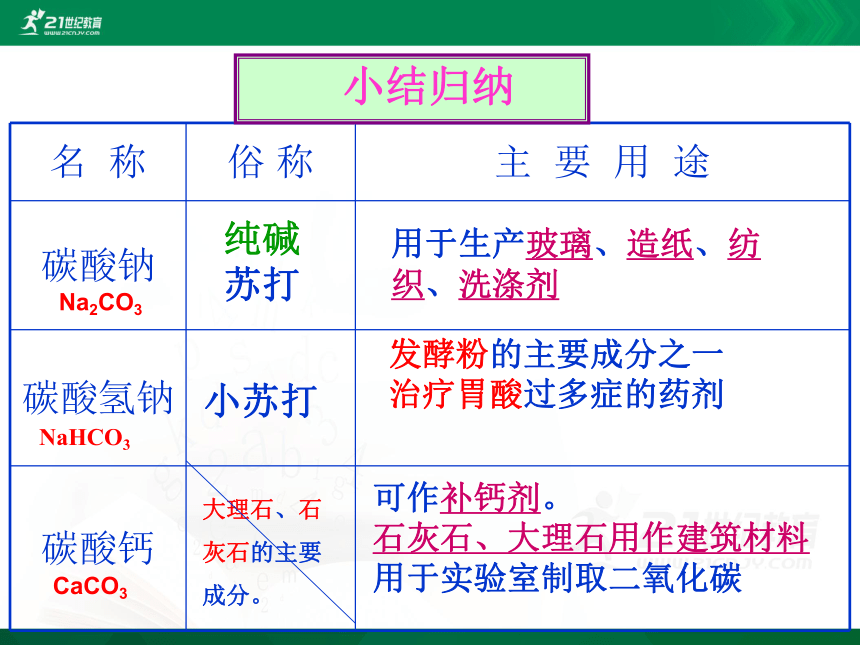
苏打小苏打大理石、石灰石的主要成分。用于生产玻璃、造纸、纺织、洗涤剂发酵粉的主要成分之一
治疗胃酸过多症的药剂 可作补钙剂。
石灰石、大理石用作建筑材料
用于实验室制取二氧化碳
CaCO3
NaHCO3
Na2CO3 小结归纳 实验室用_____________制取二氧化碳
反应原理是
_________________________
大理石和稀盐酸CaCO3+2HCI=CaCI2+H2O+CO2碳酸钠可以吗?碳酸氢钠呢?实验1.碳酸钠+盐酸2.碳酸氢钠+盐酸【演示实验11-1】白色固体溶解,放出使澄清石灰水变浑浊的无色气体碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体【练习】请同学们写出上述有关化学方程式。4.CO32-、HCO3-的检验CaCO3 + 2HCl == CaCl2 + H2O + CO2↑Na2CO3 + 2HCl==2NaCl + H2O + CO2↑NaHCO3 + HCl == NaCl + H2O + CO2↑某物质产生气体变浑浊CO2CaCO3碳酸盐某同学往一无色溶液中滴加稀盐酸,发现生成一种无色气体,将生成的气体通入澄清石灰水,发现石灰水变浑浊,于是他得出了该溶液中含有碳酸根离子,你认为他的结论正确么?为什么?CO32-或HCO3-检验方法?
向待测液中滴加稀盐酸,有气体产生,将气体通入澄清石灰水中,石灰水变浑浊,则待测液中含有CO32-(碳酸根离子)或HCO3-(碳酸氢根离子)。4、将珍珠放入稀盐酸中,有气泡产生,生成的气体能使澄清的石灰水变浑浊,则珍珠中含有下列离子中的( )。
C A、氯离子 B、硫酸根离子
C、碳酸根离子 D、氢氧根离子课堂训练
大家结合这些化学反应看能发现有什么共同点?
复分解反应:两种化合物在反应时互相交换成分生成另外两种化合物的反应。一般形式:AB + CD === CB + AD特点:双交换,价(化合价)不变请问:中和反应是不是复分解反应?
HCl + NaOH == NaCl + H2O答:中和反应是复分解反应。 哪些物质之间的反应属于复分解反应?复分解反应的发生是否需要条件?思考:拓展探究一实验11-2 碳酸钠溶液中滴加澄清石灰水实验11-3 硫酸铜溶液中滴加氢氧化钠溶液和氯化钡溶液。实验11-2 向盛有少量碳酸钠溶液的试管里滴入澄清的石灰水,观察现象。溶液变浑浊Na2CO3 + Ca(OH)2 == CaCO3↓+ 2NaOHNaOH的工业制取:
用纯碱Na2CO3和熟石灰Ca(OH)2制取烧碱Na2CO3 + Ca(OH)2 == CaCO3↓+ 2NaOH由纯碱制烧碱纯碱烧碱实验11-3 向硫酸铜溶液里滴入氢氧化钠溶液。产生蓝色沉淀CuSO4 + NaOH == Cu(OH)2↓+ Na2SO4实验11-3 向硫酸铜溶液里滴入氯化钡溶液。产生白色沉淀CuSO4 + BaCl2 == BaSO4↓+ CuCl2(1)HCl+ NaOH== H2O + NaCl
(2)CaCO3 +2HCl==CaCl2 + H2O+CO2↑
(3)Na2CO3 + 2HCl==2NaCl + H2O+CO2↑
(4)Na2CO3 + Ca(OH)2== 2NaOH + CaCO3↓
(5)CuSO4 + NaOH == Cu(OH)2↓+ Na2SO4
(6)CuSO4 + BaCl2 == BaSO4↓+ CuCl2H2CO3H2CO3复分解反应的条件(1)生成水;
(2)生成气体;
(3)生成沉淀。练习一:判断下列反应能否发生,如能发生请写出相应的化学方程式例:AgNO3 + HCl =
NaOH + KNO3 = AgNO3 + HCl = AgCl ↓+ HNO3
NaOH + KNO3 = 不反应 P114说出酸、碱、盐的溶解性规律(20℃)物质溶解性口诀:
酸都溶:
碱只溶:NH4OH、KOH、NaOH、Ba(OH)2
Ca(OH)2微溶。
钾(K)、钠(Na)、铵(NH4)盐均可溶。
硝酸盐(NO3-)入水无影踪。
盐酸盐不溶氯化银(AgCl)。
硫酸盐难溶硫酸钡(BaSO4)。
至于还有碳酸盐,只溶钾、钠、铵。这些你都能记住吗?常见7个沉淀:五白一蓝一红褐【课堂练习】【练习1】判断下列物质是否溶于水:(1)Na2CO3 (2)AgCl
(3)BaCO3 (4)MgSO4
(5)BaSO4 (6)Cu(OH)2
(7)(NH4)2SO4 (8)Ba(OH)2
(9)Mg(OH)2 (10)AgNO3
(11)NaNO3 (12)Fe(OH)3 白色↓白色↓白色↓蓝色↓白色↓红褐色↓ 书写下列方程式:1、盐+酸=新盐+新酸(1) Na2CO3+ HCl=== (2) AgNO3+HCl===(3) BaCl2+H2SO4===AgCl↓ + HNO3BaSO4↓ + 2HCl现象:白色固体逐渐溶解,产生大量气泡,产生的气体能使澄清的石灰水变浑浊。现象:生成白色沉淀,且白色沉淀不溶于稀硝酸。现象:生成白色沉淀,且白色沉淀不溶于稀硝酸。几种常见离子的检验1.氯离子(Cl-)的检验2.硫酸根离子(SO42-)的检验①滴加硝酸钡,现象:生成白色沉淀②滴加稀硝酸,现象:沉淀不溶解①滴加硝酸银,现象:生成白色沉淀②滴加稀硝酸,现象:沉淀不溶解(2)盐+酸——新盐+新酸BaCl2 + H2SO4 ===CaCO3+2HCl ==CaCO3 +H2SO4 ==(复分解反应)无↓无↓无↓AgNO3 + HCl ==BaSO4↓+ 2HClCaCl2 + CO2↑+H2OCaSO4+H2O+CO2↑AgCl ↓ +HNO3(1) Na2CO3+Ca(OH)2(2) CuSO4+ NaOH (3) FeCl3+ Ba(OH)2 现象:生成白色沉淀。现象:生成蓝色沉淀。现象:生成红褐色沉淀。=== CaCO3↓+ 2NaOH(3)盐(溶液)+碱(溶液)——新盐+新碱CuSO4+2NaOH ==Cu(OH)2↓ +Na2SO4(复分解反应)Mg(OH)2不溶水Mg(OH)2不溶水CaCO3不溶水反应物不溶水无↓(1) Na2CO3+BaCl2(2) CuSO4+ Ba(NO3)2(3) AgNO3+NaCl=== CaCO3↓ + 2BaCl2 === AgCl↓ + NaNO3现象:生成白色沉淀。现象:生成白色沉淀。现象:生成白色沉淀。④金属+盐→新盐+新金属位于前面位于后面盐溶液无可溶性不要用K、Ca、Na置换盐溶液中的金属在金属活动性顺序表中,只有_________ 的金属才能把________的金属从它的___ 中置换出来,与氢的位置 __关;盐必须
是______盐。Zn + CuSO4 = ZnSO4 + Cu
(置换反应)判断下列反应是否能发生?CuSO4+ Fe ===BaCl2+ Fe ------ CaCO3 +Fe-----CuSO4+ K -----CaCO3不溶于水Ba不在金属活动性顺序??FeSO4 + CuK太活泼了,会先与溶液中的水反应?探究五:请归纳盐的化学性质(可溶)(可溶)(可溶)(可溶)(可溶)(至少有一种沉淀)(至少有一种沉淀)1.盐 + 金属 = 新盐 + 新金属 2.盐 + 酸 = 新盐 + 新酸 3.盐 + 碱 = 新盐 + 新碱4.盐 + 盐 = 新盐 + 新盐(置换反应)常见的复分解反应有五大类:1)金属氧化物+酸 盐 + 水
CuO + H2SO4 === CuSO4 + H2O
H2O + CO2↑常见7个沉淀:五白一蓝一红褐 【盐的水溶液的颜色】
1、铜盐(Cu 2+) 溶液: 蓝色
2、铁盐(Fe 3+ )溶液: 黄色
3、亚铁盐(Fe 2+ )溶液:浅绿色
4、高锰酸钾溶液:紫红色
5、其它盐溶液一般:无色一、现有①碳酸钠, ②碳酸钙、 ③碳酸氢钠 ④氯化钠、 ⑤盐酸,请用序号完成
(1)人体胃液中存在帮助消化的液体是_____
(2)发酵粉的主要成分之一是_____
(3)日常生活中重要的调味品是_____
(4)天安门前华表的主要成份是_____
(5)广泛用于制造玻璃的原材料是_____①②③④⑤【课堂练习】2、下列关于物质用途的说法中,错误的是( )
A.碳酸钙用作补钙剂
B.碳酸氢钠用于焙制糕点
C.纯碱溶液用于除水垢
D.食盐用作调味品 1、下列各组物质名称不代表同一物质的一组是( )
A.氯化钠、盐 B.氢氧化钠、苛性钠
C.碳酸钠、纯碱 D.碳酸氢钠、小苏打
AC3、下列化学反应属复分解反应的是( ) A、Zn+H2SO4 =ZnSO4+H2↑
B、2KMnO4 = K2MnO4+MnO2+O2↑ C、CaO+H2O=Ca(OH)2 D、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 D课堂训练4、下列各组物质间不能反应的是( )
A、HCl + AgNO3
B、H2SO4 + NaOH
C、Ca(OH)2 + Na2CO3
D、NaCl + KNO35、下列能共存于水溶液中的是( )
A、 KCl AgNO3 B、 H2SO4 BaCl2
C、 HCl Ca(OH)2 D、 KOH NaNO3DD【题6】下列各组离子在酸性溶液中能大量共存的( )
A. Ag+ 、Na+ 、Cl- 、NO3-
B. Na+ 、OH- 、SO42-
C. K+ 、Na+ 、CO32- 、Cl-
D. Ba2+ 、Mg2+ 、Cl- D【例7】请将除去下列物质中的杂质的试剂的化学式填在短线上
FeSO4(CuSO4)________
NaOH(Na2CO3)________
NaNO3(NaCl)_______FeCa(OH)2AgNO3【练习8】有Ba(OH)2溶液、BaCl2溶液、Na2CO3溶液、H2SO4溶液四种物质,两物质间能发生的化学反应共有( )
A. 3个 B. 4个 C. 5个 D. 6个C【练习9】 下列各组离子在溶液中能大量共存的是( )。
A、Ca2+ Cl- Na+ CO32-
B、H+ K+ NO3- OH-
C、H+ Na+ SO42- CO32-
D、K+ Na+ NO3- SO42-D 小军先将原料放入足量的水中,请写出所发生的化学反应:
______________________________
______________________________
课堂练习:小军购得一包制皮蛋的材料,说明如下原料:碳酸钠,氧化钙,氯化钠
制法:将原料溶于冷开水,再将鲜鸡蛋放在其中,数天后即可CaO+H2O=Ca(OH)2
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH浮沉中的鸡蛋将一个新鲜的鸡蛋放在盛有水和足量稀盐酸的烧杯中,观察现象,并解释其中的原因? 因为CaCO3和稀HCl反应生成CO2气体,气泡附着在蛋壳上,使鸡蛋所受的浮力变大,当浮力大于鸡蛋的重力时,鸡蛋上浮;当鸡蛋浮到水面时,气泡破裂,鸡蛋所受浮力变小,浮力小于鸡蛋重力,所以鸡蛋下沉。【小组合作】写出下列反应的方程式,并讨论它们是否属于复分解反应。
1.盐酸除铁锈。
2.氢氧化镁中和胃酸
3纯碱制烧碱。
4硫酸铜溶液与氢氧化钠溶液反应。
5.硫酸溶液与碳酸钠反应6HCl+2Fe2O3===2FeCl3+3H2OMg(OH)2+2HCl==MgCl2+2H2OCa(OH)2+Na2CO3==2NaCl+CaCO3↓CuSO4+2NaOH==Cu(OH)2↓+Na2SO4H2SO4+Na2CO3==Na2SO4+H2O+CO2↑一些常见物质的化学式及俗称NaClNaOHH2O2HClCa(OH)2CaCO3CuSO4·5H2ONaHCO3CaO盐碱氧化物碱盐盐盐氧化物石灰石和石灰岩地区的溶洞溶洞的形成
石灰岩的主要成分是碳酸钙。碳酸钙遇到溶有二氧化碳的水时,会慢慢变成可溶于水的碳酸氢钙Ca(HCO3)2]
CaCO3+H2O+CO2=Ca(HCO3)2
当受热或压强突然变小时,水中碳酸氢钙会分解,重新变成碳酸钙沉积下来。
Ca(HCO3)2=CaCO3↓+CO2↑+H2O
在自然界里不断发生上述反应,石灰岩逐渐变成碳酸氢钙而溶解掉,形成溶洞;碳酸氢钙不断分解,生成的碳酸钙逐渐沉积,形成千姿百态的钟乳石、石笋和石柱。 谢谢21世纪教育网(www.21cnjy.com) 中小学教育资源网站 有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
碳酸钠是化学工业的重要产品之一,它广泛用于制造玻璃,利用碱性制肥皂,造纸、纺织品等。 我国制碱工业的先驱——侯德榜 在中国化学工业史上,有一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的大厦,这位先驱者就是被称为“国宝”的侯德榜。 侯德榜一生在化工技术上有巨大贡献。创立了中国人自己的制碱工艺——侯氏制碱法。NH3+CO2+H2O = NH4HCO3 NH4HCO3+NaCl = NaHCO3↓+NH4Cl2、碳酸氢钠(NaHCO3) 碳酸氢钠俗称小苏打,细小白色晶体,较易溶于水。
碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一。在医疗上,它是治疗胃酸过多症的一种药剂。 3、碳酸钙(CaCO3) 石灰石、大理石的主要成分都是碳酸钙,它们都是重要的建筑材料。天安门前的华表、人民大会堂的不少柱子都是用大理石做的。 石灰石也是建筑上常用的石料。
石灰石是制生石灰的原料
( CaCO3 CaO+ CO2↑)
碳酸钙还可用作补钙剂。天安门前的华表补钙剂2.碳酸钙
1)洁白纯净的碳酸钙岩石叫汉白玉。
2)含杂质而有花纹的碳酸钙叫大理石。
3)质地致密的碳酸钙岩石叫石灰石。
CaCO3鸡蛋壳、贝
壳-主要成分 碳酸钙的用途石灰石——建筑、保健品、日用品的原材料。大理石——建筑材料。石灰石纯碱
苏打小苏打大理石、石灰石的主要成分。用于生产玻璃、造纸、纺织、洗涤剂发酵粉的主要成分之一
治疗胃酸过多症的药剂 可作补钙剂。
石灰石、大理石用作建筑材料
用于实验室制取二氧化碳
CaCO3
NaHCO3
Na2CO3 小结归纳 实验室用_____________制取二氧化碳
反应原理是
_________________________
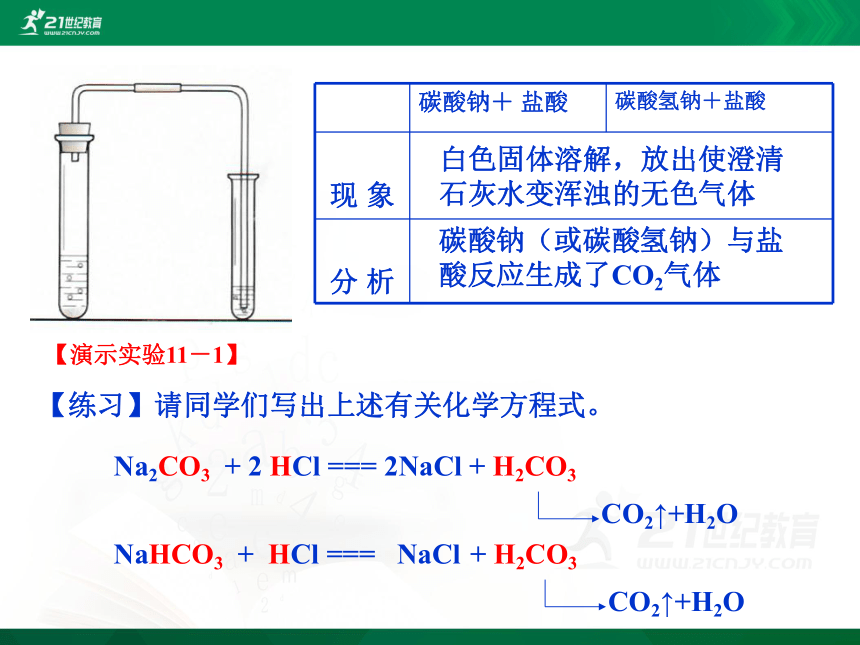
大理石和稀盐酸CaCO3+2HCI=CaCI2+H2O+CO2碳酸钠可以吗?碳酸氢钠呢?实验1.碳酸钠+盐酸2.碳酸氢钠+盐酸【演示实验11-1】白色固体溶解,放出使澄清石灰水变浑浊的无色气体碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体【练习】请同学们写出上述有关化学方程式。4.CO32-、HCO3-的检验CaCO3 + 2HCl == CaCl2 + H2O + CO2↑Na2CO3 + 2HCl==2NaCl + H2O + CO2↑NaHCO3 + HCl == NaCl + H2O + CO2↑某物质产生气体变浑浊CO2CaCO3碳酸盐某同学往一无色溶液中滴加稀盐酸,发现生成一种无色气体,将生成的气体通入澄清石灰水,发现石灰水变浑浊,于是他得出了该溶液中含有碳酸根离子,你认为他的结论正确么?为什么?CO32-或HCO3-检验方法?
向待测液中滴加稀盐酸,有气体产生,将气体通入澄清石灰水中,石灰水变浑浊,则待测液中含有CO32-(碳酸根离子)或HCO3-(碳酸氢根离子)。4、将珍珠放入稀盐酸中,有气泡产生,生成的气体能使澄清的石灰水变浑浊,则珍珠中含有下列离子中的( )。
C A、氯离子 B、硫酸根离子
C、碳酸根离子 D、氢氧根离子课堂训练
大家结合这些化学反应看能发现有什么共同点?
复分解反应:两种化合物在反应时互相交换成分生成另外两种化合物的反应。一般形式:AB + CD === CB + AD特点:双交换,价(化合价)不变请问:中和反应是不是复分解反应?
HCl + NaOH == NaCl + H2O答:中和反应是复分解反应。 哪些物质之间的反应属于复分解反应?复分解反应的发生是否需要条件?思考:拓展探究一实验11-2 碳酸钠溶液中滴加澄清石灰水实验11-3 硫酸铜溶液中滴加氢氧化钠溶液和氯化钡溶液。实验11-2 向盛有少量碳酸钠溶液的试管里滴入澄清的石灰水,观察现象。溶液变浑浊Na2CO3 + Ca(OH)2 == CaCO3↓+ 2NaOHNaOH的工业制取:
用纯碱Na2CO3和熟石灰Ca(OH)2制取烧碱Na2CO3 + Ca(OH)2 == CaCO3↓+ 2NaOH由纯碱制烧碱纯碱烧碱实验11-3 向硫酸铜溶液里滴入氢氧化钠溶液。产生蓝色沉淀CuSO4 + NaOH == Cu(OH)2↓+ Na2SO4实验11-3 向硫酸铜溶液里滴入氯化钡溶液。产生白色沉淀CuSO4 + BaCl2 == BaSO4↓+ CuCl2(1)HCl+ NaOH== H2O + NaCl
(2)CaCO3 +2HCl==CaCl2 + H2O+CO2↑
(3)Na2CO3 + 2HCl==2NaCl + H2O+CO2↑
(4)Na2CO3 + Ca(OH)2== 2NaOH + CaCO3↓
(5)CuSO4 + NaOH == Cu(OH)2↓+ Na2SO4
(6)CuSO4 + BaCl2 == BaSO4↓+ CuCl2H2CO3H2CO3复分解反应的条件(1)生成水;
(2)生成气体;
(3)生成沉淀。练习一:判断下列反应能否发生,如能发生请写出相应的化学方程式例:AgNO3 + HCl =
NaOH + KNO3 = AgNO3 + HCl = AgCl ↓+ HNO3
NaOH + KNO3 = 不反应 P114说出酸、碱、盐的溶解性规律(20℃)物质溶解性口诀:
酸都溶:
碱只溶:NH4OH、KOH、NaOH、Ba(OH)2
Ca(OH)2微溶。
钾(K)、钠(Na)、铵(NH4)盐均可溶。
硝酸盐(NO3-)入水无影踪。
盐酸盐不溶氯化银(AgCl)。
硫酸盐难溶硫酸钡(BaSO4)。
至于还有碳酸盐,只溶钾、钠、铵。这些你都能记住吗?常见7个沉淀:五白一蓝一红褐【课堂练习】【练习1】判断下列物质是否溶于水:(1)Na2CO3 (2)AgCl
(3)BaCO3 (4)MgSO4
(5)BaSO4 (6)Cu(OH)2
(7)(NH4)2SO4 (8)Ba(OH)2
(9)Mg(OH)2 (10)AgNO3
(11)NaNO3 (12)Fe(OH)3 白色↓白色↓白色↓蓝色↓白色↓红褐色↓ 书写下列方程式:1、盐+酸=新盐+新酸(1) Na2CO3+ HCl=== (2) AgNO3+HCl===(3) BaCl2+H2SO4===AgCl↓ + HNO3BaSO4↓ + 2HCl现象:白色固体逐渐溶解,产生大量气泡,产生的气体能使澄清的石灰水变浑浊。现象:生成白色沉淀,且白色沉淀不溶于稀硝酸。现象:生成白色沉淀,且白色沉淀不溶于稀硝酸。几种常见离子的检验1.氯离子(Cl-)的检验2.硫酸根离子(SO42-)的检验①滴加硝酸钡,现象:生成白色沉淀②滴加稀硝酸,现象:沉淀不溶解①滴加硝酸银,现象:生成白色沉淀②滴加稀硝酸,现象:沉淀不溶解(2)盐+酸——新盐+新酸BaCl2 + H2SO4 ===CaCO3+2HCl ==CaCO3 +H2SO4 ==(复分解反应)无↓无↓无↓AgNO3 + HCl ==BaSO4↓+ 2HClCaCl2 + CO2↑+H2OCaSO4+H2O+CO2↑AgCl ↓ +HNO3(1) Na2CO3+Ca(OH)2(2) CuSO4+ NaOH (3) FeCl3+ Ba(OH)2 现象:生成白色沉淀。现象:生成蓝色沉淀。现象:生成红褐色沉淀。=== CaCO3↓+ 2NaOH(3)盐(溶液)+碱(溶液)——新盐+新碱CuSO4+2NaOH ==Cu(OH)2↓ +Na2SO4(复分解反应)Mg(OH)2不溶水Mg(OH)2不溶水CaCO3不溶水反应物不溶水无↓(1) Na2CO3+BaCl2(2) CuSO4+ Ba(NO3)2(3) AgNO3+NaCl=== CaCO3↓ + 2BaCl2 === AgCl↓ + NaNO3现象:生成白色沉淀。现象:生成白色沉淀。现象:生成白色沉淀。④金属+盐→新盐+新金属位于前面位于后面盐溶液无可溶性不要用K、Ca、Na置换盐溶液中的金属在金属活动性顺序表中,只有_________ 的金属才能把________的金属从它的___ 中置换出来,与氢的位置 __关;盐必须
是______盐。Zn + CuSO4 = ZnSO4 + Cu
(置换反应)判断下列反应是否能发生?CuSO4+ Fe ===BaCl2+ Fe ------ CaCO3 +Fe-----CuSO4+ K -----CaCO3不溶于水Ba不在金属活动性顺序??FeSO4 + CuK太活泼了,会先与溶液中的水反应?探究五:请归纳盐的化学性质(可溶)(可溶)(可溶)(可溶)(可溶)(至少有一种沉淀)(至少有一种沉淀)1.盐 + 金属 = 新盐 + 新金属 2.盐 + 酸 = 新盐 + 新酸 3.盐 + 碱 = 新盐 + 新碱4.盐 + 盐 = 新盐 + 新盐(置换反应)常见的复分解反应有五大类:1)金属氧化物+酸 盐 + 水
CuO + H2SO4 === CuSO4 + H2O
H2O + CO2↑常见7个沉淀:五白一蓝一红褐 【盐的水溶液的颜色】
1、铜盐(Cu 2+) 溶液: 蓝色
2、铁盐(Fe 3+ )溶液: 黄色
3、亚铁盐(Fe 2+ )溶液:浅绿色
4、高锰酸钾溶液:紫红色
5、其它盐溶液一般:无色一、现有①碳酸钠, ②碳酸钙、 ③碳酸氢钠 ④氯化钠、 ⑤盐酸,请用序号完成
(1)人体胃液中存在帮助消化的液体是_____
(2)发酵粉的主要成分之一是_____
(3)日常生活中重要的调味品是_____
(4)天安门前华表的主要成份是_____
(5)广泛用于制造玻璃的原材料是_____①②③④⑤【课堂练习】2、下列关于物质用途的说法中,错误的是( )
A.碳酸钙用作补钙剂
B.碳酸氢钠用于焙制糕点
C.纯碱溶液用于除水垢
D.食盐用作调味品 1、下列各组物质名称不代表同一物质的一组是( )
A.氯化钠、盐 B.氢氧化钠、苛性钠
C.碳酸钠、纯碱 D.碳酸氢钠、小苏打
AC3、下列化学反应属复分解反应的是( ) A、Zn+H2SO4 =ZnSO4+H2↑
B、2KMnO4 = K2MnO4+MnO2+O2↑ C、CaO+H2O=Ca(OH)2 D、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 D课堂训练4、下列各组物质间不能反应的是( )
A、HCl + AgNO3
B、H2SO4 + NaOH
C、Ca(OH)2 + Na2CO3
D、NaCl + KNO35、下列能共存于水溶液中的是( )
A、 KCl AgNO3 B、 H2SO4 BaCl2
C、 HCl Ca(OH)2 D、 KOH NaNO3DD【题6】下列各组离子在酸性溶液中能大量共存的( )
A. Ag+ 、Na+ 、Cl- 、NO3-
B. Na+ 、OH- 、SO42-
C. K+ 、Na+ 、CO32- 、Cl-
D. Ba2+ 、Mg2+ 、Cl- D【例7】请将除去下列物质中的杂质的试剂的化学式填在短线上
FeSO4(CuSO4)________
NaOH(Na2CO3)________
NaNO3(NaCl)_______FeCa(OH)2AgNO3【练习8】有Ba(OH)2溶液、BaCl2溶液、Na2CO3溶液、H2SO4溶液四种物质,两物质间能发生的化学反应共有( )
A. 3个 B. 4个 C. 5个 D. 6个C【练习9】 下列各组离子在溶液中能大量共存的是( )。
A、Ca2+ Cl- Na+ CO32-
B、H+ K+ NO3- OH-
C、H+ Na+ SO42- CO32-
D、K+ Na+ NO3- SO42-D 小军先将原料放入足量的水中,请写出所发生的化学反应:
______________________________
______________________________
课堂练习:小军购得一包制皮蛋的材料,说明如下原料:碳酸钠,氧化钙,氯化钠
制法:将原料溶于冷开水,再将鲜鸡蛋放在其中,数天后即可CaO+H2O=Ca(OH)2
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH浮沉中的鸡蛋将一个新鲜的鸡蛋放在盛有水和足量稀盐酸的烧杯中,观察现象,并解释其中的原因? 因为CaCO3和稀HCl反应生成CO2气体,气泡附着在蛋壳上,使鸡蛋所受的浮力变大,当浮力大于鸡蛋的重力时,鸡蛋上浮;当鸡蛋浮到水面时,气泡破裂,鸡蛋所受浮力变小,浮力小于鸡蛋重力,所以鸡蛋下沉。【小组合作】写出下列反应的方程式,并讨论它们是否属于复分解反应。
1.盐酸除铁锈。
2.氢氧化镁中和胃酸
3纯碱制烧碱。
4硫酸铜溶液与氢氧化钠溶液反应。
5.硫酸溶液与碳酸钠反应6HCl+2Fe2O3===2FeCl3+3H2OMg(OH)2+2HCl==MgCl2+2H2OCa(OH)2+Na2CO3==2NaCl+CaCO3↓CuSO4+2NaOH==Cu(OH)2↓+Na2SO4H2SO4+Na2CO3==Na2SO4+H2O+CO2↑一些常见物质的化学式及俗称NaClNaOHH2O2HClCa(OH)2CaCO3CuSO4·5H2ONaHCO3CaO盐碱氧化物碱盐盐盐氧化物石灰石和石灰岩地区的溶洞溶洞的形成
石灰岩的主要成分是碳酸钙。碳酸钙遇到溶有二氧化碳的水时,会慢慢变成可溶于水的碳酸氢钙Ca(HCO3)2]
CaCO3+H2O+CO2=Ca(HCO3)2
当受热或压强突然变小时,水中碳酸氢钙会分解,重新变成碳酸钙沉积下来。
Ca(HCO3)2=CaCO3↓+CO2↑+H2O
在自然界里不断发生上述反应,石灰岩逐渐变成碳酸氢钙而溶解掉,形成溶洞;碳酸氢钙不断分解,生成的碳酸钙逐渐沉积,形成千姿百态的钟乳石、石笋和石柱。 谢谢21世纪教育网(www.21cnjy.com) 中小学教育资源网站 有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
同课章节目录
