人教版高中化学 必修2 第一章 第2节 元素周期律
文档属性
| 名称 | 人教版高中化学 必修2 第一章 第2节 元素周期律 |  | |
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-02-20 21:17:46 | ||
图片预览






文档简介
第一章第一节 元素周期表
第2课时
元素的性质与原子结构
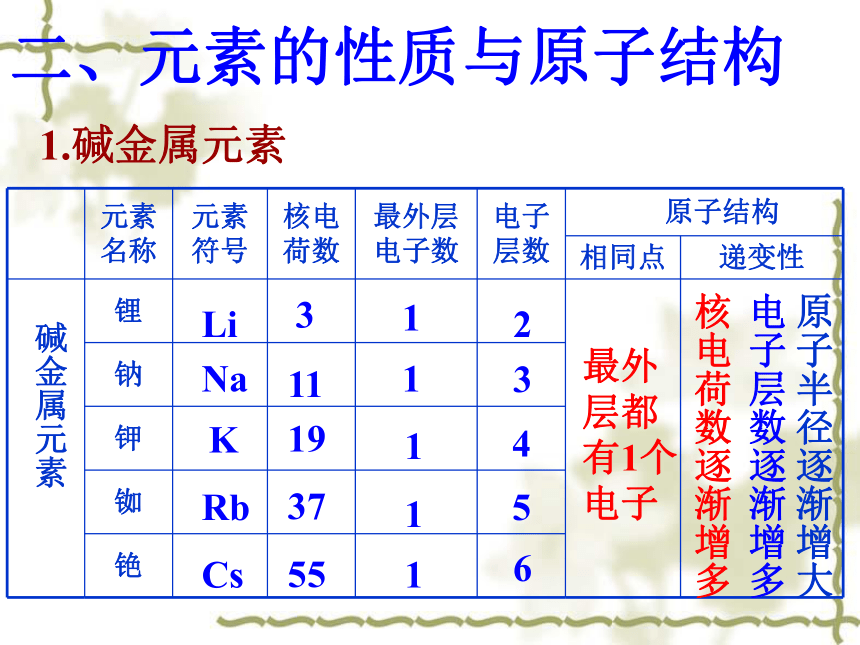
二、元素的性质与原子结构
1.碱金属元素
碱金属元素
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
最外
层都
有1个
电子
核电荷数逐渐增多
电子层数逐渐增多
原子半径逐渐增大
元素
名称 元素
符号 核电
荷数 最外层电子数 电子
层数 原子结构
相同点 递变性
锂
钠
钾
铷
铯
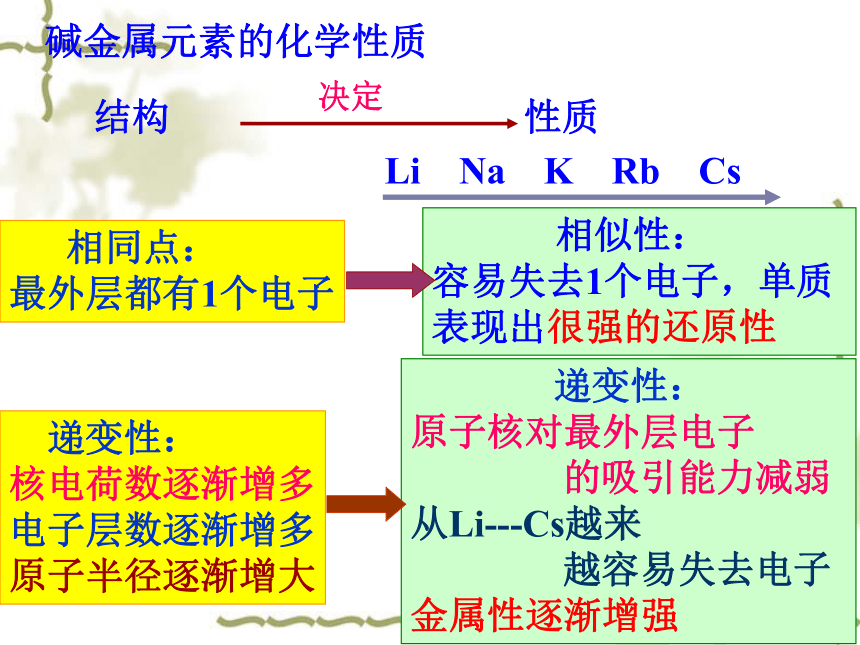
碱金属元素的化学性质
递变性:
核电荷数逐渐增多
电子层数逐渐增多
原子半径逐渐增大
相同点:
最外层都有1个电子
相似性:
容易失去1个电子,单质
表现出很强的还原性
递变性:
原子核对最外层电子
的吸引能力减弱
从Li---Cs越来
越容易失去电子
金属性逐渐增强
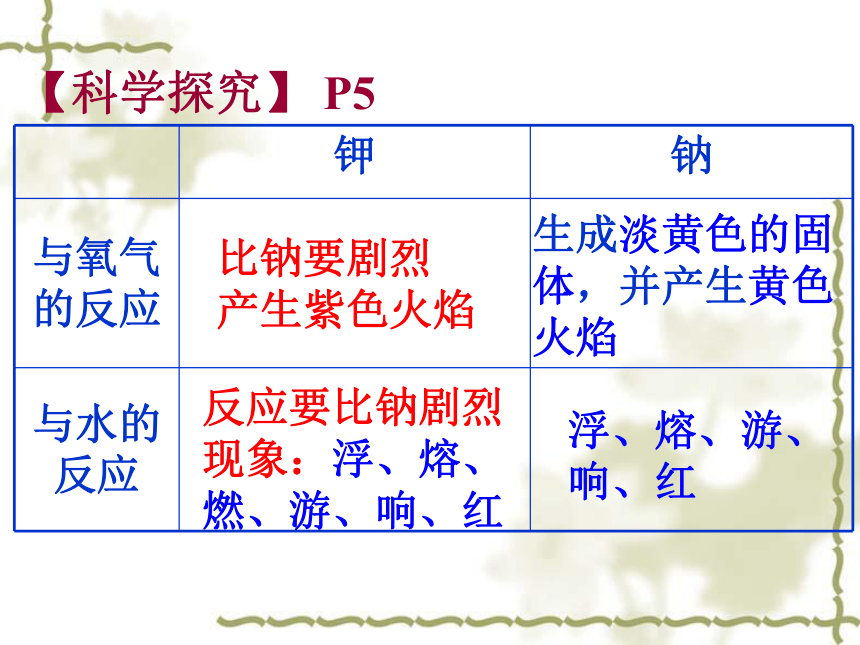
【科学探究】 P5
[实验1]钾在空气中燃烧
将一干燥的坩埚加热,同时取一小块钾,擦干表面的煤油后,迅速投到热坩埚中,观察现象,并对比钠在空气中的燃烧。
[实验2]钠、钾在烧杯中与水反应
在培养皿中放入一些水,然后取绿豆大的钾,用滤纸吸干表面的煤油,投入培养皿中,观察现象,并对比钠与水的反应。
【科学探究】 P5
生成淡黄色的固体,并产生黄色火焰
浮、熔、游、
响、红
比钠要剧烈
产生紫色火焰
反应要比钠剧烈
现象:浮、熔、燃、游、响、红
钾 钠
与氧气的反应
与水的反应
碱金属元素的单质的性质:
1、与非金属单质的反应:
4Na+O2===2Na2O
(氧化钠)
4K+O2===2K2O
(氧化钾)
4Li+O2===2Li2O
(氧化锂)
点燃
2Na+O2===Na2O2
点燃
(过氧化钠)
2K+O2===K2O2
△
(过氧化钾)
K+O2===KO2
△
(超氧化钾)
Rb、Cs遇空气即燃烧
Li Na K
常温
非常温
2、与水反应
2Na+2H2O==2NaOH+H2↑
2K+2H2O==2KOH+H2↑
(反应特点:浮,熔,游,响,红)
2Li+2H2O==2LiOH+H2↑
(比钠更剧烈)
(十分缓慢,因为生成的LiOH微溶于水,反应慢,且Li不熔化)
碱金属元素的单质的性质:
Rb、Cs与水即燃烧爆炸
碱金属元素的物理性质
柔软
小
低
好
逐渐变大(K例外)
逐渐降低
Li Na K Rb Cs
相
似
性 颜色 银白色(Cs略带金色)
硬度
密度
熔点
导电导热
递变规律 密度变化
熔沸点变化
对于同族元素而言
核电荷数逐渐增多
电子层数依次增加
失电子能力逐渐增强
金属性逐渐增强
从上到下
结论
随堂练习
1.下列关于碱金属的化学性质的叙述中,错误的是 ( )
A.它们的化学性质都很活泼
B.它们都是强还原剂
C.它们都能在空气中燃烧生成M2O
D.它们都能与水反应生成氢气和碱。
2.在实验室中,少量的钠、钾应当保存在( )
A.水中 B.煤油中 C. 汽油中 D.CCl4中
C
B
3.碱金属的原子最外层都有 个电子,在化学反应中容易 电子,形成 离子,它们都可以做 剂,在碱金属中,密度最小的是 ,熔点最低的是 ,金属性最强的是 。
1
阳
失去
还原
Li
Cs
Cs
4.钾和钠各1g,分别与足量的水反应,其中,反应更剧烈的是 ,在标准状况下,生成气体的体积多的是 。
5.关于金属锂的叙述,错误的是( )
A.与水反应时,比钠还剧烈。
B.它的原子半径比钠的原子半径小。
C.它是密度最小的碱金属。
D.它可以做还原剂。
K
Na
A
氟
氯
溴
碘
核电荷数
电子层排布
元素符号
F
Cl
Br
I
9
17
35
53
2,7
2,8,7
2,8,18,7
2,8,18,18,7
卤素
2.卤族元素
P7学与问
卤族元素的化学性质
递变性:
核电荷数逐渐增多
电子层数逐渐增多
原子半径逐渐增大
相同点:
最外层都有7个电子
相似性:
容易得到1个电子,单质
表现出很强的氧化性
递变性:
原子核吸引电子
的能力减弱
从F---I 越来
越难得到电子
非金属性逐渐减弱
1. 卤素单质与氢气反应
卤素单质与氢气反应
剧烈程度:F2>Cl2>Br2>I2
生成氢化物稳定性:HF>HCl>HBr>HI
[实验1]
将少量氯水分别注盛有NaBr溶液和KI溶液的试管中,用力振荡后注入少量四氯化碳,振荡。观察
[实验2]
将少量的溴水注入盛有KI溶液的试管中,用力振荡后注入少量的四氯化碳。观察四氯化碳层和水层颜色的变化。
2. 单质间的置换反应
Cl2+2KI===2KCl+I2
Cl2+2NaBr===2NaCl+Br2
Br2+2KI===2KBr +I2
阅读自学:课本P8 资料卡片
卤素单质的物理性质
对于同族元素而言
核电荷数逐渐增多
电子层数依次增加
得电子能力逐渐减弱
非金属性逐渐减弱
从上到下
结论
对于同族元素而言
核电荷数逐渐增多
电子层数依次增加
得电子能力逐渐减弱
失电子能力逐渐增强
金属性逐渐增强
非金属性逐渐减弱
从上到下
结论
6.下列关于F、Cl、Br、I 性质的比较,不正确的是( )
A.它们的核外电子层数随核电荷数的增加而增多。
B.被其它卤素单质从卤化物中置换出来的可能性随核电荷数的增加而增大。
C.它们的氢化物的稳定性随核电荷数的增加而增强。
D.它们的单质的颜色随核电荷数的增加而加深。
C
7.向含有NaBr和KI 的混合溶液中通入过量Cl2,充分反应,将溶液蒸干,并灼烧所得的物质,最后剩余的固体物质是( )
A.NaCl和KI B.NaCl、KCl和I2
C.KCl和NaBr D.KCl和NaCl
8.各组性质的比较中,正确的是( )
A.还原性:HF>HCl>HBr>HI
B.稳定性:HFC.与水反应的难易:Cl2>Br2>I2>F2
D.沸点:F2D
D
金属性强弱的判断方法?
金属性强弱的判断方法 说明
①?单质与水(或酸)反应置换出H2的难易 越易反应,元素的金属性越强
②?最高价氧化物水化物(M(OH)n)的碱性强弱 碱性越强,元素的金属性越强
③?金属与盐溶液的置换反应 活泼的金属能置换出较不活泼的金属
④?单质的还原性(或离子的氧化性) 单质的还原性越强,该元素的金属性越强
非金属性强弱的判断方法?
非金属性强弱的判断方法 说明
①?与H2化合的难易 越易化合,元素的非金属性越强
② 与H2化合生成的氢化物的稳定性 氢化物越稳定,元素的非金属性越强
③ 最高价氧化物的水化物(HnROm)的酸性强弱 酸性越强,元素的非金属性越强
④ 非金属单质与盐溶液的置换反应 活泼的非金属能置换出较不活泼的非金属
⑤ 单质的氧化性(或离子的还原性) 单质的氧化性越强,该元素的非金属性越强
第2课时
元素的性质与原子结构
二、元素的性质与原子结构
1.碱金属元素
碱金属元素
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
最外
层都
有1个
电子
核电荷数逐渐增多
电子层数逐渐增多
原子半径逐渐增大
元素
名称 元素
符号 核电
荷数 最外层电子数 电子
层数 原子结构
相同点 递变性
锂
钠
钾
铷
铯
碱金属元素的化学性质
递变性:
核电荷数逐渐增多
电子层数逐渐增多
原子半径逐渐增大
相同点:
最外层都有1个电子
相似性:
容易失去1个电子,单质
表现出很强的还原性
递变性:
原子核对最外层电子
的吸引能力减弱
从Li---Cs越来
越容易失去电子
金属性逐渐增强
【科学探究】 P5
[实验1]钾在空气中燃烧
将一干燥的坩埚加热,同时取一小块钾,擦干表面的煤油后,迅速投到热坩埚中,观察现象,并对比钠在空气中的燃烧。
[实验2]钠、钾在烧杯中与水反应
在培养皿中放入一些水,然后取绿豆大的钾,用滤纸吸干表面的煤油,投入培养皿中,观察现象,并对比钠与水的反应。
【科学探究】 P5
生成淡黄色的固体,并产生黄色火焰
浮、熔、游、
响、红
比钠要剧烈
产生紫色火焰
反应要比钠剧烈
现象:浮、熔、燃、游、响、红
钾 钠
与氧气的反应
与水的反应
碱金属元素的单质的性质:
1、与非金属单质的反应:
4Na+O2===2Na2O
(氧化钠)
4K+O2===2K2O
(氧化钾)
4Li+O2===2Li2O
(氧化锂)
点燃
2Na+O2===Na2O2
点燃
(过氧化钠)
2K+O2===K2O2
△
(过氧化钾)
K+O2===KO2
△
(超氧化钾)
Rb、Cs遇空气即燃烧
Li Na K
常温
非常温
2、与水反应
2Na+2H2O==2NaOH+H2↑
2K+2H2O==2KOH+H2↑
(反应特点:浮,熔,游,响,红)
2Li+2H2O==2LiOH+H2↑
(比钠更剧烈)
(十分缓慢,因为生成的LiOH微溶于水,反应慢,且Li不熔化)
碱金属元素的单质的性质:
Rb、Cs与水即燃烧爆炸
碱金属元素的物理性质
柔软
小
低
好
逐渐变大(K例外)
逐渐降低
Li Na K Rb Cs
相
似
性 颜色 银白色(Cs略带金色)
硬度
密度
熔点
导电导热
递变规律 密度变化
熔沸点变化
对于同族元素而言
核电荷数逐渐增多
电子层数依次增加
失电子能力逐渐增强
金属性逐渐增强
从上到下
结论
随堂练习
1.下列关于碱金属的化学性质的叙述中,错误的是 ( )
A.它们的化学性质都很活泼
B.它们都是强还原剂
C.它们都能在空气中燃烧生成M2O
D.它们都能与水反应生成氢气和碱。
2.在实验室中,少量的钠、钾应当保存在( )
A.水中 B.煤油中 C. 汽油中 D.CCl4中
C
B
3.碱金属的原子最外层都有 个电子,在化学反应中容易 电子,形成 离子,它们都可以做 剂,在碱金属中,密度最小的是 ,熔点最低的是 ,金属性最强的是 。
1
阳
失去
还原
Li
Cs
Cs
4.钾和钠各1g,分别与足量的水反应,其中,反应更剧烈的是 ,在标准状况下,生成气体的体积多的是 。
5.关于金属锂的叙述,错误的是( )
A.与水反应时,比钠还剧烈。
B.它的原子半径比钠的原子半径小。
C.它是密度最小的碱金属。
D.它可以做还原剂。
K
Na
A
氟
氯
溴
碘
核电荷数
电子层排布
元素符号
F
Cl
Br
I
9
17
35
53
2,7
2,8,7
2,8,18,7
2,8,18,18,7
卤素
2.卤族元素
P7学与问
卤族元素的化学性质
递变性:
核电荷数逐渐增多
电子层数逐渐增多
原子半径逐渐增大
相同点:
最外层都有7个电子
相似性:
容易得到1个电子,单质
表现出很强的氧化性
递变性:
原子核吸引电子
的能力减弱
从F---I 越来
越难得到电子
非金属性逐渐减弱
1. 卤素单质与氢气反应
卤素单质与氢气反应
剧烈程度:F2>Cl2>Br2>I2
生成氢化物稳定性:HF>HCl>HBr>HI
[实验1]
将少量氯水分别注盛有NaBr溶液和KI溶液的试管中,用力振荡后注入少量四氯化碳,振荡。观察
[实验2]
将少量的溴水注入盛有KI溶液的试管中,用力振荡后注入少量的四氯化碳。观察四氯化碳层和水层颜色的变化。
2. 单质间的置换反应
Cl2+2KI===2KCl+I2
Cl2+2NaBr===2NaCl+Br2
Br2+2KI===2KBr +I2
阅读自学:课本P8 资料卡片
卤素单质的物理性质
对于同族元素而言
核电荷数逐渐增多
电子层数依次增加
得电子能力逐渐减弱
非金属性逐渐减弱
从上到下
结论
对于同族元素而言
核电荷数逐渐增多
电子层数依次增加
得电子能力逐渐减弱
失电子能力逐渐增强
金属性逐渐增强
非金属性逐渐减弱
从上到下
结论
6.下列关于F、Cl、Br、I 性质的比较,不正确的是( )
A.它们的核外电子层数随核电荷数的增加而增多。
B.被其它卤素单质从卤化物中置换出来的可能性随核电荷数的增加而增大。
C.它们的氢化物的稳定性随核电荷数的增加而增强。
D.它们的单质的颜色随核电荷数的增加而加深。
C
7.向含有NaBr和KI 的混合溶液中通入过量Cl2,充分反应,将溶液蒸干,并灼烧所得的物质,最后剩余的固体物质是( )
A.NaCl和KI B.NaCl、KCl和I2
C.KCl和NaBr D.KCl和NaCl
8.各组性质的比较中,正确的是( )
A.还原性:HF>HCl>HBr>HI
B.稳定性:HF
D.沸点:F2
D
金属性强弱的判断方法?
金属性强弱的判断方法 说明
①?单质与水(或酸)反应置换出H2的难易 越易反应,元素的金属性越强
②?最高价氧化物水化物(M(OH)n)的碱性强弱 碱性越强,元素的金属性越强
③?金属与盐溶液的置换反应 活泼的金属能置换出较不活泼的金属
④?单质的还原性(或离子的氧化性) 单质的还原性越强,该元素的金属性越强
非金属性强弱的判断方法?
非金属性强弱的判断方法 说明
①?与H2化合的难易 越易化合,元素的非金属性越强
② 与H2化合生成的氢化物的稳定性 氢化物越稳定,元素的非金属性越强
③ 最高价氧化物的水化物(HnROm)的酸性强弱 酸性越强,元素的非金属性越强
④ 非金属单质与盐溶液的置换反应 活泼的非金属能置换出较不活泼的非金属
⑤ 单质的氧化性(或离子的还原性) 单质的氧化性越强,该元素的非金属性越强
