人教高中化学 选修四 第四章、2.1--化学电源
文档属性
| 名称 | 人教高中化学 选修四 第四章、2.1--化学电源 |  | |
| 格式 | zip | ||
| 文件大小 | 710.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-02-18 17:11:55 | ||
图片预览






文档简介
第二节 化学电源
电解质:KOH
负极:Zn
Zn - 2e-+ 2OH- = Zn(OH)2
正极:MnO2
2MnO2+2e- +2H2O= 2MnOOH+2OH-
1、碱性锌-锰电池:
一、一次电池:
总反应:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
练习1: 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:
Zn?s?+2MnO2?s?+H2O?l?=Zn?OH?2?s?+Mn2O3?s?
下列说法错误的是 ( )
A? 电池工作时,锌失去电子
B? 电池正极电极反应式为:
2MnO2?s?+H2O?l?+2e?=Mn2O3?s?+2OH??aq?
C? 电池工作时,电子由正极通过外电路流向负极
D? 外电路每通过0?2 mol电子,锌的质量理论上减小6?5 g
C
2、锌银钮扣电池
正极:Ag2O
Ag2O+2e-+H2O=2Ag+2OH-
负极:Zn
Zn -2e-+2OH- =Zn(OH)2
总反应:Zn+Ag2O+ H2O=Zn(OH)2+2Ag
二、二次电池
1、铅蓄电池:
铅蓄电池是以平行排列的铅、铅锑合金栅板为主架,栅格中交替地填充着负极和正极的铅和二氧化铅,电解质为H2SO4溶液。
总反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O
Pb -2e- + SO42- =PbSO4
正极(PbO2):
PbO2 +2e- + 4H++SO42- =PbSO4 +2H2O
负极(Pb):
充电反应是上述过程的逆反应
放电过程:
铅蓄电池的充放电过程:
Pb+PbO2+2H2SO4 2PbSO4+2H2O
→充电时变阴极
→充电时变阳极
问题:反应一段时间后,电解液的PH如何变化?
问题:每转移1mole-时,消耗____mol硫酸。
1
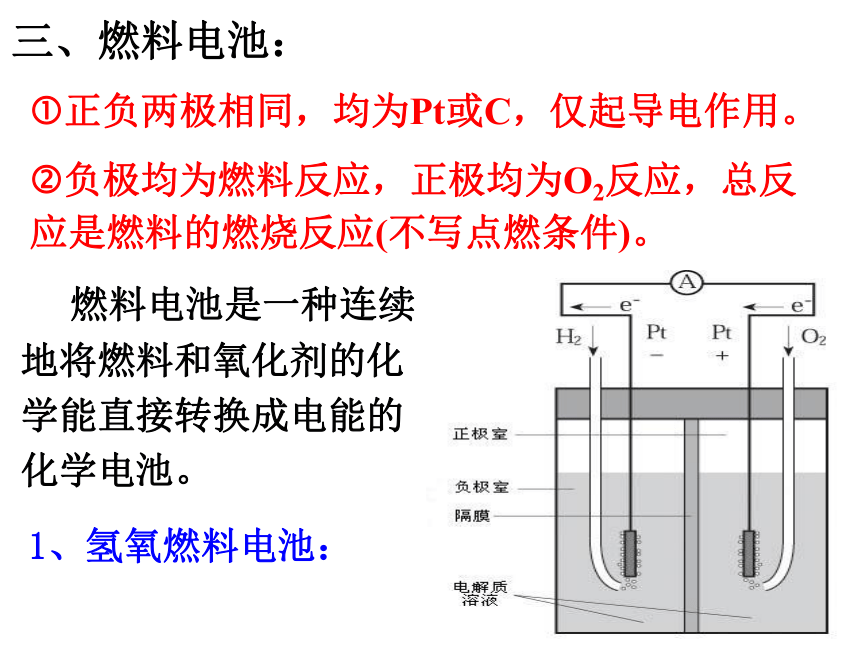
三、燃料电池:
燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。
1、氢氧燃料电池:
?正负两极相同,均为Pt或C,仅起导电作用。
?负极均为燃料反应,正极均为O2反应,总反应是燃料的燃烧反应(不写点燃条件)。
?电解液呈中性:
负极:
正极:
总反应:
2H2 - 4e- = 4H+
O2 + 2H2O + 4e-= 4OH-
2H2 +O2 =2H2O
?电解液呈酸性:
负极:
正极:
不变
O2 + 4H+ + 4e-= 2H2O
?电解液呈碱性:
负极:
正极:
2H2 +4OH-- 4e- = 4H2O
不变
1、氢氧燃料电池:
练习2:航天技术上使用的氢氧燃料电池具有高
能、轻便、无污染的优点。氢氧燃料电池有酸式
和碱式两种,它们放电时的总反应都可以表示为
2H2+O2=2H2O,酸式电池中电解质是酸,其负极反
应可表示为2H2-4e-=4H+ ,则其正极反应式
为 。碱式电池的电解质是碱,
其正极反应式为O2+2H2O+4e-=4OH-,则其负极反应
可表示为 。
O2+4e-+4H+=2H2O
2H2-4e-+4OH-=4H2O
2、甲烷碱性燃料电池:
电解质溶液:KOH
负极:
正极:
2O2 + 4H2O + 8e-= 8OH-
CH4- 8e-+10OH- =CO32- +7H2O
CH4+2O2+2KOH=K2CO3+3H2O
总反应:
1、电池是人类生产和生活中的重要能量来源,各式各样电池的发明是化学对人类的一项重大贡献,下列有关电池的叙述不正确的是( )
A.手机上用的锂离子电池属于二次电池
B.甲醇燃料电池中甲醇参与正极反应
C.碱性锌锰电池中,锌电极是负极
D.太阳能电池的主要材料是高纯度的硅
B
3、氢氧燃料电池是符合绿色化学理念的新型发电装置。关于以KOH为电解质的氢氧燃料电池叙述错误的是( )
A、氢氧燃料电池直接把热能转化为电能
B、电子从负极出发,沿导线流向正极
C、负极反应式为H2+2OH--2e- =2H2O
D、电解质 KOH的物质的量不发生变化
A
2、关于铅蓄电池放电时的说法正确的( )
A.电池的负极材料是铅板
B.正极发生的反应是 Pb +SO42--2e-= PbSO4
C.电池中硫酸的浓度不发生变化
D.负极质量减少、正极质量增加
A
减 少 污 染
节 约 资 源
电解质:KOH
负极:Zn
Zn - 2e-+ 2OH- = Zn(OH)2
正极:MnO2
2MnO2+2e- +2H2O= 2MnOOH+2OH-
1、碱性锌-锰电池:
一、一次电池:
总反应:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
练习1: 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:
Zn?s?+2MnO2?s?+H2O?l?=Zn?OH?2?s?+Mn2O3?s?
下列说法错误的是 ( )
A? 电池工作时,锌失去电子
B? 电池正极电极反应式为:
2MnO2?s?+H2O?l?+2e?=Mn2O3?s?+2OH??aq?
C? 电池工作时,电子由正极通过外电路流向负极
D? 外电路每通过0?2 mol电子,锌的质量理论上减小6?5 g
C
2、锌银钮扣电池
正极:Ag2O
Ag2O+2e-+H2O=2Ag+2OH-
负极:Zn
Zn -2e-+2OH- =Zn(OH)2
总反应:Zn+Ag2O+ H2O=Zn(OH)2+2Ag
二、二次电池
1、铅蓄电池:
铅蓄电池是以平行排列的铅、铅锑合金栅板为主架,栅格中交替地填充着负极和正极的铅和二氧化铅,电解质为H2SO4溶液。
总反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O
Pb -2e- + SO42- =PbSO4
正极(PbO2):
PbO2 +2e- + 4H++SO42- =PbSO4 +2H2O
负极(Pb):
充电反应是上述过程的逆反应
放电过程:
铅蓄电池的充放电过程:
Pb+PbO2+2H2SO4 2PbSO4+2H2O
→充电时变阴极
→充电时变阳极
问题:反应一段时间后,电解液的PH如何变化?
问题:每转移1mole-时,消耗____mol硫酸。
1
三、燃料电池:
燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。
1、氢氧燃料电池:
?正负两极相同,均为Pt或C,仅起导电作用。
?负极均为燃料反应,正极均为O2反应,总反应是燃料的燃烧反应(不写点燃条件)。
?电解液呈中性:
负极:
正极:
总反应:
2H2 - 4e- = 4H+
O2 + 2H2O + 4e-= 4OH-
2H2 +O2 =2H2O
?电解液呈酸性:
负极:
正极:
不变
O2 + 4H+ + 4e-= 2H2O
?电解液呈碱性:
负极:
正极:
2H2 +4OH-- 4e- = 4H2O
不变
1、氢氧燃料电池:
练习2:航天技术上使用的氢氧燃料电池具有高
能、轻便、无污染的优点。氢氧燃料电池有酸式
和碱式两种,它们放电时的总反应都可以表示为
2H2+O2=2H2O,酸式电池中电解质是酸,其负极反
应可表示为2H2-4e-=4H+ ,则其正极反应式
为 。碱式电池的电解质是碱,
其正极反应式为O2+2H2O+4e-=4OH-,则其负极反应
可表示为 。
O2+4e-+4H+=2H2O
2H2-4e-+4OH-=4H2O
2、甲烷碱性燃料电池:
电解质溶液:KOH
负极:
正极:
2O2 + 4H2O + 8e-= 8OH-
CH4- 8e-+10OH- =CO32- +7H2O
CH4+2O2+2KOH=K2CO3+3H2O
总反应:
1、电池是人类生产和生活中的重要能量来源,各式各样电池的发明是化学对人类的一项重大贡献,下列有关电池的叙述不正确的是( )
A.手机上用的锂离子电池属于二次电池
B.甲醇燃料电池中甲醇参与正极反应
C.碱性锌锰电池中,锌电极是负极
D.太阳能电池的主要材料是高纯度的硅
B
3、氢氧燃料电池是符合绿色化学理念的新型发电装置。关于以KOH为电解质的氢氧燃料电池叙述错误的是( )
A、氢氧燃料电池直接把热能转化为电能
B、电子从负极出发,沿导线流向正极
C、负极反应式为H2+2OH--2e- =2H2O
D、电解质 KOH的物质的量不发生变化
A
2、关于铅蓄电池放电时的说法正确的( )
A.电池的负极材料是铅板
B.正极发生的反应是 Pb +SO42--2e-= PbSO4
C.电池中硫酸的浓度不发生变化
D.负极质量减少、正极质量增加
A
减 少 污 染
节 约 资 源
