高一 必修二 第一章 物质结构 元素周期律 第三节 化学键(16张)
文档属性
| 名称 | 高一 必修二 第一章 物质结构 元素周期律 第三节 化学键(16张) |  | |
| 格式 | zip | ||
| 文件大小 | 896.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-02-19 22:47:20 | ||
图片预览





文档简介
温故知新
什么是离子键?什么是离子化合物?
比较下列元素非金属性的强弱
H___Cl H___C C___O
H原子和C l原子能形成离子键吗? C l 原子和C l呢?
带相反电荷离子之间的相互作用(静电作用)称为离子键
含有离子键的化合物称为离子化合物
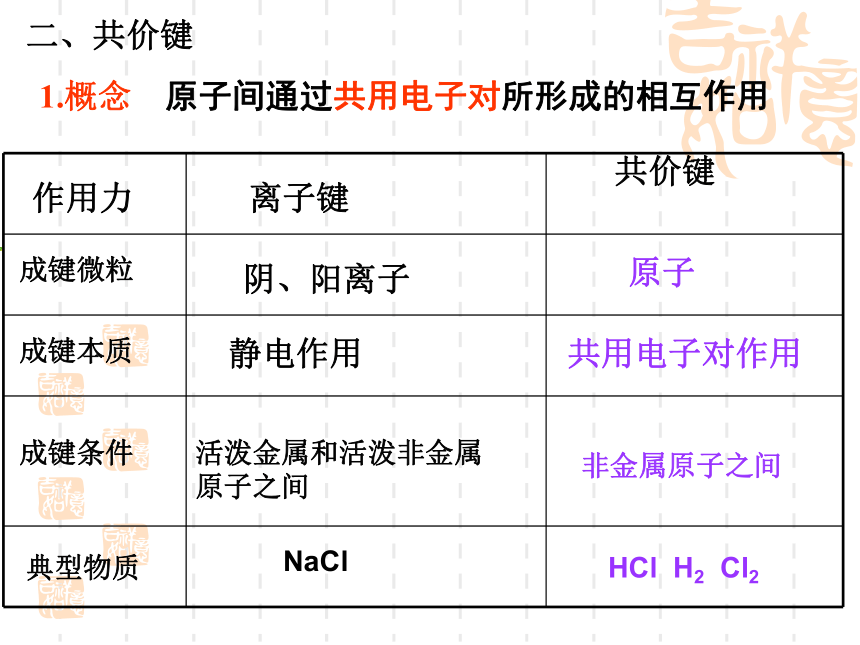
1.概念 原子间通过共用电子对所形成的相互作用
原子
共用电子对作用
非金属原子之间
HCl H2 Cl2
二、共价键
2. 用电子式表示共价键的形成过程
(1)原则:H 原子满足2电子稳定结构,其他原子一般满足8电子稳定结构
(2) 左边写原子的电子式,中间用→连接,右边写 分子的电子式; (3) 不用箭头表示电子的偏移; (4)“ →”左边相同原子可以合并在一起, 右边相同原子不能合并在一起。
【练习1】用电子式表示下列物质的形成过程
① H2O ② CO2 ③ NH3 ④CH4 ⑤N2
2、用电子式表示共价化合物的形成过程
2. HCl
3. H2O
1. H2
5. NH3
4. CO2
双键
叁键
单键
电子对偏向 ?
电子对偏向Cl
电子对不偏移
非极性键
极性键
非极性键: 同种原子形成的共价键,共用电子对不偏移,成键原子不显电性。
极性键: 不同种元素原子形成的共价键共用电子对发生偏移,成键原子显电性。
3.共价键的分类
4. 共价化合物:
只含有共价键的化合物叫做共价化合物
① ② ④ ⑥
③
① ② ③ ⑤ ⑥
② ⑤
正
误
误
误
⑤稀有气体分子中含有非极性键 ( )
误
小结
作用力
离子键
共价键
成键微粒
成键本质
阴、阳离子
静电作用
原子
共用电子对作用
成键条件
典型物质
活泼金属和活泼非金属原子之间
非金属原子之间
NaCl、CaO等
Cl2 、HCl、NaOH等
键的存在
只存于离子化合物
存于非金属单质、共价化合物、也可能存在离子化合物
化学键
5.化学键
化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程,所以化学反应中反应物一定有化学键被破坏
使离子相结合或原子相结合的作用。
【练习4】判断下列过程破坏或形成了哪种类型的化学键?
1.NaCl溶于水_______________________
2.熔融NaCl_________________________
3.蒸发结晶精制食盐水_______________
4.HCl溶于水_______________________
5.NH4Cl NH3+HCl_________________
破坏离子键
破坏离子键
形成离子键
破坏共价键
破坏离子键、共价键;形成共价键
什么是离子键?什么是离子化合物?
比较下列元素非金属性的强弱
H___Cl H___C C___O
H原子和C l原子能形成离子键吗? C l 原子和C l呢?
带相反电荷离子之间的相互作用(静电作用)称为离子键
含有离子键的化合物称为离子化合物
1.概念 原子间通过共用电子对所形成的相互作用
原子
共用电子对作用
非金属原子之间
HCl H2 Cl2
二、共价键
2. 用电子式表示共价键的形成过程
(1)原则:H 原子满足2电子稳定结构,其他原子一般满足8电子稳定结构
(2) 左边写原子的电子式,中间用→连接,右边写 分子的电子式; (3) 不用箭头表示电子的偏移; (4)“ →”左边相同原子可以合并在一起, 右边相同原子不能合并在一起。
【练习1】用电子式表示下列物质的形成过程
① H2O ② CO2 ③ NH3 ④CH4 ⑤N2
2、用电子式表示共价化合物的形成过程
2. HCl
3. H2O
1. H2
5. NH3
4. CO2
双键
叁键
单键
电子对偏向 ?
电子对偏向Cl
电子对不偏移
非极性键
极性键
非极性键: 同种原子形成的共价键,共用电子对不偏移,成键原子不显电性。
极性键: 不同种元素原子形成的共价键共用电子对发生偏移,成键原子显电性。
3.共价键的分类
4. 共价化合物:
只含有共价键的化合物叫做共价化合物
① ② ④ ⑥
③
① ② ③ ⑤ ⑥
② ⑤
正
误
误
误
⑤稀有气体分子中含有非极性键 ( )
误
小结
作用力
离子键
共价键
成键微粒
成键本质
阴、阳离子
静电作用
原子
共用电子对作用
成键条件
典型物质
活泼金属和活泼非金属原子之间
非金属原子之间
NaCl、CaO等
Cl2 、HCl、NaOH等
键的存在
只存于离子化合物
存于非金属单质、共价化合物、也可能存在离子化合物
化学键
5.化学键
化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程,所以化学反应中反应物一定有化学键被破坏
使离子相结合或原子相结合的作用。
【练习4】判断下列过程破坏或形成了哪种类型的化学键?
1.NaCl溶于水_______________________
2.熔融NaCl_________________________
3.蒸发结晶精制食盐水_______________
4.HCl溶于水_______________________
5.NH4Cl NH3+HCl_________________
破坏离子键
破坏离子键
形成离子键
破坏共价键
破坏离子键、共价键;形成共价键
