人教版九年级化学下册第八单元 课题2金属的化学性质复习学案(无答案)
文档属性
| 名称 | 人教版九年级化学下册第八单元 课题2金属的化学性质复习学案(无答案) | 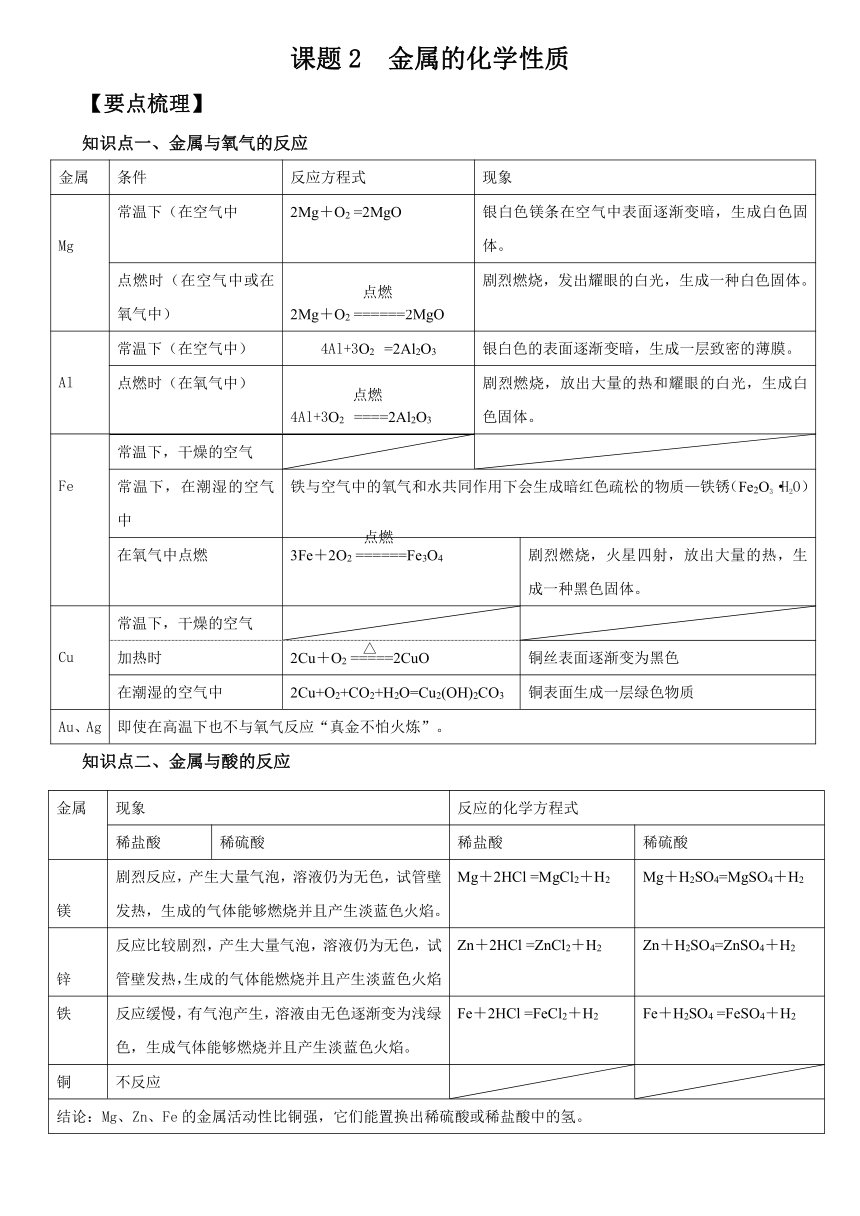 | |
| 格式 | zip | ||
| 文件大小 | 250.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-02-19 09:52:41 | ||
图片预览



文档简介
课题2 金属的化学性质
【要点梳理】
知识点一、金属与氧气的反应
金属 条件 反应方程式 现象
Mg 常温下(在空气中 2Mg+O2 =2MgO 银白色镁条在空气中表面逐渐变暗,生成白色固体。
点燃时(在空气中或在氧气中) 2Mg+O2 ======2MgO 剧烈燃烧,发出耀眼的白光,生成一种白色固体。
Al 常温下(在空气中) 4Al+3O2 =2Al2O3 银白色的表面逐渐变暗,生成一层致密的薄膜。
点燃时(在氧气中) 4Al+3O2 ====2Al2O3 剧烈燃烧,放出大量的热和耀眼的白光,生成白色固体。
Fe 常温下,干燥的空气
常温下,在潮湿的空气中 铁与空气中的氧气和水共同作用下会生成暗红色疏松的物质—铁锈(Fe2O3·H2O)
在氧气中点燃 3Fe+2O2 ======Fe3O4 剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体。
Cu 常温下,干燥的空气
加热时 2Cu+O2 =====2CuO 铜丝表面逐渐变为黑色
在潮湿的空气中 2Cu+O2+CO2+H2O=Cu2(OH)2CO3 铜表面生成一层绿色物质
Au、Ag 即使在高温下也不与氧气反应“真金不怕火炼”。
知识点二、金属与酸的反应
金属 现象 反应的化学方程式
稀盐酸 稀硫酸 稀盐酸 稀硫酸
镁 剧烈反应,产生大量气泡,溶液仍为无色,试管壁发热,生成的气体能够燃烧并且产生淡蓝色火焰。 Mg+2HCl =MgCl2+H2 Mg+H2SO4=MgSO4+H2
锌 反应比较剧烈,产生大量气泡,溶液仍为无色,试管壁发热,生成的气体能燃烧并且产生淡蓝色火焰 Zn+2HCl =ZnCl2+H2 Zn+H2SO4=ZnSO4+H2
铁 反应缓慢,有气泡产生,溶液由无色逐渐变为浅绿色,生成气体能够燃烧并且产生淡蓝色火焰。 Fe+2HCl =FeCl2+H2 Fe+H2SO4 =FeSO4+H2
铜 不反应
结论:Mg、Zn、Fe的金属活动性比铜强,它们能置换出稀硫酸或稀盐酸中的氢。
知识点三、置换反应
置换反应:由一种单质与一种化合物反应,生成另一种单质与化合物的反应叫做置换反应。
如:Mg+2HCl =MgCl2+H2 Fe+2HCl =FeCl2+H2 Fe+CuSO4= Cu+FeSO4
知识点四、金属活动性顺序
人们通过大量的实验验证得到常见金属的活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
金属活动性:由强到弱
1. 在金属活动性顺序里,金属的位置越靠前,它的活动性越强。
2. 在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
3. 在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来(K、Ca、Na除外)。
实验操作 现象 反应的化学方程式
铁丝浸入硫酸铜溶液中 浸入溶液的铁钉表面覆盖一层紫红色的物质,溶液由蓝色逐渐变为浅绿色 Fe+CuSO4= Cu+FeSO4
【典型例题】
1、铝在一百多年里产量得到大幅度的提高,并被广泛地使用,原因之一就是铝的抗腐蚀性能好。铝具有良好抗腐蚀性能的原因是 ( )
A.铝的化学性质不活泼 B.铝不与酸、碱反应
C.铝常温下不与氧气反应 D.铝表面生成一层致密的氧化铝保护膜
2、将金属锰(Mn)投入稀盐酸中,有气泡产生。将镁条插入硫酸锰溶液中,如果有锰析出,则Mn、Mg、Cu的金属活泼性由强到弱的顺序是 ( )
A.Mn、Mg、Cu B.Mg、Mn、Cu C.Cu、Mg、Mn D.Cu、Mn、Mg
3、将一小块Na投入足量的CuSO4溶液中,现象是( )
A、置换出金属铜 B、产生气体,置换出金属铜
C、生成蓝色沉淀 D、产生气体,生成蓝色沉淀
举一反三:
1、有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放人硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上实验事实,判断这三种金属的活动性由强到弱的顺序为( )
A.Z、Y、X B.X、Y、Z C.Y、X、Z D.X、Z、Y
2、下列四个实验中只需要完成三个就可以证明Fe、Cu、Ag三种金属的活动性顺序。其中不必进行的是( )
A.将铁片放入稀盐酸 B.将铜片放入稀盐酸
C.将铁片放入硝酸银溶液 D.将铜片放入硝酸银溶液
3、铁片放入硫酸铜溶液中,观察到现象是( )
A.有气泡生成 B.铁片表面镀上一层红色的铜
C.溶液颜色由无色变为蓝色 D.溶液颜色由蓝色变为浅绿色
【典型例题】
1、往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。根据上述现象,你能得出的结论是 ( )
A.滤渣中一定有Fe粉 B.滤渣中一定有Cu粉
C.滤液中一定有Fe2+ D.滤液中一定有Ag+、Cu 2+
2、相同质量的M、N两种活泼金属,分别与足量质量分数为8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如右图。下列叙述正确的是 (????)
A.金属的活泼性N>M???? B.两个反应生成H2的体积相等
C.相对原子质量N>M???? D.两个反应消耗盐酸的质量一定相等
3、实验室中要除去细碎铜屑中的少量细碎铁屑.某课外活动小组设计了两个方案:
①Cu、Fe搅拌→加入适量稀盐酸过滤→洗涤
②Cu、Fe搅拌→加入适量CuSO4溶液过滤→洗涤
(1)在上述两个方案中,你认为较好的是______________理由______________________________
(2)你是否有更简便的方法,请写出方法_____________________________________
举一反三:
1、等质量的X、Y两种金属分别和足量的同体积、同浓度的盐酸反应,产生气体的质量与时间的关系如图所示.下列说法中不正确的是( )
A、t1时,产生气体的质量:X>Y B.t2时,消耗金属的质量:X>Y
C.t3时,消耗金属的质量:X=Y D.t3时,消耗盐酸的质量:X=Y
2、除去下列物质中的杂质(括号内为杂质),请你写出有关的化学方程式:
Ag(Cu)___________________________________________
FeSO4溶液(CuSO4)________________________________________
【巩固提升】
1、面对纷繁复杂的化学变化,如果我们逐个进行学习和研究,时间上不允许,同时也不便于寻找规律,因此有必要对化学反应进行分类学习。下列反应属于置换反应类型的是( )
A.Zn+H2SO4====ZnSO4+H2↑ B.3Fe+2O2Fe3O4
C.CH4+2O2CO2+2H2O D.2HgO2Hg+O2↑
2、小雨的妈妈买了一条黄金项链,小雨想通过实验探究这条黄金项链是否为锌铜合金制?成的仿制品,她不能选用的试剂是( )
A.A1C13溶液???????????????????? ???????B.Cu(NO3)2溶液?
C.H2SO4溶液??????????????????????????? D.AgNO3溶液
3.下列关于金属的说法正确的是( )
A.各种金属在常温下都不能与氧气反应
B.各种金属在高温下都能与氧气反应
C.根据金属与氧气反应的难易程度可以初步比较金属的活动性
D.各种金属都能与盐酸发生置换反应
4、下列化合物不能由金属与稀硫酸反应直接制得的是( )
A.CuSO4 B.MgCl2 C.FeCl2 D.ZnSO4
5、下列叙述中不正确的是( )
A.氯化亚铁溶液和硫酸亚铁溶液都是浅绿色的
B.氧化铝和氧化铜都是黑色固体
C.硫酸铜溶液是蓝色溶液
D.硫酸铝溶液是无色溶液
6、下列成语或谚语中描述金属的化学性质的是( )
A.斩钉截铁 B.铁杵磨针
C.铁石心肠 D.真金不怕火炼
7、下列物质放入足量的稀硫酸中,反应速率最慢的是( )
A.铁片 B.锌片 C.镁片 D.铝片
8、某不纯的铁5.6g与足量的稀硫酸充分反应,生成0.21g氢气,则铁中混有的金属可能是( )
A.Zn B.Cu C.Mg D.Ag
9、现有X、Y、Z三种金属,只有X与稀硫酸反应产生氢气,Y、Z则不能,但二者有下列关系:Y + Z(NO3)2 == Z + Y(NO3)2,则X、Y、Z三种金属活动性顺序由强到弱的是( )
A.Z、Y、X B.X、Z、Y C.X、Y、Z D.Z、X、Y
10、某化学兴趣小组,为验证Ag、Fe、Cu三种金属的活动性顺序,设计了如图所示的实验操作,其中可以达到实验目的组合是( )
A.①③ B.②④ C.④⑤ D.②③
11、为了探究影响锌与盐酸反应剧烈程度的因素,某学习小组设计了下列实验,其中,说法正确的是( )
A.对比实验①和②,可研究盐酸的浓度对反应剧烈程度的影响
B.对比实验②和③,可研究盐酸的浓度对反应剧烈程度的影响
C.对比实验②和③,可研究温度对反应剧烈程度的影响
D.对比实验①和②,可研究温度对反应剧烈程度的影响
12、等质量的甲、乙、丙三种金属的粉末,与足量的稀硫酸反应(反应后甲、乙、丙三种金属都显+2价),生成H2的质量与反应时间的关系如图所示,下列说法错误的是( )
A、三种金属的活泼性:乙>甲>丙
B、生成氢气的质量:甲>乙>丙
C、相对原子质量:甲>乙>丙
D、消耗硫酸的质量:甲>乙>丙
13、向CuSO4溶液中加入一定质量的铝粉,完全反应后过滤,得滤渣和蓝色滤液.下列说法正确的是( )
A.向滤渣中滴加稀盐酸,无气泡产生
B.滤渣中一定有Cu,可能有Al
C.滤液中只有Al2(SO4)3
D.滤液中只有CuSO4
二、填空题
1、写出下列变化的化学反应方程式。
(1)用砂纸打磨过的铝片放置在空气中:__________________________________________。
(2)铁钉在稀硫酸溶液中:_____________________________________________________。
(3)工人师傅在切割钢板时常用硫酸铜划线是因为
2、镁、铁在日常生活中有较为广泛的用途。如:
(1)镁在空气中燃烧时,发出耀眼的白光,可用来制造镁闪光灯,其反应化学方程式为: 。
(2)市场上出售的补血麦片中常含有微量颗粒细小的还原性铁粉,铁粉与人体胃液中的盐酸反应转
化成氯化亚铁,起到补血作用,写出这个反应方程式: 。
3、材料:我国第四套人民币中的一元硬币是钢芯镀镍(Ni),镍与稀硫酸能发生下列反应:
Ni?+?H2SO4?===?NiSO4?+?H2↑。
根据此材料及金属活动性顺序,请回答:
(1)铸造硬币用到的材料是_______________(填“合成材料”或“金属材料”);
(2)写出Ni与CuSO4溶液发生置换反应的方程式____________________________?。
三、实验题
1、钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注。某化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究。
提出假设:a. Ti的金属活动性比Mg强; b. Ti的金属活动性介于Mg和Ag之间。
查阅资料:在相同条件下,金属与酸反应,产生气泡的速度越快,则该金属活动性越强。
实验设计:同温下,取大小相同的这三种金属薄片,分别投入等体积、等质量分数的足量稀盐酸中,观察现象。
请回答:(1) 三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是 (填序号)
①除去氧化膜,利于直接反应② 使反应的金属温度相同, ③使表面光亮,易观察现象
(2)根据下表中的实验现象填空:
Ti Mg Ag
实验现象 产生气泡速度缓慢 产生气泡速度快 无任何现象
结论:原假设中 不正确(填“a”或“b”或“ab”),理由是
;三种金属的活动性由强到弱的顺序为 。
(3)上述实验设计中,如果所用盐酸的溶质质量分数不同,是否一定能够得出正确的结论?
(填“是”或“否”),理由是 。
2、某化学兴趣小组的同学在探究Mg、Cu、Fe三种金属的有关性质时进行了如下实验:
(1)实验一:发生反应的化学方程式___________________,该实验可得出三种金属的活动性由强到弱的顺序为_________________________________.
(2)实验二:将实验一后①、②试管内的物质倒入烧杯中,发现烧杯内的红色固体明显增多,一段时间后过滤.滤渣中一定含有的物质是______________可能有的物质是_______________,为了进一步确定可能有的物质是否存在,同学们设计了如下方案:
实验步骤 实验现象 结论
取少量滤渣于试管中,向其中滴加 ________________ 没有气泡产生 __________________ ______________
滤液中含有的金属离子可能是_______________
①Mg2+;? ②Mg2+、Fe2+;?③Mg2+、Fe3+;??④Cu2+、Fe2+;??⑤Mg2+、Fe2+、Cu2+
四、计算
黄铜是铜、锌合金,它用于制造机器、电器零件等.为测定某黄铜样品中铜的质量分数,取10g该黄铜样品,将40g 9.6%的稀硫酸分四次加入,实验结果如下表:
9.6%的硫酸/g 10g 10g 10g 10g
生成的氢气/g 0.04g 0.04g Xg 0.02g
(1)X的值是___________
(2)该黄铜样品中铜的质量分数.
点燃
点燃
点燃
△
PAGE
同课章节目录
