人教版高中化学必修二第二章《 化学反应与能量》单元测试题(解析版)
文档属性
| 名称 | 人教版高中化学必修二第二章《 化学反应与能量》单元测试题(解析版) |

|
|
| 格式 | zip | ||
| 文件大小 | 281.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-02-20 00:00:00 | ||
图片预览




文档简介
第二章《 化学反应与能量》单元测试题
一、单选题(每小题只有一个正确答案)
1.把A、B、C、D四块金属泡在稀H2SO4中,用导线两例相连可以组成各种原电池。若A、B相连时,A为负极;C、D相连,D上有气泡逸出;A、C相连时A极减轻;B、D相连,B为正极.则四种金属的活泼性顺序由大到小排列为( )
A.A>B>C>D B.A>C>D>B C.A>C>B>D D.B>D>C>A
2.下列描述的化学反应状态,不一定是平衡状态的是( )
A.H2(g)+Br2(g) 2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
B.2NO2(g) N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
C.3H2(g)+N2(g) 2NH3(g),反应体系中H2与N2的物质的量之比保持3∶1
D.CaCO3(s)CO2(g)+CaO(s)恒温、恒容下,反应体系中气体的密度保持不变
3.在密闭容器中充入4 mol SO2和3 mol O2,一定条件下建立如下平衡:2SO2(g)+O2(g)2SO3(g) ΔH=-Q kJ/mol,测得SO2的转化率为90%,则在此条件下反应放出的热量为( )
A.2Q kJ B.Q kJ C.1.8Q kJ D.0.9Q kJ
4.将小块生石灰投入盛有水的试管中,发生剧烈反应。一段时间后,用手触摸试管外壁感觉烫手,这个实验事实说明该反应( )
A.是放热反应 B.是吸热反应
C.反应过程中热能转化为化学能 D.反应物的总能量等于生成物的总能量
5.在体积恒定的密闭容器中,一定量的SO2与1.100molO2在催化剂作用下加热到600℃发生反应:2SO2+ O22SO3,ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B.降低温度,正反应速率减小程度比逆反应速率减小程度大
C.将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980g
D.达到平衡时,SO2的转化率为90%
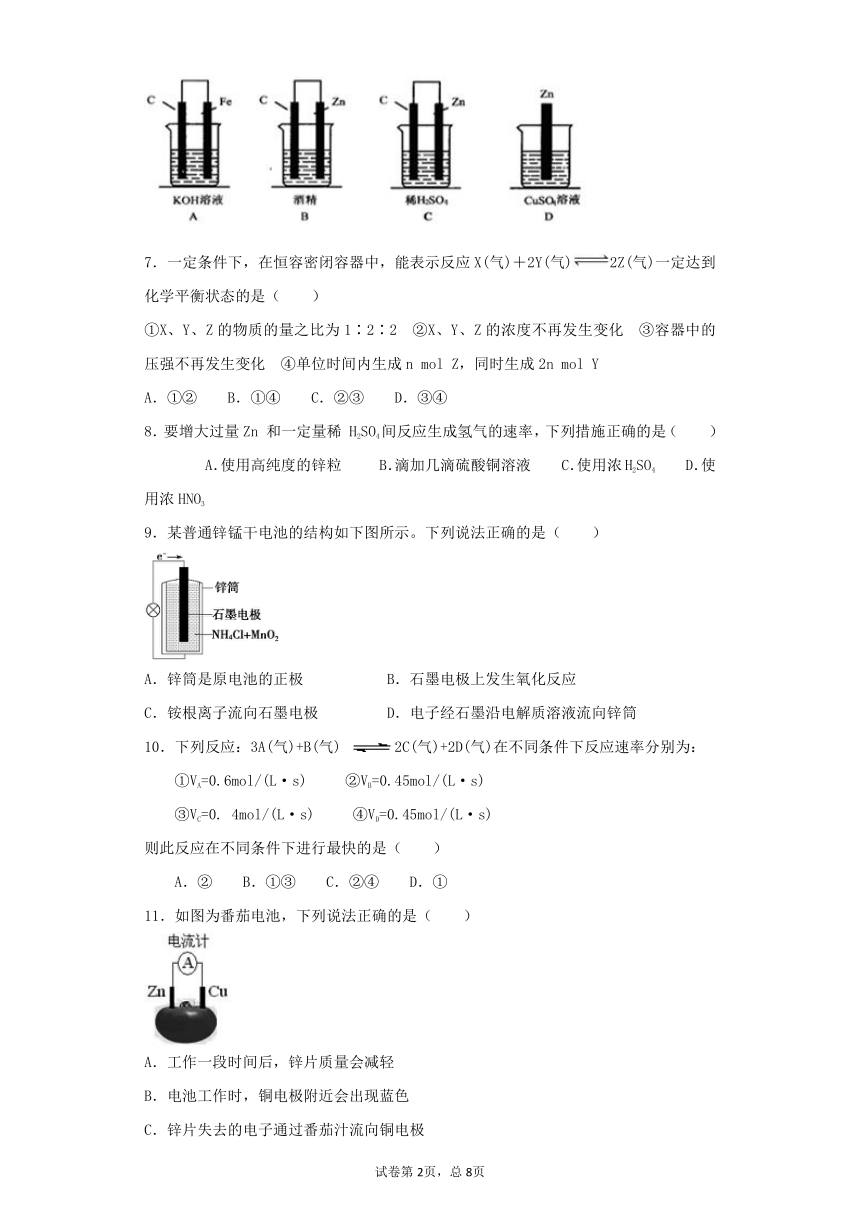
6.如下图,下列装置能产生有效电流的是( )
7.一定条件下,在恒容密闭容器中,能表示反应X(气)+2Y(气)2Z(气)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④ C.②③ D.③④
8.要增大过量Zn 和一定量稀 H2SO4间反应生成氢气的速率,下列措施正确的是( ) A.使用高纯度的锌粒 B.滴加几滴硫酸铜溶液 C.使用浓H2SO4 D.使用浓HNO3
9.某普通锌锰干电池的结构如下图所示。下列说法正确的是( )
A.锌筒是原电池的正极 B.石墨电极上发生氧化反应
C.铵根离子流向石墨电极 D.电子经石墨沿电解质溶液流向锌筒
10.下列反应:3A(气)+B(气) 2C(气)+2D(气)在不同条件下反应速率分别为:
①VA=0.6mol/(L·s) ②VB=0.45mol/(L·s)
③VC=0. 4mol/(L·s) ④VD=0.45mol/(L·s)
则此反应在不同条件下进行最快的是( )
A.② B.①③ C.②④ D.①
11.如图为番茄电池,下列说法正确的是( )
A.工作一段时间后,锌片质量会减轻
B.电池工作时,铜电极附近会出现蓝色
C.锌片失去的电子通过番茄汁流向铜电极
D.铜电极发生还原反应
12.对于放热反应:H2+Cl22HCl,下列说法中正确的是( )
A.反应物所具有的总能量高于产物所具有的总能量
B.产物所具有的总能量高于反应物所具有的总能量
C.断开1 mol H—H键和1 mol C1—C1键所吸收的总能量大于形成2 mol H—C1键所放出能量
D.该反应中,化学能只转变为热能
13.对于可逆反应A(g) +3B(g)2C(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A.v(A)=0.5 mol/(L·min) B.v(B)=1.2 mol/(L·min)
C.v(C)=0.4 mol/(L·min ) D.v(C)=1.1 mol/(L·min)
14.工业制备氮化硅的反应为:3SiCl4(g)+2N2(g)+6H2(g)Si3N4(s)+12HCl(g) ΔH<0,将0.3 molSiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:
时间/min 质量/g 温 度/℃ 0 1 2 3 4 5 6
250 0.00 1.52 2.80 3.71 4.73 5.60 5.60
300 0.00 2.13 3.45 4.48 4.48 4.48 4.48
下列说法正确的是( )
A.250℃,前 2min, Si3N4 的平均反应速率为 0.02 mol·L-1·min-1
B.反应达到平衡时, 两种温度下 N2 和 H2 的转化率之比相同
C.达到平衡前, 300℃条件的反应速率比 250℃快; 平衡后, 300℃比 250℃慢
D.反应达到平衡时, 两种条件下反应放出的热量一样多
15.现代火法炼锌过程中发生了以下三个主要反应。下列说法正确的是( )
① 2ZnS(s) + 3O2(g)=2ZnO(s)+2SO2(g) △H1=a kJ ? mol-1
② 2C(s) +O2(g)=2CO(g) △H2=b kJ ? mol-1
③ ZnO(s) +CO(g)=Zn(g) +CO2(g) △H3=c kJ ? mol-1
A.以上三个反应中,只有①是放热反应
B.反应②的作用是仅为反应③提供还原剂
C.用这种方法得到的是纯净的锌单质
D.反应ZnS(s)+C(s)+2O2(g)=Zn(g)+SO2(g)+CO2(g)的△H= kJ ? mol-1
二、填空题
16.下图为一个原电池,完成下列问题:
(1)负极材料________,正极材料________,电解质溶液是________。
(2)写出电极反应式:负极:__________________________;
正极:___________________________。
17.合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)CH3OH(g) △H =-181.6kJ·mol-1。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
物质
H2
CO
CH3OH
浓度/(mol·L-1)
0.2
0.1
0.4
⑴比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)。
⑵若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH) = mol·(L·min)-1。
⑶生产过程中,合成气要进行循环,其目的是 。
18.50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎泡沫塑料的作用是________________。
(3)大烧杯上如不盖硬纸板,求得的中和反应的反应热的数值________(填“偏大”“偏小”或“无影响”)。
(4)实验中改用55 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应的反应热会________(填“偏大”“偏小”或“无影响”)
三、实验题
19.某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) 1 2 3 4 5
氢气体积(mL) 50 120 232 290 310
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大___________,原因是___________________________________________________。
(2)哪一时间段的反应速率最小___________,原因是_____________________。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变) ___________。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:A.蒸馏水、B.NaCl溶液、C.NaNO3溶液、D.CuSO4溶液、E.Na2CO3溶液,你认为可行的是___________。
(5)把锌与盐酸的反应设计成原电池,请画出装置示意图,标明正负极,电子流动方向,写出正极的电极反应式________________________。
20.某学习小组在通过反应Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O研究反应速率的影响因素后,对Na2S2O3产生了兴趣,查资料知Na2S2O3名称为硫代硫酸钠,俗称海波,可以看成是用一个S原子取代了Na2SO4中的一个O原子而形成。该实验小组运用类比学习的思想预测了Na2S2O3的某些性质,并通过实验探究验证自己的预测。
[提出假设]
(1)部分学生认为Na2S2O3与Na2SO4结构相似,化学性质也相似,因此室温时Na2S2O3溶液的pH 7(填“>”、“=”或“<”)
(2)部分学生从S元素化合价推测Na2S2O3与SO2性质相似,均具有较强的 。
[实验探究]
取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究(填写下表中空格)。
[实验结论]
(6)探究①: 。
(7)探究②: 。
[问题讨论]
(8)甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由
。
(9)请你重新设计一个实验方案,证明Na2S2O3被氯水氧化。你的方案是
。
四、推断题
21.A、B、C、D均为中学化学中常见的物质,它们之间的转化关系如下图(部分产物已略去):
试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为 (填元素符号)
(2)若D是金属,C溶液在储存时应加入少量D,其理由是(用必要的文字和离子方程式表示) ;D在潮湿的空气中易发生吸氧腐蚀,写出腐蚀时原电池正极的电极反应式 。
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子方程式 。
22.部分中学化学常见元素的原子结构及性质如下表所示:
元素 结构及性质
A A 单质是生活中的常见金属,它有两种氯化物,相对分子质量相差 35.5
B B 原子最外层电子数是内层电子总数的 1/5
C C 是常见化肥的主要元素,单质常温下呈气态
D D 是地壳中含量最丰富的金属元素,工业上可通过电解法获取其单质
E 通常情况下,E 没有最高正价,A、B、C、D、F 都能与 E 形成化合物
F F 在周期表中可以排在 IA 族,也有人提出可以排在 VIIA 族
(1)E 元素在周期表中的位置为_____。
(2)B 与 C 形成的化合物的化学式为_____,它属于_____(填“离子”或“共价”)化合物。
(3)C 与 E 都是较活泼的非金属元素,两者的非金属性较强的是:_____(用化学符号回答), 请写出一个可以判断二者非金属性强弱的化学方程式__________________ 。
(4)B~F 各元素原子半径由小到大的顺序是___________________________(用元素符号表示)。
(5)有人认为 B、D 的单质用导线连接后插入 NaOH 溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式_________
五、计算题
23.根据所学知识填空:
(1)已知某反应的各物质浓度数据如下:
aA(g) + bB(g) 2C(g)
起始浓度(mol·L-1): 1.5 1.0 0
2 s末浓度(mol·L-1): 0.9 0.8 0.4
则①a= ,b= ;
②2 s内用B表示该反应的反应速率为 。
(2)由碳棒、铁片和200 mL 1.5 mol·L-1的稀硫酸组成的原电池中,当在碳棒上产生气体3.36 L(标准状况)时,求:①有 个电子通过了电线?(NA=6.02×1023)
②此时溶液中H+的物质的量浓度为 (不考虑溶液体积变化)。
24.已知分解100 g CaCO3需要177.7 kJ的热量,而12 g碳完全燃烧,则放出393 kJ的热。求:
(1)煅烧1 t石灰石需要多少热量?
(2)这些热量全部由碳燃烧提供,问理论上要消耗多少克碳?
试卷第6页,总8页
参考答案
1.B
【解析】
试题分析:把A、B、C、D四块金属泡在稀H2SO4中,用导线两例相连可以组成各种原电池。若A、B相连时,A为负极说明金属活动性A>B;C、D相连,D上有气泡逸出,则C为负极,D为正极,金属活动性C>D;A、C相连时A极减轻,则金属活动性A>C;B、D相连,B为正极,则金属活动性D>B,所以四种金属的活泼性顺序由大到小排列为A>C>D>B,选项B正确。
考点:考查金属活动性大小比较的知识。
2.C
【解析】
【分析】
化学平衡状态到达的标志的分析,要抓两条件线索:一是正反应速率=逆反应速率;二是“变量”不变。由此分析。
【详解】
A.气体颜色的深浅决定于该气体的浓度大小,H2(g)+Br2(g) 2HBr(g)反应体系中Br2蒸气呈红棕色,在反应过程中Br2的浓度一直在变化,当气体颜色保持不变,说明Br2浓度保持不变,所以当Br2的浓度不变(即气体颜色不变)时表明反应到达平衡状态,A项错误;
B.根据阿伏加德罗定律的推论知:恒温、恒容下,任何气体的压强与气体分子数成正比。而反应2NO2(g) N2O4(g)中反应前后分子数目不相同,所以反应过程中反应体系的分子数目一直在变化,压强也就一直在变化,所以当反应体系中气体的压强保持不变时即到达平衡状态,B项错误;
C.根据化学计量数可知,当H2与N2初始物质的量之比为3:1时,那么反应过程中H2与N2的物质的量之比一直是3:1,所以反应体系中H2与N2的物质的量之比保持3∶1,不一定是平衡状态,C项正确;
D.根据密度公式看,因为容积不变,所以气体密度与气体质量成正比。反应体系中只有CO2是气体,CO2在反应过程中质量一直在变化,反应体系中气体的密度也一直在变化,所以当气体密度保持不变时即到达平衡状态,D项错误;答案选C。
【点睛】
注意:若反应向正反应方向进行,任一时刻某反应物的量=初始量-消耗量,某生成物的量=初始量+生成量。
3.C
【解析】
试题分析:设反应放出的热量为x,
由2SO2(g)+O2(g)?2SO3(g)△H=-Q KJ/mol
2 QkJ
4mol×90% x
2/ (4mol×90%)=QkJ/x
解得x=1.8QkJ, 故选C
考点:化学平衡的有关计算
4.A
【解析】一段时间后,用手触摸试管外壁感觉烫手,说明反应为放热反应,则反应物的总能量高于生成物的总能量,将化学能转化为热能,答案选A。
5.D
【解析】
A、生成SO3和消耗SO2,反应都是向正反应方向进行,因此不能说明反应达到平衡,故A错误;B、此反应是放热反应,降低温度,平衡向正反应方向移动,正反应速率减小程度比逆反应速率减小程度小,故B错误;C、2SO2+O22SO3 △n
2 1 2 1
2×0.315 0.315 气体通入到足量的BaCl2溶液中,发生SO3+H2O+BaCl2=BaSO4↓+2HCl,n(SO3)=n(BaSO4)=2×0.315mol=0.63mol,质量为0.63×233g=146.79g,故C错误;
D、 2SO2+O22SO3 △n
起始: a 1.1 0
变化: 0.63 0.315 0.63
平衡:a-0.63 0.785 0.63 相同条件下,达到平衡,气体压强是反应前的82.5%,即为(a+1.1)/(a+0.785)=1/0.825,解得a=0.7mol,即SO2的转化率为0.63/0.7×100%=90%,故D正确。
点睛:用不同物质的反应速率表示反应达到平衡,要求反应的方向是一正一逆,且反应速率之比等于化学计量数之比,生成SO3和消耗SO2,反应都向正反应方向进行,因此不能作为达到平衡的标志。
6.C
【解析】
试题分析:A.不能自发进行氧化还原反应,不具备原电池构成条件,错误。B.没有电解质溶液,不能构成原电池,错误。C.具备原电池构成条件,可以形成原电池,正确。D. 缺少电极,错误。
考点:考查原电池的构成条件的判断的知识。
7.C
【解析】
在一定条件下,当可逆反应的正反应速率和逆反应速率相等时,反应混合物中各种物质的浓度或含量不再变化的状态,称为化学平衡状态。平衡时各种物质的浓度不再变化,但物质的浓度不一定相等,①不正确,②正确。由于反应前后气体体积是变化的,所以压强在反应过程中是变化的,因此如果压强不再变化,可以说明反应已达到平衡状态。④中反应速率的方向相反,但不满足速率之比是相应的化学计量数之比,不能说明。答案选C。
8.B
【解析】
试题分析:A.使用高纯度的锌粒,反应速率减慢,错误;B.滴加几滴硫酸铜溶液,硫酸铜与锌发生置换反应,产生的Cu与Zn及硫酸形成了原电池,从而加快了化学反应速率,正确;C.使用浓H2SO4在溶液中主要以分子的形式存在,离子的浓度减小,反应速率减慢,错误;D.使用浓HNO3有强氧化性,与金属发生反应,一般不能产生氢气,错误。
考点:考查化学反应速率的知识。
9.C
【解析】分析:锌锰干电池中,锌作负极,锌失电子发生氧化反应,碳作正极,二氧化锰在正极上得电子发生还原反应,氯化铵是电解质,据此分析。
详解:A.锌锰干电池中,锌筒作负极,石墨作正极,选项A错误;B.锌锰干电池中,锌筒作负极,石墨作正极,正极上二氧化锰得电子发生还原反应,选项B错误;C.原电池中阳离子定向移动到正极,故铵根离子流向石墨电极,选项C正确;D.电子经导线由负极锌筒流向正极石墨电极,选项D错误;答案选C。
点睛:本题考查锌锰干电池,明确锌锰干电池的成分及放电原理是解本题关键,难度不大。
10.A
【解析】把不同物质的反应速率转化为一种物质的反应速率,都转化为A 物质的反应速率。
①VA=0.6mol/(L·s) ②VA=1.35mol/(L·s) ③VA=0. 6mol/(L·s) ④VA=0.675mol/(L·s)
故②VA=1.35mol/(L·s)反应速率最快,选A。
11.A
【解析】A.该原电池中,锌作负极,负极上锌失电子生成锌离子进入溶液,所以锌片的质量会变小,故A正确;B.铜作正极,正极上氢离子得电子生成氢气,所以铜电极附近不会出现蓝色,故B错误;C.锌作负极,铜作正极,电子从锌沿导线流向铜,电子不会经过电解质,故C错误;D.锌作该原电池的负极,铜作正极,故D错误;故选A。
点睛:明确原电池工作原理,准确判断正负极是解题关键,根据金属的活泼性知,锌作负极,铜作正极,负极上锌失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,电流从正极沿导线流向负极。
12.A
【解析】该反应是放热反应,根据能量守恒定律知,反应物所具有的总能量高于产物所具有的总能量;放热反应的本质是:生成物成键释放的总能量大于反应物断键吸收的总能量,故选A。
13.D
【解析】根据A(g)+3B(g)?2C(g)可知,都用物质C表示反应速率,则分别是:A.v(A)=0.5mol?L-1?min-1,则v(C)=2v(A)=1mol?L-1?min-1;B.v(B)=1.2mol?L-1?min-1,则v(C)=v(A)=0.8mol?L-1?min-1;C.v(C)=0.4mol?L-1?min-1;D.v(C)=1.1mol?L-1?min-1,反应速率最快是D,故选D。
点睛:本题考查反应速率快慢的判断,该题是高考中的常见考点和题型。解题方法是:把不同物质的反应速率换算成同一物质的反应速率进行比较,注意单位是否相同。
14.B
【解析】根据反应3SiCl4(g)+2N2(g)+6H2(g)Si3N4(s)+12HCl(g) ΔH<0,和图表知前2min Si3N4 的
的变化量2.8g/140g.mol-1= 0.02 mol,。 A. 250℃,前 2min, Si3N4 的平均反应速率为 0.005 mol·L-1·min-1故A 错;B.,250℃根据化学反应关系式 N2(g)3H2(g) 反应达到平衡时,两者转化率的比值为1:3,300℃反应达到平衡时N2(g)3H2(g) ,两者转化率的比值为1:3。故B正确; C. 升高温度加快化学反应速率,达到平衡前, 300℃条件的反应速率比 250℃快; 平衡后, 300℃也比 250℃快。故C错;D. 因为3SiCl4(g)+2N2(g)+6H2(g)Si3N4(s)+12HCl(g) ΔH<0,为放热反应,不同温度下达到平衡时,反应的程度不同,放出的热量不一样多。故D错。
点睛:按计量数比例加料时,反应物的转化率之比就等于计量数之比。反应放出的热量和反应物的量有关,参加反应的越多放出或吸收的热量越多。所以ΔH大小与计量数有关。
15.D
【解析】
【详解】
A.燃烧反应为放热反应,则①②为放热反应,故A错误;
B.反应②放热,因此其作用还有为反应③提供能量,故B错误;
C.参与反应的固体有ZnS、ZnO、C和Zn,所以用这种方法不可能得到的纯净的锌单质,故C错误;
D.已知:
① 2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g) △H1=a kJ?mol-1
② 2C(s)+O2(g)=2CO(g) △H2=b kJ?mol-1
③ ZnO(s)+CO(g)=Zn(g)+CO2(g) △H3=c kJ?mol-1
结合盖斯定律可知(①+②)/2+③得方程式ZnS(s)+C(s)+2O2(g)=Zn(g)+SO2(g)+CO2(g),其△H=(a+b+2c)/2 kJ?mol-1,故D正确;
答案选D。
16.(1) 锌片 铜片 稀H2SO4
(2)负极:Zn - 2e? = Zn2+; 正极:2H+ + 2e? = H2↑
【解析】
试题分析:(1)在该原电池中,由于金属活动性:Zn>Cu,所以Zn是负极,Cu是正极,电解质溶液是稀H2SO4。(2)在负极,Zn失去电子,被氧化变为Zn2+,电极反应式是Zn - 2e? = Zn2+;在正极,溶液中的H+得到电子,被还原变为H2,电极反应式是2H+ + 2e? = H2↑。
考点:考查原电池的电极材料、电极反应式的书写的知识。
17.⑴ > ⑵ 0.03 mol·L-1·min-1⑶ 提高原料CO、H2的利用率(或提高产量、产率亦可)。
【解析】
(1)根据物质的浓度可知,此时<160,所以反应向正反应方向进行,即正反应速率大于逆反应速率。
(2)根据(1)可知,起始时氢气的浓度是1.0mol/L,所以在(2)中氢气的浓度变化量是0.6mol/L,则生成甲醇是0.3mol/L,则甲醇的反应速率是0.3mol/L÷10min=0.03 mol·L-1·min-1。
(3)生产过程中,合成气进行循环,可以提高原料CO、H2的利用率。
18.(1)环形玻璃搅拌器
(2)减少实验过程中的热量损失
(3)偏小 (4)不相等 (5)偏小
【解析】(3)大烧杯上如不盖硬纸板,会有热量的散失,则求得的中和热的值偏小。
(4)中和反应放出的热量与参加反应的酸和碱的物质的量有关,物质的量不同,防出的热量不同。
(5)氨水是弱碱,在水溶液中电离时吸收热量,故测得的反应热偏小。
19.(15分)(1)2~3 min (1分) 该反应是放热反应,此时温度高(2分)
(2)4~5 min (1分) 此时H+浓度小(2分)
(3)0.1 mol/(L·min)(2分) A、B(2分)
(4)2H+ + 2e- =H2↑(2分)
【解析】
试题分析:根据影响化学反应速率的因素有浓度、温度以及固体的表面积大小等因素,温度越高、浓度越大、固体表面积越大,反应的速率越大,从表中数据看出2 min~3 min收集的氢气比其他时间段多,原因是Zn置换H2的反应是放热反应,温度升高;4 min~5 min收集的氢气最少是因为随反应进行c(H+)下降;根据v=c/t 计算反应速率;影响氢气的量取决于H+的物质的量。
(1)从表中数据看出2 min~3 min收集的氢气比其他时间段多,虽然反应中c(H+)下降,但主要原因是Zn置换H2的反应是放热反应,温度升高,温度对反应速率影响占主导作用.
(2)4 min~5 min收集的氢气最少,虽然反应中放热,但随着反应的进行c(H+)下降,反应物浓度越低,反应速率减小,浓度对反应速率影响占主导作用。
(3)在2~3min时间段内,n(H2)=0.112L÷22.4L/mol=0.005mol,由2HCl~H2得,消耗盐酸的物质的量为0.01mol,则υ(HCl)==0.1mol/(L?min)。
(4)加入蒸馏水,溶液的浓度减小,反应速率减小,H+的物质的量不变,氢气的量也不变,故A正确;加入氯化钠溶液,降低盐酸的浓度,反应速率减小,H+的物质的量不变,氢气的量也不变,故B正确;加入NaNO3溶液,降低盐酸的浓度,但此时溶液中含有硝酸,与金属反应得不到氢气,故C错误;加入CuSO4溶液,锌能置换出铜,锌、铜、稀盐酸形成原电池,加快了化学反应速率,氢气的量不变,故D错误;加入Na2CO3溶液,Na2CO3能与盐酸反应,盐酸的浓度减小,反应速率减小,H+的物质的量减小,氢气的量也减小,故E错误,答案选A、B。
(5)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。在反应中锌失去电子,则锌是负极。正极可以是石墨或金属性弱于锌的铜等。氢离子在正极得到电子,则电解质是盐酸,其中正极电极反应式是2H+ + 2e- =H2↑,装置图为 (
锌
铜
稀盐酸
→
e
-
)。
考点:考查化学反应速率的影响因素、反应速率的计算以及原电池原理的应用
点评:该题是中等难度的试题,试题基础性强,紧扣教材基础知识,有利于培养学生的学习兴趣和规范答题能力,有助于提高学生的应试能力。该题在答题时需要注意的是反应过程中浓度以及温度的变化,注重基础知识的积累。
20.
【解析】
(1)=
(2)还原性
(3)用玻璃棒蘸取待测液Na2S2O3点在pH试纸上,然后与标准比色卡比较,确定其pH值
(4)S2O32―+H2OHS2O3―+OH―,硫代硫酸钠中有一个硫相当于亚硫酸中的硫,因此其水解产生氢氧根,水溶液呈酸性。
(5)硫代硫酸钠把Cl2还原:S2O32―+4Cl2+5H2O=2SO42―+8Cl―+10H+
(6)硫代硫酸钠水溶液呈碱性。
(7)硫代硫酸钠具有还原性
(8)该方案不合理。因氯水过量,Ag+ 与Cl― 会生成AgCl沉淀。
(9)取反应后的溶液少量,加入氯化钡溶液,再加入盐酸,若产生的沉淀不溶解,则硫代硫酸钠被氧化了;否则没被氧化。
21.(1)Na;(2)加入少量铁,防止Fe2+被氧化为Fe3+;
2Fe3++Fe = 3Fe2+;O2+2H2O+4e— = 4OH—;
(3)Al(OH)3+3H+ = Al3++3H2O或 Al(OH)3+OH—= AlO2—+2H2O
【解析】
试题分析:(1)D是具有氧化性的单质,A元素属于短周期主族金属元素,根据反应关系可知A为Na,B为Na2O,D为O2 ,C为Na2O2;(2)若D是金属.说明金属具有变价,A稀溶液具有氧化性,推断为:HNO3→Fe(NO3)3→Fe(NO3)2,D为Fe,因Fe(NO3)2易被氧化而变质,可加入铁防止被氧化生成硝酸铁,离子方程式为2Fe3++Fe = 3Fe2+,铁在潮湿的空气中易发生吸氧腐蚀,发生腐蚀时原电池正极是氧气获得电子变为OH-,该的电极反应式为O2+2H2O+4e— = 4OH—;(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B.判断为:Al3+→Al(OH)3→AlO2-; B转化为C的所有可能的离子方程式为生成氢氧化铝沉淀,在酸溶解的离子方程式是Al(OH)3+3H+ = Al3++3H2O,或碱中Al(OH)3溶解反应的离子方程式为Al(OH)3+OH—= AlO2—+2H2O。
考点:考查无机物的推断、离子方程式的书写、物质的保存方法等知识。
22.第二周期第ⅥA 族 Mg3N2 离子 O 4NH3+3O2=====2N2+6H2O H【解析】
【分析】
A是生活中的常见金属,它有两种氯化物,相对分子质量之差为35.5,则A为Fe;B原子最外层电子数是内层电子数的1/5,这说明B应该是第三周期元素,则B是Mg元素;C是常见化肥的主要元素,单质常温下呈气态,则C为N元素;D是地壳中含量最丰富的金属元素,工业上可通过电解法获取其单质,则D为Al元素;F在周期表中可以排在ⅠA族,也有人提出排在VⅡA族,则F为H元素;通常情况下,E没有最高正价,A、B、C、D、F 都能与E形成化合物,则E为O元素,据此分析。
【详解】
根据表格中提供的信息,可以推断A为Fe、B为Mg、C为N、D为Al、E为O、F为H。
(1)E为O元素,氧元素位于第二周期第ⅥA族,故答案为:第二周期第ⅥA族。
(2)Mg与N形成的化合物为Mg3N2,属于离子化合物,故答案为:Mg3N2,离子。
(3)C与E分别为N、O元素,N与O位于同一周期,非金属性逐渐增强,非金属性较强的是O,O2的氧化性强于N2,可以通过单质的置换反应验证,反应方程式为:4NH3+3O2=2N2+6H2O,故答案为:O,4NH3+3O2=2N2+6H2O。
(4)B~F分别为Mg、N、Al、O、H,电子层数越多,半径越大,若电子层数相同,核电荷数越大,半径越小,所以B~F各元素原子半径由小到大的顺序是H(5)Mg、Al的单质用导线连接插入NaOH溶液中可以形成原电池,Al作负极,电极反应式为Al+4OH--3e-=AlO2-+2H2O,故答案为:Al+4OH--3e-=AlO2-+2H2O。
【点睛】
非金属性强弱的比较规律:①单质的氧化性:一般情况下,氧化性越强,对应非金属性越强;②单质和酸或者和水的反应程度:反应越剧烈,非金属性越强;③对应氢化物的稳定性:氢化物越稳定,非金属性越强;④和氢气化合的难易程度:化合反应越容易,非金属性越强;⑤最高价氧化物对应水化物的酸性:酸性越强,非金属越强;⑥由对应最低价阴离子的还原性:还原性越强,对应非金属性越弱;⑦置换反应:非金属性强的制非金属性弱的。
23.(每空2分,共10分)
(1)①3 1 ②0.1 mol·(L·s)-1
(2)①1.806×1023 ②1.5 mol·L-1
【解析】
试题分析:(1)①根据所给化学方程式可知,2s末,A的物质的量浓度减小(1.5-0.9)mol/L =0.6mol/L,C的物质的量浓度增加0.4mol/L,B的物质的量浓度减小(1.0-0.8)mol/L=0.2 mol/L,所以a:2=0.6:0.4=3:2,b:2=0.2:0.4=1:2,所以a=3,b=1;
②2 s内用B表示该反应的反应速率为0.2mol/L/2s=0.1 mol·(L·s)-1;
(2)①该原电池的实质是Fe与稀硫酸的反应生成氢气,所以碳棒为正极,产生的气体为氢气,3.36L氢气的物质的量是3.36L/22.4L/mol=0.15mol,所以转移电子数是0.15mol×2×NA=1.806×1023;
②原溶液中氢离子的物质的量是0.2L×1.5mol/L×2=0.6mol,电解产生0.15mol氢气,则氢离子的物质的量减少0.3mol,所以溶液中的氢离子的物质的量浓度是(0.6-0.3)mol/0.2L=1.5 mol·L-1。
考点:考查反应速率的计算、物质的量浓度的计算
24.(1)1.777×106 kJ;(2)5.4×104 g
【解析】(1)分解100g CaCO3需要177.7kJ的热量,煅烧1t石灰石需要热量为177.7kJ× =1.777×106kJ,答:煅烧1t石灰石需要1.777×106kJ热量;
(2)12g碳完全燃烧,则放出393kJ的热,热量全部由碳燃烧提供,问理论上要消耗碳12g×=5.4×104g,答:热量全部由碳燃烧提供,理论上要消耗5.4×104g碳。
一、单选题(每小题只有一个正确答案)
1.把A、B、C、D四块金属泡在稀H2SO4中,用导线两例相连可以组成各种原电池。若A、B相连时,A为负极;C、D相连,D上有气泡逸出;A、C相连时A极减轻;B、D相连,B为正极.则四种金属的活泼性顺序由大到小排列为( )
A.A>B>C>D B.A>C>D>B C.A>C>B>D D.B>D>C>A
2.下列描述的化学反应状态,不一定是平衡状态的是( )
A.H2(g)+Br2(g) 2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
B.2NO2(g) N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
C.3H2(g)+N2(g) 2NH3(g),反应体系中H2与N2的物质的量之比保持3∶1
D.CaCO3(s)CO2(g)+CaO(s)恒温、恒容下,反应体系中气体的密度保持不变
3.在密闭容器中充入4 mol SO2和3 mol O2,一定条件下建立如下平衡:2SO2(g)+O2(g)2SO3(g) ΔH=-Q kJ/mol,测得SO2的转化率为90%,则在此条件下反应放出的热量为( )
A.2Q kJ B.Q kJ C.1.8Q kJ D.0.9Q kJ
4.将小块生石灰投入盛有水的试管中,发生剧烈反应。一段时间后,用手触摸试管外壁感觉烫手,这个实验事实说明该反应( )
A.是放热反应 B.是吸热反应
C.反应过程中热能转化为化学能 D.反应物的总能量等于生成物的总能量
5.在体积恒定的密闭容器中,一定量的SO2与1.100molO2在催化剂作用下加热到600℃发生反应:2SO2+ O22SO3,ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B.降低温度,正反应速率减小程度比逆反应速率减小程度大
C.将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980g
D.达到平衡时,SO2的转化率为90%
6.如下图,下列装置能产生有效电流的是( )
7.一定条件下,在恒容密闭容器中,能表示反应X(气)+2Y(气)2Z(气)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④ C.②③ D.③④
8.要增大过量Zn 和一定量稀 H2SO4间反应生成氢气的速率,下列措施正确的是( ) A.使用高纯度的锌粒 B.滴加几滴硫酸铜溶液 C.使用浓H2SO4 D.使用浓HNO3
9.某普通锌锰干电池的结构如下图所示。下列说法正确的是( )
A.锌筒是原电池的正极 B.石墨电极上发生氧化反应
C.铵根离子流向石墨电极 D.电子经石墨沿电解质溶液流向锌筒
10.下列反应:3A(气)+B(气) 2C(气)+2D(气)在不同条件下反应速率分别为:
①VA=0.6mol/(L·s) ②VB=0.45mol/(L·s)
③VC=0. 4mol/(L·s) ④VD=0.45mol/(L·s)
则此反应在不同条件下进行最快的是( )
A.② B.①③ C.②④ D.①
11.如图为番茄电池,下列说法正确的是( )
A.工作一段时间后,锌片质量会减轻
B.电池工作时,铜电极附近会出现蓝色
C.锌片失去的电子通过番茄汁流向铜电极
D.铜电极发生还原反应
12.对于放热反应:H2+Cl22HCl,下列说法中正确的是( )
A.反应物所具有的总能量高于产物所具有的总能量
B.产物所具有的总能量高于反应物所具有的总能量
C.断开1 mol H—H键和1 mol C1—C1键所吸收的总能量大于形成2 mol H—C1键所放出能量
D.该反应中,化学能只转变为热能
13.对于可逆反应A(g) +3B(g)2C(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A.v(A)=0.5 mol/(L·min) B.v(B)=1.2 mol/(L·min)
C.v(C)=0.4 mol/(L·min ) D.v(C)=1.1 mol/(L·min)
14.工业制备氮化硅的反应为:3SiCl4(g)+2N2(g)+6H2(g)Si3N4(s)+12HCl(g) ΔH<0,将0.3 molSiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:
时间/min 质量/g 温 度/℃ 0 1 2 3 4 5 6
250 0.00 1.52 2.80 3.71 4.73 5.60 5.60
300 0.00 2.13 3.45 4.48 4.48 4.48 4.48
下列说法正确的是( )
A.250℃,前 2min, Si3N4 的平均反应速率为 0.02 mol·L-1·min-1
B.反应达到平衡时, 两种温度下 N2 和 H2 的转化率之比相同
C.达到平衡前, 300℃条件的反应速率比 250℃快; 平衡后, 300℃比 250℃慢
D.反应达到平衡时, 两种条件下反应放出的热量一样多
15.现代火法炼锌过程中发生了以下三个主要反应。下列说法正确的是( )
① 2ZnS(s) + 3O2(g)=2ZnO(s)+2SO2(g) △H1=a kJ ? mol-1
② 2C(s) +O2(g)=2CO(g) △H2=b kJ ? mol-1
③ ZnO(s) +CO(g)=Zn(g) +CO2(g) △H3=c kJ ? mol-1
A.以上三个反应中,只有①是放热反应
B.反应②的作用是仅为反应③提供还原剂
C.用这种方法得到的是纯净的锌单质
D.反应ZnS(s)+C(s)+2O2(g)=Zn(g)+SO2(g)+CO2(g)的△H= kJ ? mol-1
二、填空题
16.下图为一个原电池,完成下列问题:
(1)负极材料________,正极材料________,电解质溶液是________。
(2)写出电极反应式:负极:__________________________;
正极:___________________________。
17.合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)CH3OH(g) △H =-181.6kJ·mol-1。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
物质
H2
CO
CH3OH
浓度/(mol·L-1)
0.2
0.1
0.4
⑴比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)。
⑵若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH) = mol·(L·min)-1。
⑶生产过程中,合成气要进行循环,其目的是 。
18.50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎泡沫塑料的作用是________________。
(3)大烧杯上如不盖硬纸板,求得的中和反应的反应热的数值________(填“偏大”“偏小”或“无影响”)。
(4)实验中改用55 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应的反应热会________(填“偏大”“偏小”或“无影响”)
三、实验题
19.某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) 1 2 3 4 5
氢气体积(mL) 50 120 232 290 310
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大___________,原因是___________________________________________________。
(2)哪一时间段的反应速率最小___________,原因是_____________________。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变) ___________。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:A.蒸馏水、B.NaCl溶液、C.NaNO3溶液、D.CuSO4溶液、E.Na2CO3溶液,你认为可行的是___________。
(5)把锌与盐酸的反应设计成原电池,请画出装置示意图,标明正负极,电子流动方向,写出正极的电极反应式________________________。
20.某学习小组在通过反应Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O研究反应速率的影响因素后,对Na2S2O3产生了兴趣,查资料知Na2S2O3名称为硫代硫酸钠,俗称海波,可以看成是用一个S原子取代了Na2SO4中的一个O原子而形成。该实验小组运用类比学习的思想预测了Na2S2O3的某些性质,并通过实验探究验证自己的预测。
[提出假设]
(1)部分学生认为Na2S2O3与Na2SO4结构相似,化学性质也相似,因此室温时Na2S2O3溶液的pH 7(填“>”、“=”或“<”)
(2)部分学生从S元素化合价推测Na2S2O3与SO2性质相似,均具有较强的 。
[实验探究]
取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究(填写下表中空格)。
[实验结论]
(6)探究①: 。
(7)探究②: 。
[问题讨论]
(8)甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由
。
(9)请你重新设计一个实验方案,证明Na2S2O3被氯水氧化。你的方案是
。
四、推断题
21.A、B、C、D均为中学化学中常见的物质,它们之间的转化关系如下图(部分产物已略去):
试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为 (填元素符号)
(2)若D是金属,C溶液在储存时应加入少量D,其理由是(用必要的文字和离子方程式表示) ;D在潮湿的空气中易发生吸氧腐蚀,写出腐蚀时原电池正极的电极反应式 。
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子方程式 。
22.部分中学化学常见元素的原子结构及性质如下表所示:
元素 结构及性质
A A 单质是生活中的常见金属,它有两种氯化物,相对分子质量相差 35.5
B B 原子最外层电子数是内层电子总数的 1/5
C C 是常见化肥的主要元素,单质常温下呈气态
D D 是地壳中含量最丰富的金属元素,工业上可通过电解法获取其单质
E 通常情况下,E 没有最高正价,A、B、C、D、F 都能与 E 形成化合物
F F 在周期表中可以排在 IA 族,也有人提出可以排在 VIIA 族
(1)E 元素在周期表中的位置为_____。
(2)B 与 C 形成的化合物的化学式为_____,它属于_____(填“离子”或“共价”)化合物。
(3)C 与 E 都是较活泼的非金属元素,两者的非金属性较强的是:_____(用化学符号回答), 请写出一个可以判断二者非金属性强弱的化学方程式__________________ 。
(4)B~F 各元素原子半径由小到大的顺序是___________________________(用元素符号表示)。
(5)有人认为 B、D 的单质用导线连接后插入 NaOH 溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式_________
五、计算题
23.根据所学知识填空:
(1)已知某反应的各物质浓度数据如下:
aA(g) + bB(g) 2C(g)
起始浓度(mol·L-1): 1.5 1.0 0
2 s末浓度(mol·L-1): 0.9 0.8 0.4
则①a= ,b= ;
②2 s内用B表示该反应的反应速率为 。
(2)由碳棒、铁片和200 mL 1.5 mol·L-1的稀硫酸组成的原电池中,当在碳棒上产生气体3.36 L(标准状况)时,求:①有 个电子通过了电线?(NA=6.02×1023)
②此时溶液中H+的物质的量浓度为 (不考虑溶液体积变化)。
24.已知分解100 g CaCO3需要177.7 kJ的热量,而12 g碳完全燃烧,则放出393 kJ的热。求:
(1)煅烧1 t石灰石需要多少热量?
(2)这些热量全部由碳燃烧提供,问理论上要消耗多少克碳?
试卷第6页,总8页
参考答案
1.B
【解析】
试题分析:把A、B、C、D四块金属泡在稀H2SO4中,用导线两例相连可以组成各种原电池。若A、B相连时,A为负极说明金属活动性A>B;C、D相连,D上有气泡逸出,则C为负极,D为正极,金属活动性C>D;A、C相连时A极减轻,则金属活动性A>C;B、D相连,B为正极,则金属活动性D>B,所以四种金属的活泼性顺序由大到小排列为A>C>D>B,选项B正确。
考点:考查金属活动性大小比较的知识。
2.C
【解析】
【分析】
化学平衡状态到达的标志的分析,要抓两条件线索:一是正反应速率=逆反应速率;二是“变量”不变。由此分析。
【详解】
A.气体颜色的深浅决定于该气体的浓度大小,H2(g)+Br2(g) 2HBr(g)反应体系中Br2蒸气呈红棕色,在反应过程中Br2的浓度一直在变化,当气体颜色保持不变,说明Br2浓度保持不变,所以当Br2的浓度不变(即气体颜色不变)时表明反应到达平衡状态,A项错误;
B.根据阿伏加德罗定律的推论知:恒温、恒容下,任何气体的压强与气体分子数成正比。而反应2NO2(g) N2O4(g)中反应前后分子数目不相同,所以反应过程中反应体系的分子数目一直在变化,压强也就一直在变化,所以当反应体系中气体的压强保持不变时即到达平衡状态,B项错误;
C.根据化学计量数可知,当H2与N2初始物质的量之比为3:1时,那么反应过程中H2与N2的物质的量之比一直是3:1,所以反应体系中H2与N2的物质的量之比保持3∶1,不一定是平衡状态,C项正确;
D.根据密度公式看,因为容积不变,所以气体密度与气体质量成正比。反应体系中只有CO2是气体,CO2在反应过程中质量一直在变化,反应体系中气体的密度也一直在变化,所以当气体密度保持不变时即到达平衡状态,D项错误;答案选C。
【点睛】
注意:若反应向正反应方向进行,任一时刻某反应物的量=初始量-消耗量,某生成物的量=初始量+生成量。
3.C
【解析】
试题分析:设反应放出的热量为x,
由2SO2(g)+O2(g)?2SO3(g)△H=-Q KJ/mol
2 QkJ
4mol×90% x
2/ (4mol×90%)=QkJ/x
解得x=1.8QkJ, 故选C
考点:化学平衡的有关计算
4.A
【解析】一段时间后,用手触摸试管外壁感觉烫手,说明反应为放热反应,则反应物的总能量高于生成物的总能量,将化学能转化为热能,答案选A。
5.D
【解析】
A、生成SO3和消耗SO2,反应都是向正反应方向进行,因此不能说明反应达到平衡,故A错误;B、此反应是放热反应,降低温度,平衡向正反应方向移动,正反应速率减小程度比逆反应速率减小程度小,故B错误;C、2SO2+O22SO3 △n
2 1 2 1
2×0.315 0.315 气体通入到足量的BaCl2溶液中,发生SO3+H2O+BaCl2=BaSO4↓+2HCl,n(SO3)=n(BaSO4)=2×0.315mol=0.63mol,质量为0.63×233g=146.79g,故C错误;
D、 2SO2+O22SO3 △n
起始: a 1.1 0
变化: 0.63 0.315 0.63
平衡:a-0.63 0.785 0.63 相同条件下,达到平衡,气体压强是反应前的82.5%,即为(a+1.1)/(a+0.785)=1/0.825,解得a=0.7mol,即SO2的转化率为0.63/0.7×100%=90%,故D正确。
点睛:用不同物质的反应速率表示反应达到平衡,要求反应的方向是一正一逆,且反应速率之比等于化学计量数之比,生成SO3和消耗SO2,反应都向正反应方向进行,因此不能作为达到平衡的标志。
6.C
【解析】
试题分析:A.不能自发进行氧化还原反应,不具备原电池构成条件,错误。B.没有电解质溶液,不能构成原电池,错误。C.具备原电池构成条件,可以形成原电池,正确。D. 缺少电极,错误。
考点:考查原电池的构成条件的判断的知识。
7.C
【解析】
在一定条件下,当可逆反应的正反应速率和逆反应速率相等时,反应混合物中各种物质的浓度或含量不再变化的状态,称为化学平衡状态。平衡时各种物质的浓度不再变化,但物质的浓度不一定相等,①不正确,②正确。由于反应前后气体体积是变化的,所以压强在反应过程中是变化的,因此如果压强不再变化,可以说明反应已达到平衡状态。④中反应速率的方向相反,但不满足速率之比是相应的化学计量数之比,不能说明。答案选C。
8.B
【解析】
试题分析:A.使用高纯度的锌粒,反应速率减慢,错误;B.滴加几滴硫酸铜溶液,硫酸铜与锌发生置换反应,产生的Cu与Zn及硫酸形成了原电池,从而加快了化学反应速率,正确;C.使用浓H2SO4在溶液中主要以分子的形式存在,离子的浓度减小,反应速率减慢,错误;D.使用浓HNO3有强氧化性,与金属发生反应,一般不能产生氢气,错误。
考点:考查化学反应速率的知识。
9.C
【解析】分析:锌锰干电池中,锌作负极,锌失电子发生氧化反应,碳作正极,二氧化锰在正极上得电子发生还原反应,氯化铵是电解质,据此分析。
详解:A.锌锰干电池中,锌筒作负极,石墨作正极,选项A错误;B.锌锰干电池中,锌筒作负极,石墨作正极,正极上二氧化锰得电子发生还原反应,选项B错误;C.原电池中阳离子定向移动到正极,故铵根离子流向石墨电极,选项C正确;D.电子经导线由负极锌筒流向正极石墨电极,选项D错误;答案选C。
点睛:本题考查锌锰干电池,明确锌锰干电池的成分及放电原理是解本题关键,难度不大。
10.A
【解析】把不同物质的反应速率转化为一种物质的反应速率,都转化为A 物质的反应速率。
①VA=0.6mol/(L·s) ②VA=1.35mol/(L·s) ③VA=0. 6mol/(L·s) ④VA=0.675mol/(L·s)
故②VA=1.35mol/(L·s)反应速率最快,选A。
11.A
【解析】A.该原电池中,锌作负极,负极上锌失电子生成锌离子进入溶液,所以锌片的质量会变小,故A正确;B.铜作正极,正极上氢离子得电子生成氢气,所以铜电极附近不会出现蓝色,故B错误;C.锌作负极,铜作正极,电子从锌沿导线流向铜,电子不会经过电解质,故C错误;D.锌作该原电池的负极,铜作正极,故D错误;故选A。
点睛:明确原电池工作原理,准确判断正负极是解题关键,根据金属的活泼性知,锌作负极,铜作正极,负极上锌失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,电流从正极沿导线流向负极。
12.A
【解析】该反应是放热反应,根据能量守恒定律知,反应物所具有的总能量高于产物所具有的总能量;放热反应的本质是:生成物成键释放的总能量大于反应物断键吸收的总能量,故选A。
13.D
【解析】根据A(g)+3B(g)?2C(g)可知,都用物质C表示反应速率,则分别是:A.v(A)=0.5mol?L-1?min-1,则v(C)=2v(A)=1mol?L-1?min-1;B.v(B)=1.2mol?L-1?min-1,则v(C)=v(A)=0.8mol?L-1?min-1;C.v(C)=0.4mol?L-1?min-1;D.v(C)=1.1mol?L-1?min-1,反应速率最快是D,故选D。
点睛:本题考查反应速率快慢的判断,该题是高考中的常见考点和题型。解题方法是:把不同物质的反应速率换算成同一物质的反应速率进行比较,注意单位是否相同。
14.B
【解析】根据反应3SiCl4(g)+2N2(g)+6H2(g)Si3N4(s)+12HCl(g) ΔH<0,和图表知前2min Si3N4 的
的变化量2.8g/140g.mol-1= 0.02 mol,。 A. 250℃,前 2min, Si3N4 的平均反应速率为 0.005 mol·L-1·min-1故A 错;B.,250℃根据化学反应关系式 N2(g)3H2(g) 反应达到平衡时,两者转化率的比值为1:3,300℃反应达到平衡时N2(g)3H2(g) ,两者转化率的比值为1:3。故B正确; C. 升高温度加快化学反应速率,达到平衡前, 300℃条件的反应速率比 250℃快; 平衡后, 300℃也比 250℃快。故C错;D. 因为3SiCl4(g)+2N2(g)+6H2(g)Si3N4(s)+12HCl(g) ΔH<0,为放热反应,不同温度下达到平衡时,反应的程度不同,放出的热量不一样多。故D错。
点睛:按计量数比例加料时,反应物的转化率之比就等于计量数之比。反应放出的热量和反应物的量有关,参加反应的越多放出或吸收的热量越多。所以ΔH大小与计量数有关。
15.D
【解析】
【详解】
A.燃烧反应为放热反应,则①②为放热反应,故A错误;
B.反应②放热,因此其作用还有为反应③提供能量,故B错误;
C.参与反应的固体有ZnS、ZnO、C和Zn,所以用这种方法不可能得到的纯净的锌单质,故C错误;
D.已知:
① 2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g) △H1=a kJ?mol-1
② 2C(s)+O2(g)=2CO(g) △H2=b kJ?mol-1
③ ZnO(s)+CO(g)=Zn(g)+CO2(g) △H3=c kJ?mol-1
结合盖斯定律可知(①+②)/2+③得方程式ZnS(s)+C(s)+2O2(g)=Zn(g)+SO2(g)+CO2(g),其△H=(a+b+2c)/2 kJ?mol-1,故D正确;
答案选D。
16.(1) 锌片 铜片 稀H2SO4
(2)负极:Zn - 2e? = Zn2+; 正极:2H+ + 2e? = H2↑
【解析】
试题分析:(1)在该原电池中,由于金属活动性:Zn>Cu,所以Zn是负极,Cu是正极,电解质溶液是稀H2SO4。(2)在负极,Zn失去电子,被氧化变为Zn2+,电极反应式是Zn - 2e? = Zn2+;在正极,溶液中的H+得到电子,被还原变为H2,电极反应式是2H+ + 2e? = H2↑。
考点:考查原电池的电极材料、电极反应式的书写的知识。
17.⑴ > ⑵ 0.03 mol·L-1·min-1⑶ 提高原料CO、H2的利用率(或提高产量、产率亦可)。
【解析】
(1)根据物质的浓度可知,此时<160,所以反应向正反应方向进行,即正反应速率大于逆反应速率。
(2)根据(1)可知,起始时氢气的浓度是1.0mol/L,所以在(2)中氢气的浓度变化量是0.6mol/L,则生成甲醇是0.3mol/L,则甲醇的反应速率是0.3mol/L÷10min=0.03 mol·L-1·min-1。
(3)生产过程中,合成气进行循环,可以提高原料CO、H2的利用率。
18.(1)环形玻璃搅拌器
(2)减少实验过程中的热量损失
(3)偏小 (4)不相等 (5)偏小
【解析】(3)大烧杯上如不盖硬纸板,会有热量的散失,则求得的中和热的值偏小。
(4)中和反应放出的热量与参加反应的酸和碱的物质的量有关,物质的量不同,防出的热量不同。
(5)氨水是弱碱,在水溶液中电离时吸收热量,故测得的反应热偏小。
19.(15分)(1)2~3 min (1分) 该反应是放热反应,此时温度高(2分)
(2)4~5 min (1分) 此时H+浓度小(2分)
(3)0.1 mol/(L·min)(2分) A、B(2分)
(4)2H+ + 2e- =H2↑(2分)
【解析】
试题分析:根据影响化学反应速率的因素有浓度、温度以及固体的表面积大小等因素,温度越高、浓度越大、固体表面积越大,反应的速率越大,从表中数据看出2 min~3 min收集的氢气比其他时间段多,原因是Zn置换H2的反应是放热反应,温度升高;4 min~5 min收集的氢气最少是因为随反应进行c(H+)下降;根据v=c/t 计算反应速率;影响氢气的量取决于H+的物质的量。
(1)从表中数据看出2 min~3 min收集的氢气比其他时间段多,虽然反应中c(H+)下降,但主要原因是Zn置换H2的反应是放热反应,温度升高,温度对反应速率影响占主导作用.
(2)4 min~5 min收集的氢气最少,虽然反应中放热,但随着反应的进行c(H+)下降,反应物浓度越低,反应速率减小,浓度对反应速率影响占主导作用。
(3)在2~3min时间段内,n(H2)=0.112L÷22.4L/mol=0.005mol,由2HCl~H2得,消耗盐酸的物质的量为0.01mol,则υ(HCl)==0.1mol/(L?min)。
(4)加入蒸馏水,溶液的浓度减小,反应速率减小,H+的物质的量不变,氢气的量也不变,故A正确;加入氯化钠溶液,降低盐酸的浓度,反应速率减小,H+的物质的量不变,氢气的量也不变,故B正确;加入NaNO3溶液,降低盐酸的浓度,但此时溶液中含有硝酸,与金属反应得不到氢气,故C错误;加入CuSO4溶液,锌能置换出铜,锌、铜、稀盐酸形成原电池,加快了化学反应速率,氢气的量不变,故D错误;加入Na2CO3溶液,Na2CO3能与盐酸反应,盐酸的浓度减小,反应速率减小,H+的物质的量减小,氢气的量也减小,故E错误,答案选A、B。
(5)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。在反应中锌失去电子,则锌是负极。正极可以是石墨或金属性弱于锌的铜等。氢离子在正极得到电子,则电解质是盐酸,其中正极电极反应式是2H+ + 2e- =H2↑,装置图为 (
锌
铜
稀盐酸
→
e
-
)。
考点:考查化学反应速率的影响因素、反应速率的计算以及原电池原理的应用
点评:该题是中等难度的试题,试题基础性强,紧扣教材基础知识,有利于培养学生的学习兴趣和规范答题能力,有助于提高学生的应试能力。该题在答题时需要注意的是反应过程中浓度以及温度的变化,注重基础知识的积累。
20.
【解析】
(1)=
(2)还原性
(3)用玻璃棒蘸取待测液Na2S2O3点在pH试纸上,然后与标准比色卡比较,确定其pH值
(4)S2O32―+H2OHS2O3―+OH―,硫代硫酸钠中有一个硫相当于亚硫酸中的硫,因此其水解产生氢氧根,水溶液呈酸性。
(5)硫代硫酸钠把Cl2还原:S2O32―+4Cl2+5H2O=2SO42―+8Cl―+10H+
(6)硫代硫酸钠水溶液呈碱性。
(7)硫代硫酸钠具有还原性
(8)该方案不合理。因氯水过量,Ag+ 与Cl― 会生成AgCl沉淀。
(9)取反应后的溶液少量,加入氯化钡溶液,再加入盐酸,若产生的沉淀不溶解,则硫代硫酸钠被氧化了;否则没被氧化。
21.(1)Na;(2)加入少量铁,防止Fe2+被氧化为Fe3+;
2Fe3++Fe = 3Fe2+;O2+2H2O+4e— = 4OH—;
(3)Al(OH)3+3H+ = Al3++3H2O或 Al(OH)3+OH—= AlO2—+2H2O
【解析】
试题分析:(1)D是具有氧化性的单质,A元素属于短周期主族金属元素,根据反应关系可知A为Na,B为Na2O,D为O2 ,C为Na2O2;(2)若D是金属.说明金属具有变价,A稀溶液具有氧化性,推断为:HNO3→Fe(NO3)3→Fe(NO3)2,D为Fe,因Fe(NO3)2易被氧化而变质,可加入铁防止被氧化生成硝酸铁,离子方程式为2Fe3++Fe = 3Fe2+,铁在潮湿的空气中易发生吸氧腐蚀,发生腐蚀时原电池正极是氧气获得电子变为OH-,该的电极反应式为O2+2H2O+4e— = 4OH—;(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B.判断为:Al3+→Al(OH)3→AlO2-; B转化为C的所有可能的离子方程式为生成氢氧化铝沉淀,在酸溶解的离子方程式是Al(OH)3+3H+ = Al3++3H2O,或碱中Al(OH)3溶解反应的离子方程式为Al(OH)3+OH—= AlO2—+2H2O。
考点:考查无机物的推断、离子方程式的书写、物质的保存方法等知识。
22.第二周期第ⅥA 族 Mg3N2 离子 O 4NH3+3O2=====2N2+6H2O H
【分析】
A是生活中的常见金属,它有两种氯化物,相对分子质量之差为35.5,则A为Fe;B原子最外层电子数是内层电子数的1/5,这说明B应该是第三周期元素,则B是Mg元素;C是常见化肥的主要元素,单质常温下呈气态,则C为N元素;D是地壳中含量最丰富的金属元素,工业上可通过电解法获取其单质,则D为Al元素;F在周期表中可以排在ⅠA族,也有人提出排在VⅡA族,则F为H元素;通常情况下,E没有最高正价,A、B、C、D、F 都能与E形成化合物,则E为O元素,据此分析。
【详解】
根据表格中提供的信息,可以推断A为Fe、B为Mg、C为N、D为Al、E为O、F为H。
(1)E为O元素,氧元素位于第二周期第ⅥA族,故答案为:第二周期第ⅥA族。
(2)Mg与N形成的化合物为Mg3N2,属于离子化合物,故答案为:Mg3N2,离子。
(3)C与E分别为N、O元素,N与O位于同一周期,非金属性逐渐增强,非金属性较强的是O,O2的氧化性强于N2,可以通过单质的置换反应验证,反应方程式为:4NH3+3O2=2N2+6H2O,故答案为:O,4NH3+3O2=2N2+6H2O。
(4)B~F分别为Mg、N、Al、O、H,电子层数越多,半径越大,若电子层数相同,核电荷数越大,半径越小,所以B~F各元素原子半径由小到大的顺序是H
【点睛】
非金属性强弱的比较规律:①单质的氧化性:一般情况下,氧化性越强,对应非金属性越强;②单质和酸或者和水的反应程度:反应越剧烈,非金属性越强;③对应氢化物的稳定性:氢化物越稳定,非金属性越强;④和氢气化合的难易程度:化合反应越容易,非金属性越强;⑤最高价氧化物对应水化物的酸性:酸性越强,非金属越强;⑥由对应最低价阴离子的还原性:还原性越强,对应非金属性越弱;⑦置换反应:非金属性强的制非金属性弱的。
23.(每空2分,共10分)
(1)①3 1 ②0.1 mol·(L·s)-1
(2)①1.806×1023 ②1.5 mol·L-1
【解析】
试题分析:(1)①根据所给化学方程式可知,2s末,A的物质的量浓度减小(1.5-0.9)mol/L =0.6mol/L,C的物质的量浓度增加0.4mol/L,B的物质的量浓度减小(1.0-0.8)mol/L=0.2 mol/L,所以a:2=0.6:0.4=3:2,b:2=0.2:0.4=1:2,所以a=3,b=1;
②2 s内用B表示该反应的反应速率为0.2mol/L/2s=0.1 mol·(L·s)-1;
(2)①该原电池的实质是Fe与稀硫酸的反应生成氢气,所以碳棒为正极,产生的气体为氢气,3.36L氢气的物质的量是3.36L/22.4L/mol=0.15mol,所以转移电子数是0.15mol×2×NA=1.806×1023;
②原溶液中氢离子的物质的量是0.2L×1.5mol/L×2=0.6mol,电解产生0.15mol氢气,则氢离子的物质的量减少0.3mol,所以溶液中的氢离子的物质的量浓度是(0.6-0.3)mol/0.2L=1.5 mol·L-1。
考点:考查反应速率的计算、物质的量浓度的计算
24.(1)1.777×106 kJ;(2)5.4×104 g
【解析】(1)分解100g CaCO3需要177.7kJ的热量,煅烧1t石灰石需要热量为177.7kJ× =1.777×106kJ,答:煅烧1t石灰石需要1.777×106kJ热量;
(2)12g碳完全燃烧,则放出393kJ的热,热量全部由碳燃烧提供,问理论上要消耗碳12g×=5.4×104g,答:热量全部由碳燃烧提供,理论上要消耗5.4×104g碳。
