苏教版高中化学必修2专题1第1单元原子核外电子排布与元素周期律 (共45张PPT)
文档属性
| 名称 | 苏教版高中化学必修2专题1第1单元原子核外电子排布与元素周期律 (共45张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-02-23 00:00:00 | ||
图片预览









文档简介
课件45张PPT。专题1 微观结构与物质的多样性第一单元 原子核外电子排布与元素周期律一、原子核外电子的排布复习:
1.什么是原子?
2.原子由什么微粒构成的??原子 指化学反应中不可再分的基本微粒。原子在化学反应中不可分割,但在物理状态中可以分割。原子序数=核电荷数=质子数=核外电子数
(数值上)
质量数=质子数+中子数
电子的特征:
1、质量很小,是中子或质子质量的1/1836
(质子质量为1.673×10-27kg,中子质量为1.675×10-27kg)
2、体积很小
3、运动速度很快,接近光速即3×108米/秒<讨论>电子在原子内有“广阔”的运动空间,在这“广阔”的空间里,电子怎样运动呢?有规律吗?科学模型处理:
1、原子核外电子是分区域运动的,人们把核外电子运动
的不同区域看作不同的电子层(模型思想)
2、各个区域上运动着的电子的能量是不同的,即各电子
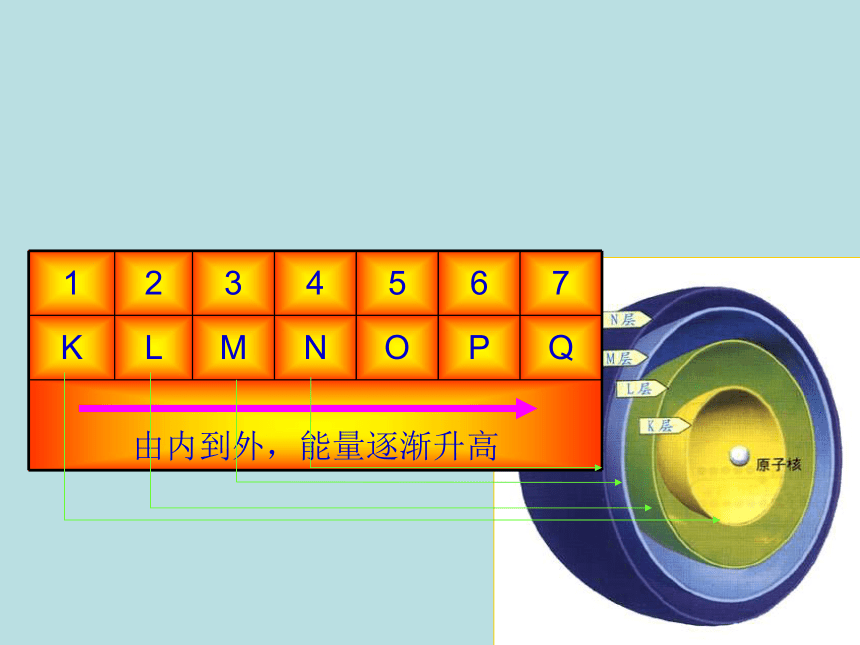
层上电子的能量不同问题:目前人们把原子核外分为几个电子层呢?
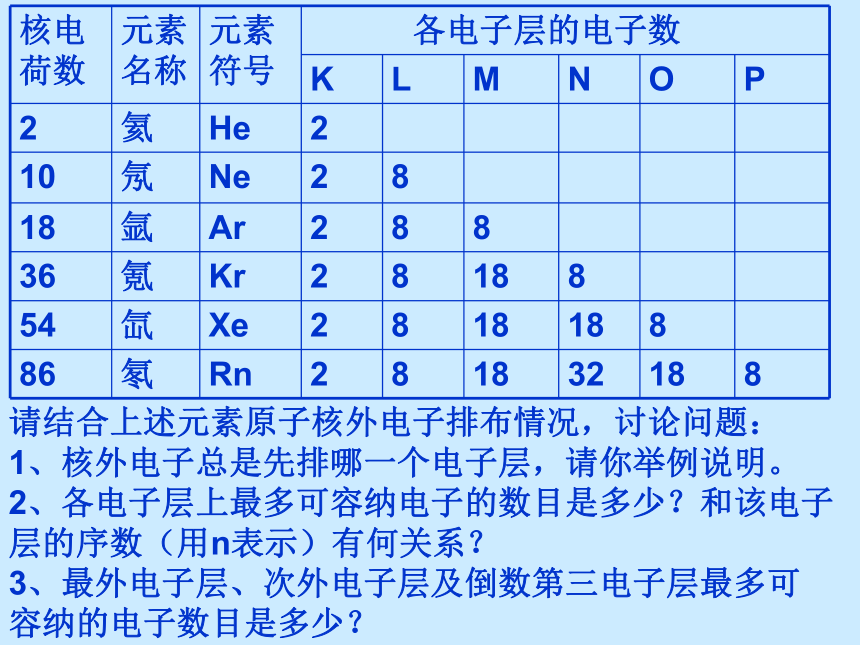
在各电子层上运动的电子的能量有什么区别呢?近→远低→高K L M N O P Q各电子层中电子离核远近和电子能量大小比较各个电子层所容纳的电子数有规律吗?请结合上述元素原子核外电子排布情况,讨论问题:
1、核外电子总是先排哪一个电子层,请你举例说明。
2、各电子层上最多可容纳电子的数目是多少?和该电子层的序数(用n表示)有何关系?
3、最外电子层、次外电子层及倒数第三电子层最多可
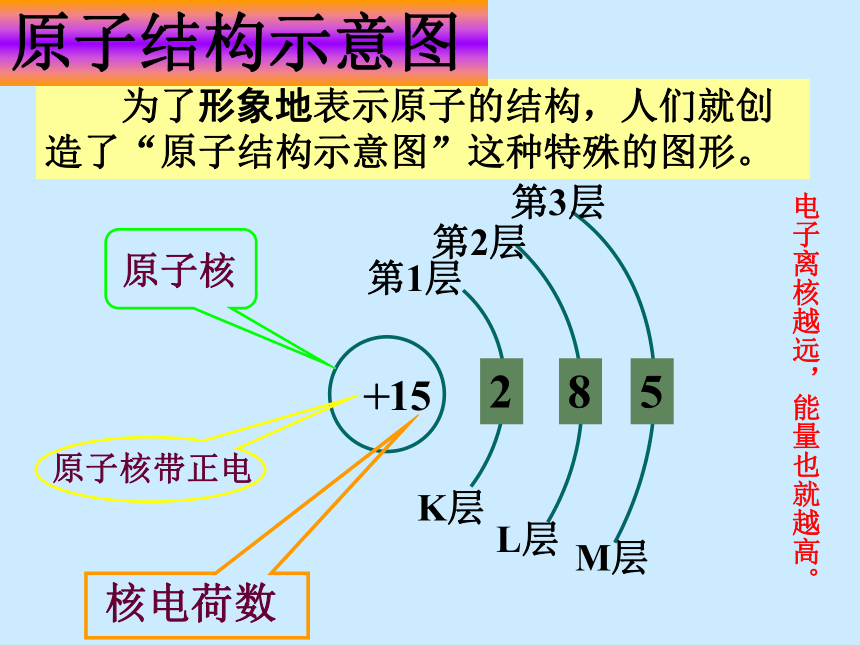
容纳的电子数目是多少?核外电子分层排布的一般规律22n281832 为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。15第1层第2层第3层K层L层M层285原子结构示意图+电子离核越远,能量也就越高。
核电荷数为1~18的元素原子核外电子层排布思考:请你画出硫离子、钠离子的结构示意图最外层电子数决定化学性质原子核外电子的排布分层的排布排
布
的
规
律由于电子能量的不同而分层排布,由近到远,由能量低到能量高。1.能量由低到高;2.每层最多容纳电子数目是2n2。3.最外层电子数目不超过8个,K层为最外层时不超过2个。 4.次外层电子数目不超过18个, [课堂小结]1.下面关于多电子原子核外电子的运动规律的叙述正确的是( )
A.核外电子是分层运动的
B.所有电子在同一区域里运动
C.能量高的电子在离核近的区域运动
D.能量低的电子在离核远的区域绕核旋转
2.若aAn+与bB2-两种离子的核外电子层结构相同,
则a的数值为 ( )?
A.b+n+2 B.b+n-2 C.b-n-2 D.b-n+2课堂练习AA3.根据下列叙述,写出元素名称
(1)A元素原子核外M层电子数是L层电子数的1/2;___________
(2)B元素原子的最外层电子数是次外层电子数的1.5倍;_____
(3)C元素的次外层电子数是最外层电子数的1/4;________
硅硼氖4.A元素原子M层上有6个电子,B元素原子的核外电子总数比A元素原子的少5个,
(1)画出A元素的原子结构示意图;
(2)A、B两元素形成化合物的化学式。二、元素周期律1、最外层电子排布的周期性课本P3图1-3随着元素核电荷数的递增,元素原子最外层电子数呈现周期性的变化。逐渐减小逐渐减小周期性2、原子半径大小的周期性2、原子半径大小的周期性(1)同一行自左到右,电子层数不变,
最外层电子数增加,原子半径减小;
(2)同一列自上而下,最外层电子数不变,
电子层数增加,原子半径增大;
3~9号元素或11~17号元素随着核电荷数的递增,原子半径的变化规律是 : 3.元素金属性与非金属性变化的周期性一、元素金属性强弱的判断依据:
1、单质越容易从水或酸中置换出氢气,其金属性越强。
2、元素最高价氧化物对应的水化物的碱性越强,其金属性越强。
3、金属性强的金属可以置换金属性弱的金属。
二、元素非金属性强弱判断的依据:
1、单质越容易与氢气反应形成气态氢化物,其非金属性越强。
2、气态氢化物越稳定,其非金属性越强。
3、元素最高价氧化物对应水化物的酸性越强,其非金属性越强、
4、与同种变价金属反应,金属被氧化的程度越大,非金属性越强。元素金属性变化规律的探究Na Mg Al 1、单质越容易从水或酸中置换出氢气,其金属性越强。?(1)钠与冷水剧烈反应:(浮、熔、游、响、红)参见P5实验1、实验2(2)镁与冷水反应产生极其少量的气泡,溶液变浅红;加热后产生大量气泡,溶液颜色加深。>参见P5实验3(3)镁与盐酸剧烈反应;
(4)铝与盐酸迅速反应;Na Mg Al>>?2、元素最高价氧化物对应的水化物的碱性越强,其金属性越强。
Na Mg Al Na2O MgO Al2O3 NaOH > Mg(OH)2 > Al(OH)3最高价氧化物碱>>3、金属性强的金属可以置换金属性弱的金属。金属活动性顺序表中,前面的金属可以置换后面的金属,例如:Fe可以置换Cu,Cu可以置换Ag元素非金属性强弱判断的依据:
1、单质越容易与氢气反应形成气态氢化物,其非金属性越强。
2、气态氢化物越稳定,其非金属性越强。
3、元素最高价氧化物对应水化物的酸性越强,其非金属性越强、
4、与同种变价金属反应,金属被氧化的程度越大,非金属性越强。
元素非金属性变化规律的探究高温磷蒸气加热点燃或光照不稳定
自燃较不稳定
易分解不很稳定
分解很稳定SiH4
SiO2PH3
P2O5H2S
SO3HCl
Cl2O7H4SiO4
弱酸H3PO4
中强酸H2SO4
强酸HClO4
最强酸弱 强最高价氧化物对应水化物的酸碱性金属性和非金属性递变金属性逐渐减弱,非金属性逐渐增强金属性逐渐减弱,非金属性逐渐增强结论: 元素的性质随着原子序数的递增呈周期性变化。
这个规律叫元素周期律。元素周期律是元素原子的核外电子排布的
周期性变化的必然结果4.元素化合价的周期性常见元素化合价的一般规律1~20号元素中,除了O、F外,
①元素的最高正价等于该元素原子的最外层电子数;
②最低负价与最高正价的关系为:最高正价+ /最低负价/ = 8
?最低负价=最外层电子数-8金属元素无负价(除零价外,在化学反应中只显正价); 既有正价又有负价的元素一定是非金属元素;三、元素周期表及其应用 知识回顾1、最外层电子排布的周期性2、原子半径大小的周期性3.元素金属性与非金属性变化的周期性4.元素化合价的周期性1、元素周期表人们把已经发现的元素按一定的规则排列成元素周期表元素周期表是元素周期律的具体表现形式 同一周期元素(稀有气体元素除外)的原子,核外电子层数( ),随着核电荷数的递增,最外层电子数逐渐( ),原子半径逐渐( ),元素的原子得到电子的能力逐渐( ),失去电子的能力逐渐( )。因此,同一周期的元素(稀有气体除外),从左到右金属性逐渐( ),非金属性逐渐( )。相同增加减小增强减弱减弱增强同一主族元素金属性和非金属性的变化规律探究 0 +7 +7 +7 -1 -1 -1 -1 HF HCl HBr HI 无 HClO4 HBrO4 HIO4 2)递变性1)相似性 同一主族元素的原子最外层电子数( ),随着核电荷数的增大,电子层数逐渐( ),原子半径逐渐( ),原子失去电子的能力逐渐( ),获得电子的能力逐渐( ),元素的金属性逐渐( ),非金属性逐渐( )。相同增加增大增强减弱减弱增强非金属性逐渐增强 0ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 1 2 3 4 5 6 7B Al SiGe Sb Te Po At As金属性逐渐增强 金属性逐渐增强 非金属性逐渐增强1、元素周期表的应用 ⑴ 学习和研究化学的规律和工具 ⑵ 研究发现新物质 预言新元素,寻找半导体材料(如锗、硅、硒等),在过渡元素中寻找催化剂(如铂、镍等)和耐高温耐腐蚀材料等。P10化学史话
1.什么是原子?
2.原子由什么微粒构成的??原子 指化学反应中不可再分的基本微粒。原子在化学反应中不可分割,但在物理状态中可以分割。原子序数=核电荷数=质子数=核外电子数
(数值上)
质量数=质子数+中子数
电子的特征:
1、质量很小,是中子或质子质量的1/1836
(质子质量为1.673×10-27kg,中子质量为1.675×10-27kg)
2、体积很小
3、运动速度很快,接近光速即3×108米/秒<讨论>电子在原子内有“广阔”的运动空间,在这“广阔”的空间里,电子怎样运动呢?有规律吗?科学模型处理:
1、原子核外电子是分区域运动的,人们把核外电子运动
的不同区域看作不同的电子层(模型思想)
2、各个区域上运动着的电子的能量是不同的,即各电子
层上电子的能量不同问题:目前人们把原子核外分为几个电子层呢?
在各电子层上运动的电子的能量有什么区别呢?近→远低→高K L M N O P Q各电子层中电子离核远近和电子能量大小比较各个电子层所容纳的电子数有规律吗?请结合上述元素原子核外电子排布情况,讨论问题:
1、核外电子总是先排哪一个电子层,请你举例说明。
2、各电子层上最多可容纳电子的数目是多少?和该电子层的序数(用n表示)有何关系?
3、最外电子层、次外电子层及倒数第三电子层最多可
容纳的电子数目是多少?核外电子分层排布的一般规律22n281832 为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。15第1层第2层第3层K层L层M层285原子结构示意图+电子离核越远,能量也就越高。
核电荷数为1~18的元素原子核外电子层排布思考:请你画出硫离子、钠离子的结构示意图最外层电子数决定化学性质原子核外电子的排布分层的排布排
布
的
规
律由于电子能量的不同而分层排布,由近到远,由能量低到能量高。1.能量由低到高;2.每层最多容纳电子数目是2n2。3.最外层电子数目不超过8个,K层为最外层时不超过2个。 4.次外层电子数目不超过18个, [课堂小结]1.下面关于多电子原子核外电子的运动规律的叙述正确的是( )
A.核外电子是分层运动的
B.所有电子在同一区域里运动
C.能量高的电子在离核近的区域运动
D.能量低的电子在离核远的区域绕核旋转
2.若aAn+与bB2-两种离子的核外电子层结构相同,
则a的数值为 ( )?
A.b+n+2 B.b+n-2 C.b-n-2 D.b-n+2课堂练习AA3.根据下列叙述,写出元素名称
(1)A元素原子核外M层电子数是L层电子数的1/2;___________
(2)B元素原子的最外层电子数是次外层电子数的1.5倍;_____
(3)C元素的次外层电子数是最外层电子数的1/4;________
硅硼氖4.A元素原子M层上有6个电子,B元素原子的核外电子总数比A元素原子的少5个,
(1)画出A元素的原子结构示意图;
(2)A、B两元素形成化合物的化学式。二、元素周期律1、最外层电子排布的周期性课本P3图1-3随着元素核电荷数的递增,元素原子最外层电子数呈现周期性的变化。逐渐减小逐渐减小周期性2、原子半径大小的周期性2、原子半径大小的周期性(1)同一行自左到右,电子层数不变,
最外层电子数增加,原子半径减小;
(2)同一列自上而下,最外层电子数不变,
电子层数增加,原子半径增大;
3~9号元素或11~17号元素随着核电荷数的递增,原子半径的变化规律是 : 3.元素金属性与非金属性变化的周期性一、元素金属性强弱的判断依据:
1、单质越容易从水或酸中置换出氢气,其金属性越强。
2、元素最高价氧化物对应的水化物的碱性越强,其金属性越强。
3、金属性强的金属可以置换金属性弱的金属。
二、元素非金属性强弱判断的依据:
1、单质越容易与氢气反应形成气态氢化物,其非金属性越强。
2、气态氢化物越稳定,其非金属性越强。
3、元素最高价氧化物对应水化物的酸性越强,其非金属性越强、
4、与同种变价金属反应,金属被氧化的程度越大,非金属性越强。元素金属性变化规律的探究Na Mg Al 1、单质越容易从水或酸中置换出氢气,其金属性越强。?(1)钠与冷水剧烈反应:(浮、熔、游、响、红)参见P5实验1、实验2(2)镁与冷水反应产生极其少量的气泡,溶液变浅红;加热后产生大量气泡,溶液颜色加深。>参见P5实验3(3)镁与盐酸剧烈反应;
(4)铝与盐酸迅速反应;Na Mg Al>>?2、元素最高价氧化物对应的水化物的碱性越强,其金属性越强。
Na Mg Al Na2O MgO Al2O3 NaOH > Mg(OH)2 > Al(OH)3最高价氧化物碱>>3、金属性强的金属可以置换金属性弱的金属。金属活动性顺序表中,前面的金属可以置换后面的金属,例如:Fe可以置换Cu,Cu可以置换Ag元素非金属性强弱判断的依据:
1、单质越容易与氢气反应形成气态氢化物,其非金属性越强。
2、气态氢化物越稳定,其非金属性越强。
3、元素最高价氧化物对应水化物的酸性越强,其非金属性越强、
4、与同种变价金属反应,金属被氧化的程度越大,非金属性越强。
元素非金属性变化规律的探究高温磷蒸气加热点燃或光照不稳定
自燃较不稳定
易分解不很稳定
分解很稳定SiH4
SiO2PH3
P2O5H2S
SO3HCl
Cl2O7H4SiO4
弱酸H3PO4
中强酸H2SO4
强酸HClO4
最强酸弱 强最高价氧化物对应水化物的酸碱性金属性和非金属性递变金属性逐渐减弱,非金属性逐渐增强金属性逐渐减弱,非金属性逐渐增强结论: 元素的性质随着原子序数的递增呈周期性变化。
这个规律叫元素周期律。元素周期律是元素原子的核外电子排布的
周期性变化的必然结果4.元素化合价的周期性常见元素化合价的一般规律1~20号元素中,除了O、F外,
①元素的最高正价等于该元素原子的最外层电子数;
②最低负价与最高正价的关系为:最高正价+ /最低负价/ = 8
?最低负价=最外层电子数-8金属元素无负价(除零价外,在化学反应中只显正价); 既有正价又有负价的元素一定是非金属元素;三、元素周期表及其应用 知识回顾1、最外层电子排布的周期性2、原子半径大小的周期性3.元素金属性与非金属性变化的周期性4.元素化合价的周期性1、元素周期表人们把已经发现的元素按一定的规则排列成元素周期表元素周期表是元素周期律的具体表现形式 同一周期元素(稀有气体元素除外)的原子,核外电子层数( ),随着核电荷数的递增,最外层电子数逐渐( ),原子半径逐渐( ),元素的原子得到电子的能力逐渐( ),失去电子的能力逐渐( )。因此,同一周期的元素(稀有气体除外),从左到右金属性逐渐( ),非金属性逐渐( )。相同增加减小增强减弱减弱增强同一主族元素金属性和非金属性的变化规律探究 0 +7 +7 +7 -1 -1 -1 -1 HF HCl HBr HI 无 HClO4 HBrO4 HIO4 2)递变性1)相似性 同一主族元素的原子最外层电子数( ),随着核电荷数的增大,电子层数逐渐( ),原子半径逐渐( ),原子失去电子的能力逐渐( ),获得电子的能力逐渐( ),元素的金属性逐渐( ),非金属性逐渐( )。相同增加增大增强减弱减弱增强非金属性逐渐增强 0ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 1 2 3 4 5 6 7B Al SiGe Sb Te Po At As金属性逐渐增强 金属性逐渐增强 非金属性逐渐增强1、元素周期表的应用 ⑴ 学习和研究化学的规律和工具 ⑵ 研究发现新物质 预言新元素,寻找半导体材料(如锗、硅、硒等),在过渡元素中寻找催化剂(如铂、镍等)和耐高温耐腐蚀材料等。P10化学史话
