2019年浙江省中考科学总复习专题练习:6 化学与曲线
文档属性
| 名称 | 2019年浙江省中考科学总复习专题练习:6 化学与曲线 |  | |
| 格式 | zip | ||
| 文件大小 | 290.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-03-02 10:59:33 | ||
图片预览


文档简介
TYPE6专题6 化学与曲线
/
命题重点:中考试题中往往会出现坐标图,这些坐标图往往以曲线的形式出现。在这类形式的题目中,常会涉及这样一些知识点:金属的性质、溶液的pH、质量守恒定律、酸碱盐的性质等。
方法要点:要解决这类问题,要搞清曲线的几个关键点:起点、转折点以及终点所代表的含义。
/
类型一 pH变化曲线问题
/1 下列实验中溶液的pH随加入试剂体积而变化的关系与图中相符的是 ( )
/
图T6-1
A.稀硫酸中不断滴入氢氧化钠溶液
B.NaOH溶液中不断滴入稀硫酸
C.Na2CO3溶液中不断滴入氢氧化钠溶液
D.NaOH溶液中不断滴入蒸馏水
【解法指导】 溶液的pH变化主要有两种情况:一是加水稀释使溶液的pH发生变化;二是加入的物质与原物质发生反应导致pH发生变化。在解决这类曲线问题时,我们要紧紧抓住曲线的起点、转折点和终点进行分析。本题中曲线的起点pH>7,因此是在碱性溶液进行的变化,再注意到转折点pH=7,终点pH<7,故应是往碱性溶液中加入了酸性物质且过量。
/
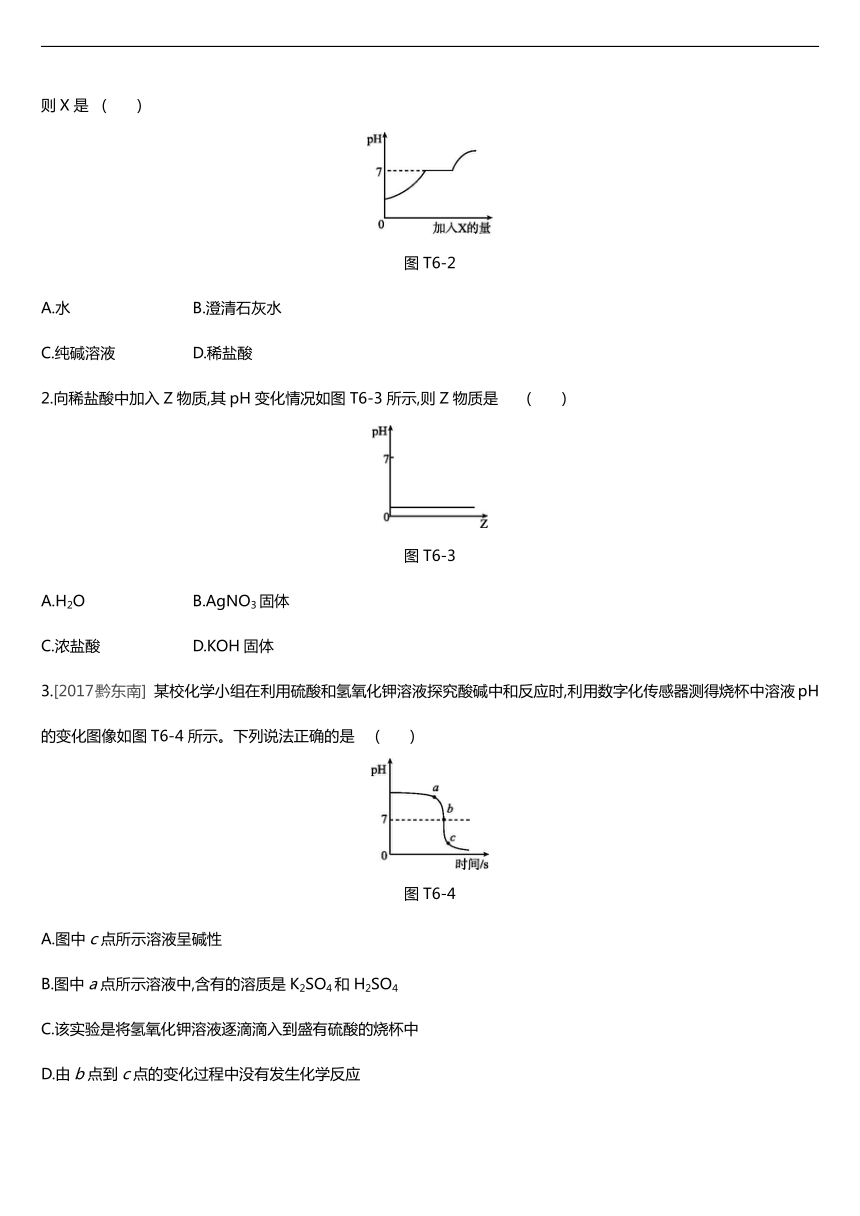
1.现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图T6-2所示。则X是 ( )
/
图T6-2
A.水 B.澄清石灰水
C.纯碱溶液 D.稀盐酸
2.向稀盐酸中加入Z物质,其pH变化情况如图T6-3所示,则Z物质是 ( )
/
图T6-3
A.H2O B.AgNO3固体
C.浓盐酸 D.KOH固体
3.[2017·黔东南] 某校化学小组在利用硫酸和氢氧化钾溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图T6-4所示。下列说法正确的是 ( )
/
图T6-4
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是K2SO4和H2SO4
C.该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸的烧杯中
D.由b点到c点的变化过程中没有发生化学反应
类型二 金属和酸、盐反应的曲线问题
/2 [2016·金华] 有A、B两种金属放入等质量分数的稀硫酸中,生成氢气的质量与反应时间的关系如图T6-5所示,下列结论合理的是 ( )
/
图T6-5
A.金属活动性A>B
B.生成氢气的质量A>B
C.反应的硫酸质量AD.反应的金属质量A【解法指导】 金属与酸反应的速率与金属的活动性有关,曲线越陡,说明金属越活泼。金属与酸反应产生氢气的质量与金属和酸溶液的质量、种类有关,等质量的化合价也相等的金属,与足量的酸反应时,相对原子质量越大,则生成的气体质量越少。另外根据质量守恒定律可知,若生成的氢气质量相等,说明反应消耗的酸中的氢元素质量也相等。
/3 [2017·泰安改编] 某同学在一定质量的AgNO3和Cu(NO3)2的混合溶液中加入铁粉,充分反应后,他对反应过程进行了分析,得到了以下图像(横坐标表示加入铁的质量),其中错误的是( )
/
图T6-6
【解法指导】 金属加入盐的混合溶液中,能否发生置换反应和置换反应的先后顺序取决于金属活动性顺序,金属活动性强的金属能够置换金属活动性比它弱的金属。同时,活动性最强的金属总是先置换活动性最弱的金属。反应过程中,溶液和固体质量的变化取决于反应进行的程度以及金属相对原子质量的大小。
/
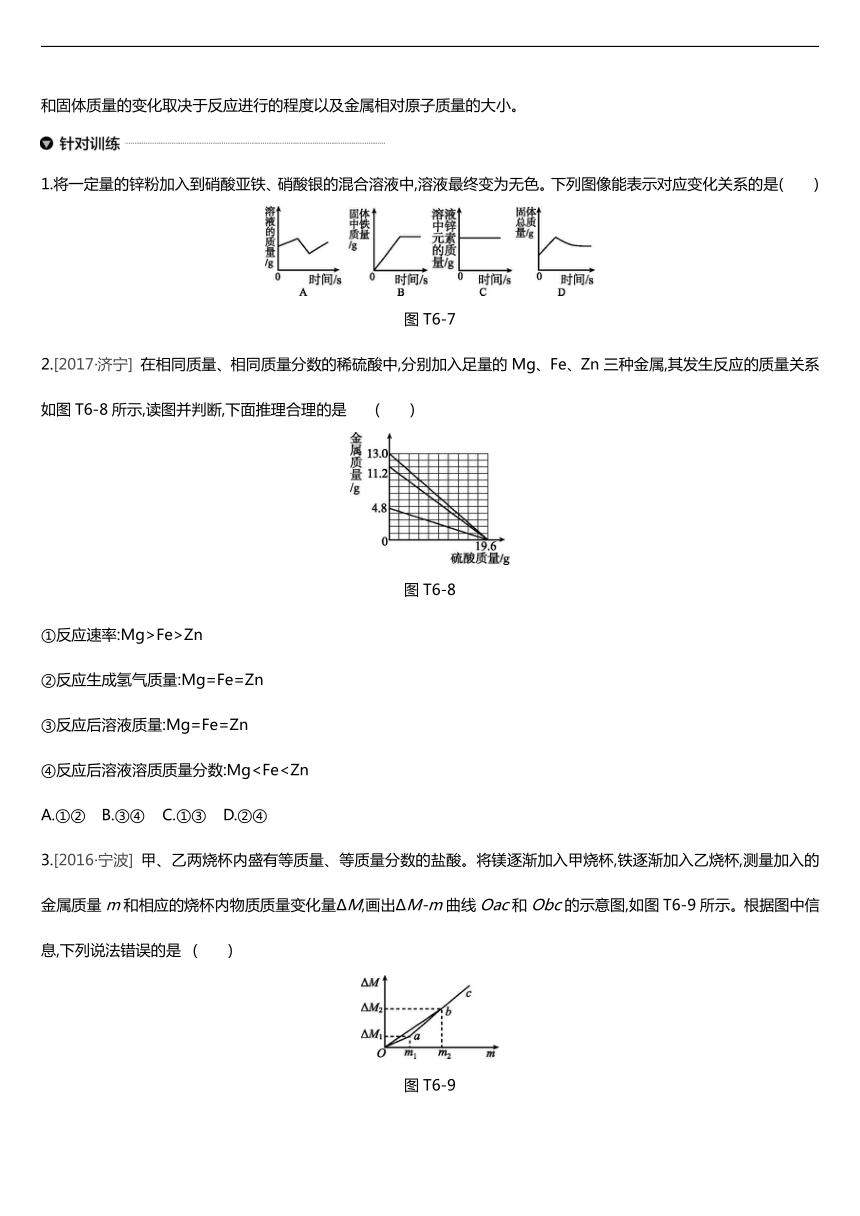
1.将一定量的锌粉加入到硝酸亚铁、硝酸银的混合溶液中,溶液最终变为无色。下列图像能表示对应变化关系的是( )
/
图T6-7
2.[2017·济宁] 在相同质量、相同质量分数的稀硫酸中,分别加入足量的Mg、Fe、Zn三种金属,其发生反应的质量关系如图T6-8所示,读图并判断,下面推理合理的是 ( )
/
图T6-8
①反应速率:Mg>Fe>Zn
②反应生成氢气质量:Mg=Fe=Zn
③反应后溶液质量:Mg=Fe=Zn
④反应后溶液溶质质量分数:MgA.①② B.③④ C.①③ D.②④
3.[2016·宁波] 甲、乙两烧杯内盛有等质量、等质量分数的盐酸。将镁逐渐加入甲烧杯,铁逐渐加入乙烧杯,测量加入的金属质量m和相应的烧杯内物质质量变化量ΔM,画出ΔM-m曲线Oac和Obc的示意图,如图T6-9所示。根据图中信息,下列说法错误的是 ( )
/
图T6-9
A.m1∶m2=3∶7
B.m1-ΔM1C.曲线Oac表示的是甲烧杯中ΔM与m的变化关系
D.当乙烧杯内加入铁的质量为m1时,溶液中溶质不止一种
4.[2017·绍兴] 往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图T6-10所示,下列说法中正确的是 ( )
/
图T6-10
A.c点对应溶液中含有的金属离子为Zn2+和Cu2+
B.bc段(不含两端点)析出的金属是Fe
C.ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、 Cu2+和Fe2+
D.若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,则m1>m2
类型三 含酸碱盐反应顺序的曲线问题
/4 [2016·丽水] 向一定量CaCl2和HCl的混合溶液中,逐渐加入Na2CO3溶液,反应过程中产生气体或沉淀的质量与加入的Na2CO3溶液的质量关系如图T6-11所示,下列说法错误的是 ( )
/
图T6-11
A.OE发生化学反应:Na2CO3+2HCl/2NaCl+H2O+CO2↑
B.PF有沉淀生成
C.G点溶液的pH>7
D.反应过程有气体和沉淀生成,不遵循质量守恒定律
【解法指导】 酸碱盐的混合溶液发生反应时,如果有酸存在,那么,碳酸盐和碱不可能以沉淀的形式析出,因为它们均能与酸反应。碳酸盐、碱首先与酸反应,待酸反应完,才与其他物质反应。本题中加入的碳酸钠溶液必然先与盐酸发生反应,因此OE段代表的是碳酸钠与盐酸反应的情况,它表示的是产生气体的质量。当盐酸不存在时,碳酸钠与氯化钙发生反应,所以PFG段代表生成沉淀的过程,其中F是转折点,代表氯化钙恰好被碳酸钠完全反应,G点代表碳酸钠过量。
/
1.在含有H2SO4和CuSO4的混合溶液中,逐滴加入NaOH溶液至过量,下列图像能正确反映生成沉淀的质量(m1)与加入NaOH溶液的质量(m2)的关系是 ( )
/
图T6-12
2.[2017·来宾] 现有盐酸和CaCl2的混合溶液,向其中逐滴滴入Na2CO3溶液,生成沉淀质量与滴入Na2CO3溶液质量的变化关系如图T6-13所示。下列说法正确的是 ( )
/
图T6-13
A.滴至a克时,溶液中反应为CaCl2+Na2CO3/2NaCl+CaCO3↓
B.滴至b克时,溶液中含HCl、NaCl两种溶质
C.滴至c克时,溶液中溶质质量比原混合溶液中溶质质量大
D.滴至d克时,溶液呈中性
3.某溶液由NaOH、HCl、H2SO4和MgCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图T6-14,下列说法正确的是 ( )
/
图T6-14
A.HCl和H2SO4一定存在
B.NaOH、H2SO4和MgCl2一定不存在
C.HCl和MgCl2一定存在
D.HCl一定存在,NaOH、H2SO4一定不存在,MgCl2可能存在
4.(双选)[2017·烟台] 下列图像能正确反映其对应的实验操作的是 ( )
/
图T6-15
A.向硫酸和硫酸铜的混合溶液中滴加过量的氢氧化钠溶液
B.向盛有一定量的氯化钙与盐酸混合溶液的烧杯中逐滴加入碳酸钠溶液至过量
C.常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
D.相同温度下,用两份等质量、等浓度的过氧化氢溶液制氧气,其中一份加入少量MnO2
5.[2017·金华] 有一包白色固体样品,可能含有碳酸钠、硫酸钠、氯化钠、氢氧化钠中的一种或几种。小科同学为探究其成分做了以下实验:
Ⅰ.取少量固体样品于烧杯中,先加足量的水溶解,再加入足量的BaCl2溶液,有白色沉淀产生;
Ⅱ.继续向烧杯中滴加稀盐酸并不断搅拌,烧杯内固体质量随加入稀盐酸质量的变化如图T6-16所示。
/
图T6-16
请回答下列问题:
(1)AB段观察到的现象是 。?
(2)C点时,溶液中一定含有的溶质是 。?
参考答案
◆分类突破
例1 B
针对训练
1.C 2.B 3.D
例2 B 例3 D
针对训练
1.D 2.D 3.B 4.C
例4 D
针对训练
1.B 2.C 3.C 4.AB
5.(1)白色沉淀部分溶解并有气泡产生
(2)NaCl、BaCl2、HCl
/
命题重点:中考试题中往往会出现坐标图,这些坐标图往往以曲线的形式出现。在这类形式的题目中,常会涉及这样一些知识点:金属的性质、溶液的pH、质量守恒定律、酸碱盐的性质等。
方法要点:要解决这类问题,要搞清曲线的几个关键点:起点、转折点以及终点所代表的含义。
/
类型一 pH变化曲线问题
/1 下列实验中溶液的pH随加入试剂体积而变化的关系与图中相符的是 ( )
/
图T6-1
A.稀硫酸中不断滴入氢氧化钠溶液
B.NaOH溶液中不断滴入稀硫酸
C.Na2CO3溶液中不断滴入氢氧化钠溶液
D.NaOH溶液中不断滴入蒸馏水
【解法指导】 溶液的pH变化主要有两种情况:一是加水稀释使溶液的pH发生变化;二是加入的物质与原物质发生反应导致pH发生变化。在解决这类曲线问题时,我们要紧紧抓住曲线的起点、转折点和终点进行分析。本题中曲线的起点pH>7,因此是在碱性溶液进行的变化,再注意到转折点pH=7,终点pH<7,故应是往碱性溶液中加入了酸性物质且过量。
/
1.现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图T6-2所示。则X是 ( )
/
图T6-2
A.水 B.澄清石灰水
C.纯碱溶液 D.稀盐酸
2.向稀盐酸中加入Z物质,其pH变化情况如图T6-3所示,则Z物质是 ( )
/
图T6-3
A.H2O B.AgNO3固体
C.浓盐酸 D.KOH固体
3.[2017·黔东南] 某校化学小组在利用硫酸和氢氧化钾溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图T6-4所示。下列说法正确的是 ( )
/
图T6-4
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是K2SO4和H2SO4
C.该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸的烧杯中
D.由b点到c点的变化过程中没有发生化学反应
类型二 金属和酸、盐反应的曲线问题
/2 [2016·金华] 有A、B两种金属放入等质量分数的稀硫酸中,生成氢气的质量与反应时间的关系如图T6-5所示,下列结论合理的是 ( )
/
图T6-5
A.金属活动性A>B
B.生成氢气的质量A>B
C.反应的硫酸质量A
/3 [2017·泰安改编] 某同学在一定质量的AgNO3和Cu(NO3)2的混合溶液中加入铁粉,充分反应后,他对反应过程进行了分析,得到了以下图像(横坐标表示加入铁的质量),其中错误的是( )
/
图T6-6
【解法指导】 金属加入盐的混合溶液中,能否发生置换反应和置换反应的先后顺序取决于金属活动性顺序,金属活动性强的金属能够置换金属活动性比它弱的金属。同时,活动性最强的金属总是先置换活动性最弱的金属。反应过程中,溶液和固体质量的变化取决于反应进行的程度以及金属相对原子质量的大小。
/
1.将一定量的锌粉加入到硝酸亚铁、硝酸银的混合溶液中,溶液最终变为无色。下列图像能表示对应变化关系的是( )
/
图T6-7
2.[2017·济宁] 在相同质量、相同质量分数的稀硫酸中,分别加入足量的Mg、Fe、Zn三种金属,其发生反应的质量关系如图T6-8所示,读图并判断,下面推理合理的是 ( )
/
图T6-8
①反应速率:Mg>Fe>Zn
②反应生成氢气质量:Mg=Fe=Zn
③反应后溶液质量:Mg=Fe=Zn
④反应后溶液溶质质量分数:Mg
3.[2016·宁波] 甲、乙两烧杯内盛有等质量、等质量分数的盐酸。将镁逐渐加入甲烧杯,铁逐渐加入乙烧杯,测量加入的金属质量m和相应的烧杯内物质质量变化量ΔM,画出ΔM-m曲线Oac和Obc的示意图,如图T6-9所示。根据图中信息,下列说法错误的是 ( )
/
图T6-9
A.m1∶m2=3∶7
B.m1-ΔM1
D.当乙烧杯内加入铁的质量为m1时,溶液中溶质不止一种
4.[2017·绍兴] 往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图T6-10所示,下列说法中正确的是 ( )
/
图T6-10
A.c点对应溶液中含有的金属离子为Zn2+和Cu2+
B.bc段(不含两端点)析出的金属是Fe
C.ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、 Cu2+和Fe2+
D.若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,则m1>m2
类型三 含酸碱盐反应顺序的曲线问题
/4 [2016·丽水] 向一定量CaCl2和HCl的混合溶液中,逐渐加入Na2CO3溶液,反应过程中产生气体或沉淀的质量与加入的Na2CO3溶液的质量关系如图T6-11所示,下列说法错误的是 ( )
/
图T6-11
A.OE发生化学反应:Na2CO3+2HCl/2NaCl+H2O+CO2↑
B.PF有沉淀生成
C.G点溶液的pH>7
D.反应过程有气体和沉淀生成,不遵循质量守恒定律
【解法指导】 酸碱盐的混合溶液发生反应时,如果有酸存在,那么,碳酸盐和碱不可能以沉淀的形式析出,因为它们均能与酸反应。碳酸盐、碱首先与酸反应,待酸反应完,才与其他物质反应。本题中加入的碳酸钠溶液必然先与盐酸发生反应,因此OE段代表的是碳酸钠与盐酸反应的情况,它表示的是产生气体的质量。当盐酸不存在时,碳酸钠与氯化钙发生反应,所以PFG段代表生成沉淀的过程,其中F是转折点,代表氯化钙恰好被碳酸钠完全反应,G点代表碳酸钠过量。
/
1.在含有H2SO4和CuSO4的混合溶液中,逐滴加入NaOH溶液至过量,下列图像能正确反映生成沉淀的质量(m1)与加入NaOH溶液的质量(m2)的关系是 ( )
/
图T6-12
2.[2017·来宾] 现有盐酸和CaCl2的混合溶液,向其中逐滴滴入Na2CO3溶液,生成沉淀质量与滴入Na2CO3溶液质量的变化关系如图T6-13所示。下列说法正确的是 ( )
/
图T6-13
A.滴至a克时,溶液中反应为CaCl2+Na2CO3/2NaCl+CaCO3↓
B.滴至b克时,溶液中含HCl、NaCl两种溶质
C.滴至c克时,溶液中溶质质量比原混合溶液中溶质质量大
D.滴至d克时,溶液呈中性
3.某溶液由NaOH、HCl、H2SO4和MgCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图T6-14,下列说法正确的是 ( )
/
图T6-14
A.HCl和H2SO4一定存在
B.NaOH、H2SO4和MgCl2一定不存在
C.HCl和MgCl2一定存在
D.HCl一定存在,NaOH、H2SO4一定不存在,MgCl2可能存在
4.(双选)[2017·烟台] 下列图像能正确反映其对应的实验操作的是 ( )
/
图T6-15
A.向硫酸和硫酸铜的混合溶液中滴加过量的氢氧化钠溶液
B.向盛有一定量的氯化钙与盐酸混合溶液的烧杯中逐滴加入碳酸钠溶液至过量
C.常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
D.相同温度下,用两份等质量、等浓度的过氧化氢溶液制氧气,其中一份加入少量MnO2
5.[2017·金华] 有一包白色固体样品,可能含有碳酸钠、硫酸钠、氯化钠、氢氧化钠中的一种或几种。小科同学为探究其成分做了以下实验:
Ⅰ.取少量固体样品于烧杯中,先加足量的水溶解,再加入足量的BaCl2溶液,有白色沉淀产生;
Ⅱ.继续向烧杯中滴加稀盐酸并不断搅拌,烧杯内固体质量随加入稀盐酸质量的变化如图T6-16所示。
/
图T6-16
请回答下列问题:
(1)AB段观察到的现象是 。?
(2)C点时,溶液中一定含有的溶质是 。?
参考答案
◆分类突破
例1 B
针对训练
1.C 2.B 3.D
例2 B 例3 D
针对训练
1.D 2.D 3.B 4.C
例4 D
针对训练
1.B 2.C 3.C 4.AB
5.(1)白色沉淀部分溶解并有气泡产生
(2)NaCl、BaCl2、HCl
