酸碱盐知识复习(24张PPT)
图片预览




文档简介
课件24张PPT。酸碱盐知识复习除铁锈中和发酵时的酸应用广泛的酸碱盐湿法炼铜治疗胃酸过多硫酸铜+
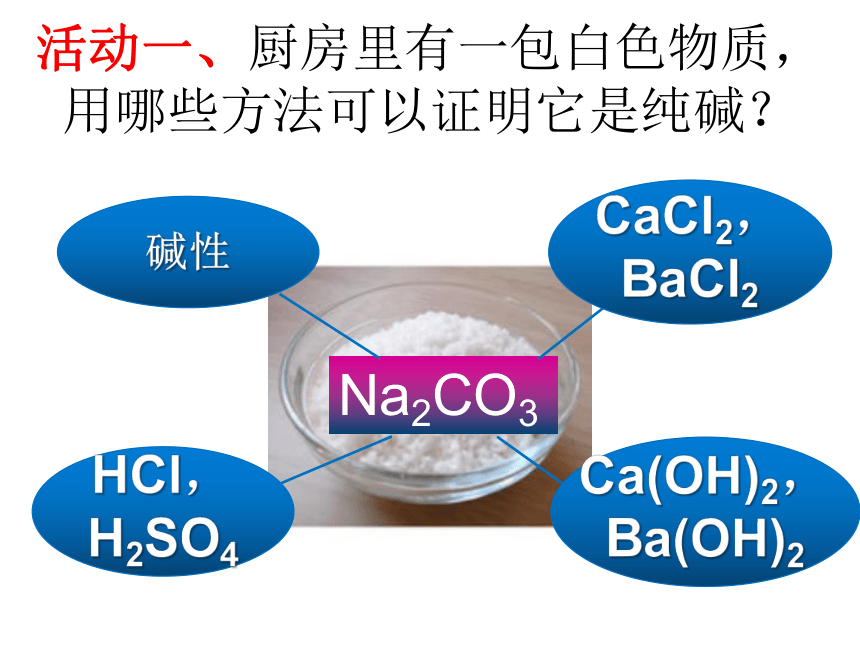
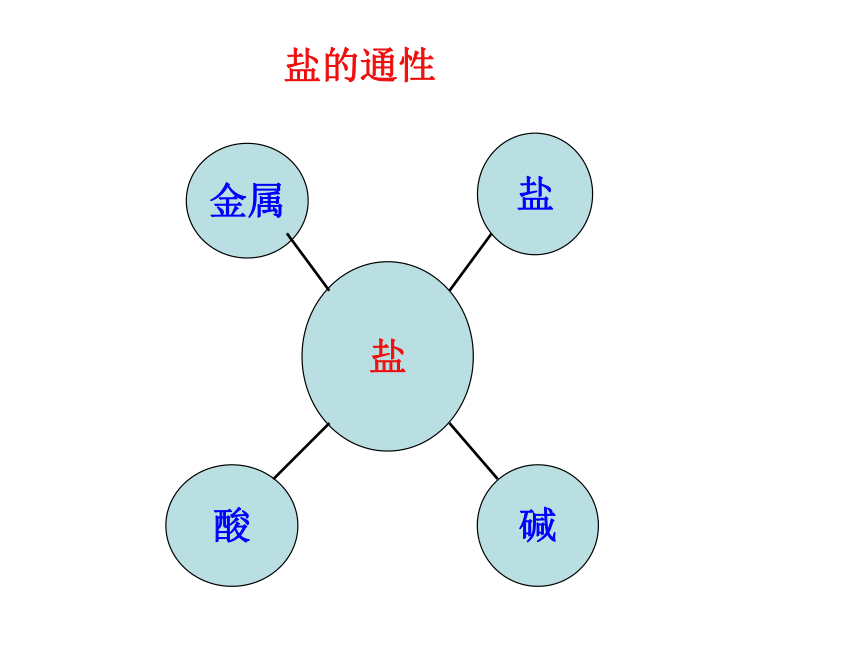
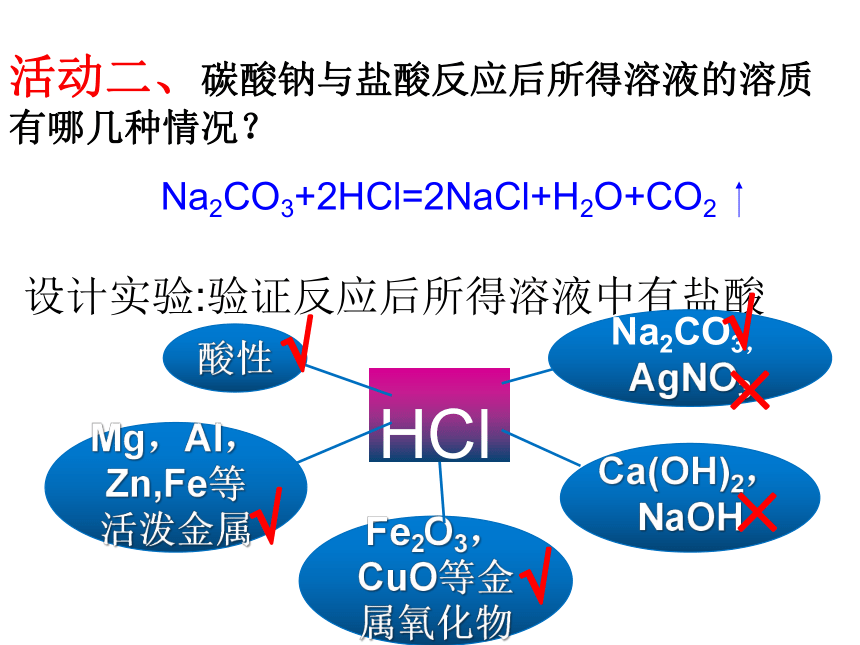
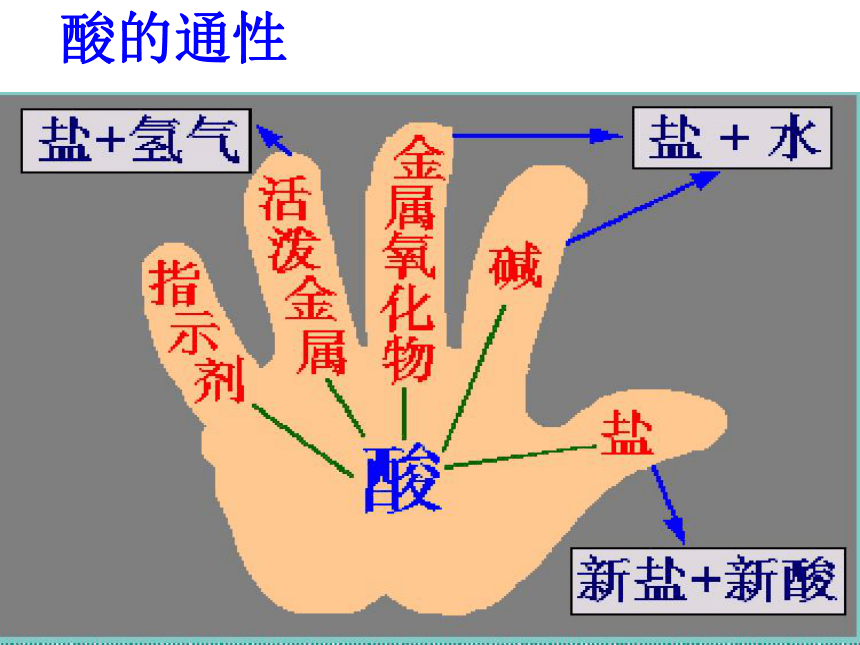
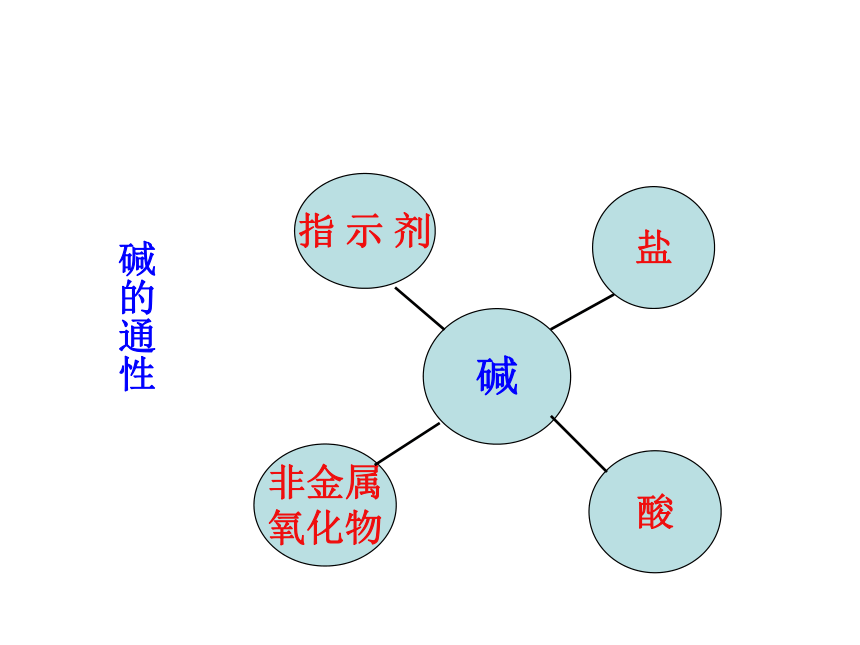
氢氧化钙金属和酸制氢气铁+硫酸铜纯碱一、性质总结活动一、厨房里有一包白色物质,用哪些方法可以证明它是纯碱?Na2CO3盐酸金属碱盐盐的通性设计实验:用两种不同方法,鉴别纯碱和食盐AgNO3×活动二、碳酸钠与盐酸反应后所得溶液的溶质有哪几种情况?设计实验:验证反应后所得溶液中有盐酸HCl酸的通性碱的通性活动三、阅读《升学指导》32-33页内容,寻找物质之间的反应关系,形成网络图酸碱指示剂
盐+水盐+水盐+水金属+盐新盐酸+盐 盐
+
碱氧气++
CO 盐
+
H2二、规律探究活动一、阅读《升学指导》32-33页内容,
1、观察化学方程式,说出基本反应类型
2、思考物质之间的反应遵循哪些规律?
酸碱盐之间:____________
金属:______________酸碱指示剂
盐+水盐+水盐+水金属+盐新盐酸+盐 盐
+
碱氧气++
CO金属
活动性
顺序复分解
反应
条件 盐
+
H21. 下列各组物质的溶液混合后,不能发生反应的是( )
A. NaCl和H2SO4 B.NaOH和HCl
C.Na2CO3和H2SO4 D.AgNO3和NaCl
2. 下列各组中的物质依次加入水中并不断搅拌,无现象发生的是( )
A.CuSO4、Na2CO3、H2SO4
B.NaOH、Ba(NO3)2、HCl
C.MgSO4、NaCl、Ca(OH)2
D.BaCl2、KNO3、AgNO3 AB三、微观探秘复分解反应是我们学过的化学基本反应类型之一。学习时,应注意将知识进行归纳、总结,深刻理解复分解反应发生的条件,形成完整的知识体系。
(1)写出下列反应的化学方程式。
①氯化钡溶液与硫酸钠溶液混合:___________
②碳酸钾溶液与稀盐酸混合: ______________
③氯化钠溶液与硝酸银混合:______________
④ 氯化铵固体与熟石灰混合:_______________
(2)你想过上述复分解反应为什么能发生吗?这是因为在这些反应物中含有一些“特殊”的阴、阳离子,它们能相互结合。例如上述反应①中,实际参加反应的离子是Ba2+和SO42-,而Na+、Cl-则是“旁观者”,并没有参加反应。请你分析上述反应②中实际参加反应的离子是 ;上述反应③中实际参加反应的离子是 ;上述反应④中实际参加反应的离子是__________;
(3)请根据你的想象,在下图右边的容器中画出体现NaOH溶液和稀HCl反应产物的示意图。特殊离子检验
1. 今有一瓶无色溶液,要证明它是盐酸,有以下操作,其中正确的是( )。
A.加入AgNO3溶液和几滴稀硝酸
B.加入紫色的石蕊试液
C.加入BaCl2溶液和几滴稀硝酸
D.先加入紫色的石蕊试液,再另取溶液加入AgNO3溶液和几滴稀硝酸
D阳
离
子H+Cu2+ 蓝色溶液
浅绿色溶液
黄色溶液Fe2+ Fe3+ NH4+NaOH溶液湿润红色石蕊试纸 红色石蕊试纸变蓝常见阳离子的检验方法知识储备Cl- SO42- CO32- 阴
离
子OH-常见阴离子的检验方法
生成个红褐色沉淀沉淀溶解,生成黄色溶液生成白色沉淀HCl 重视对工业废水的检测,确保其达标排放,是保护水资源的重要措施。小梅所在的化学兴趣小组的同学在一工厂废水出口处取样对所含物质进行检测,预测其中可能含有NaOH、CuSO4、MgCl2、Na2CO3、NaCl中的一种或几种。请完成实验报告:
学以致用HNO3酚酞试液变红CuSO4AgNO3NaOHMgCl2×××√规律总结某不纯的碳酸钠固体样品,含有的杂质可能是硫酸钠、碳酸钙、硫酸铜、氯化钠、氯化钙中的一种或几种。为确定其杂质的成分,进行如下实验:①取该样品溶于水,得无色溶液。②向适量上述溶液中,滴加过量的氯化钡溶液,出现白色沉淀,过滤。③向步骤②所得沉淀中加入过量的稀硝酸,沉淀部分消失并产生气泡。④取步骤②的滤液,加入稀硝酸、硝酸银溶液,出现白色沉淀。下列分析中,正确的是( )
A.不能确定杂质是否含有氯化钠和氯化钙
B. 杂质一定只含有硫酸钠
C.若步骤②改为滴加硝酸钡溶液,则通过步骤④可以确定杂质是否含有氯化钠
D.若步骤②改为滴加氯化钡溶液至恰好完全反应,通过准确测定各步骤中沉淀的质量,可定量分析出杂质是否含有氯化钠
√CD宏观表征微观表征符号表征结构决定性质;性质决定用途微粒观守恒观变化观定性探究定量计算
氢氧化钙金属和酸制氢气铁+硫酸铜纯碱一、性质总结活动一、厨房里有一包白色物质,用哪些方法可以证明它是纯碱?Na2CO3盐酸金属碱盐盐的通性设计实验:用两种不同方法,鉴别纯碱和食盐AgNO3×活动二、碳酸钠与盐酸反应后所得溶液的溶质有哪几种情况?设计实验:验证反应后所得溶液中有盐酸HCl酸的通性碱的通性活动三、阅读《升学指导》32-33页内容,寻找物质之间的反应关系,形成网络图酸碱指示剂
盐+水盐+水盐+水金属+盐新盐酸+盐 盐
+
碱氧气++
CO 盐
+
H2二、规律探究活动一、阅读《升学指导》32-33页内容,
1、观察化学方程式,说出基本反应类型
2、思考物质之间的反应遵循哪些规律?
酸碱盐之间:____________
金属:______________酸碱指示剂
盐+水盐+水盐+水金属+盐新盐酸+盐 盐
+
碱氧气++
CO金属
活动性
顺序复分解
反应
条件 盐
+
H21. 下列各组物质的溶液混合后,不能发生反应的是( )
A. NaCl和H2SO4 B.NaOH和HCl
C.Na2CO3和H2SO4 D.AgNO3和NaCl
2. 下列各组中的物质依次加入水中并不断搅拌,无现象发生的是( )
A.CuSO4、Na2CO3、H2SO4
B.NaOH、Ba(NO3)2、HCl
C.MgSO4、NaCl、Ca(OH)2
D.BaCl2、KNO3、AgNO3 AB三、微观探秘复分解反应是我们学过的化学基本反应类型之一。学习时,应注意将知识进行归纳、总结,深刻理解复分解反应发生的条件,形成完整的知识体系。
(1)写出下列反应的化学方程式。
①氯化钡溶液与硫酸钠溶液混合:___________
②碳酸钾溶液与稀盐酸混合: ______________
③氯化钠溶液与硝酸银混合:______________
④ 氯化铵固体与熟石灰混合:_______________
(2)你想过上述复分解反应为什么能发生吗?这是因为在这些反应物中含有一些“特殊”的阴、阳离子,它们能相互结合。例如上述反应①中,实际参加反应的离子是Ba2+和SO42-,而Na+、Cl-则是“旁观者”,并没有参加反应。请你分析上述反应②中实际参加反应的离子是 ;上述反应③中实际参加反应的离子是 ;上述反应④中实际参加反应的离子是__________;
(3)请根据你的想象,在下图右边的容器中画出体现NaOH溶液和稀HCl反应产物的示意图。特殊离子检验
1. 今有一瓶无色溶液,要证明它是盐酸,有以下操作,其中正确的是( )。
A.加入AgNO3溶液和几滴稀硝酸
B.加入紫色的石蕊试液
C.加入BaCl2溶液和几滴稀硝酸
D.先加入紫色的石蕊试液,再另取溶液加入AgNO3溶液和几滴稀硝酸
D阳
离
子H+Cu2+ 蓝色溶液
浅绿色溶液
黄色溶液Fe2+ Fe3+ NH4+NaOH溶液湿润红色石蕊试纸 红色石蕊试纸变蓝常见阳离子的检验方法知识储备Cl- SO42- CO32- 阴
离
子OH-常见阴离子的检验方法
生成个红褐色沉淀沉淀溶解,生成黄色溶液生成白色沉淀HCl 重视对工业废水的检测,确保其达标排放,是保护水资源的重要措施。小梅所在的化学兴趣小组的同学在一工厂废水出口处取样对所含物质进行检测,预测其中可能含有NaOH、CuSO4、MgCl2、Na2CO3、NaCl中的一种或几种。请完成实验报告:
学以致用HNO3酚酞试液变红CuSO4AgNO3NaOHMgCl2×××√规律总结某不纯的碳酸钠固体样品,含有的杂质可能是硫酸钠、碳酸钙、硫酸铜、氯化钠、氯化钙中的一种或几种。为确定其杂质的成分,进行如下实验:①取该样品溶于水,得无色溶液。②向适量上述溶液中,滴加过量的氯化钡溶液,出现白色沉淀,过滤。③向步骤②所得沉淀中加入过量的稀硝酸,沉淀部分消失并产生气泡。④取步骤②的滤液,加入稀硝酸、硝酸银溶液,出现白色沉淀。下列分析中,正确的是( )
A.不能确定杂质是否含有氯化钠和氯化钙
B. 杂质一定只含有硫酸钠
C.若步骤②改为滴加硝酸钡溶液,则通过步骤④可以确定杂质是否含有氯化钠
D.若步骤②改为滴加氯化钡溶液至恰好完全反应,通过准确测定各步骤中沉淀的质量,可定量分析出杂质是否含有氯化钠
√CD宏观表征微观表征符号表征结构决定性质;性质决定用途微粒观守恒观变化观定性探究定量计算
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
