人教版高中化学必修二 1.3 化学键 课件
文档属性
| 名称 | 人教版高中化学必修二 1.3 化学键 课件 |  | |
| 格式 | zip | ||
| 文件大小 | 327.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-03 15:38:54 | ||
图片预览







文档简介
课件27张PPT。 第四节 化学键(第二课时)复习上节内容:离子键:阴阳离子间的静电作用,
( 一般是由活泼金属与非金属形成)思考是否元素原子间只能以离子键结合?
试举例说明。 H2 Cl2 O2 N2 HCl
H2O NH3 CO2属于
非金属元素的单质或化合物它们内部原子又是怎样结合的呢? 以氢气和氯气反应
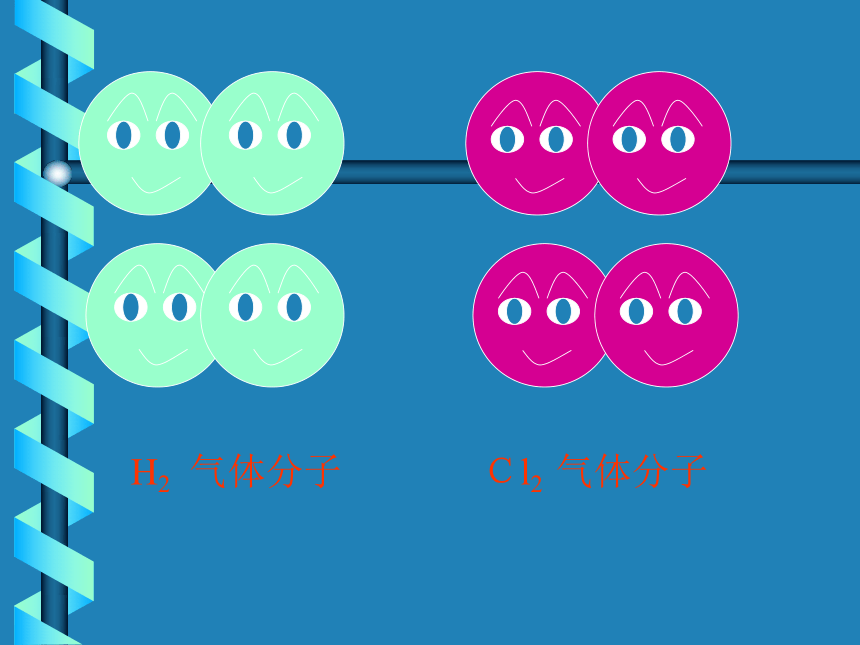
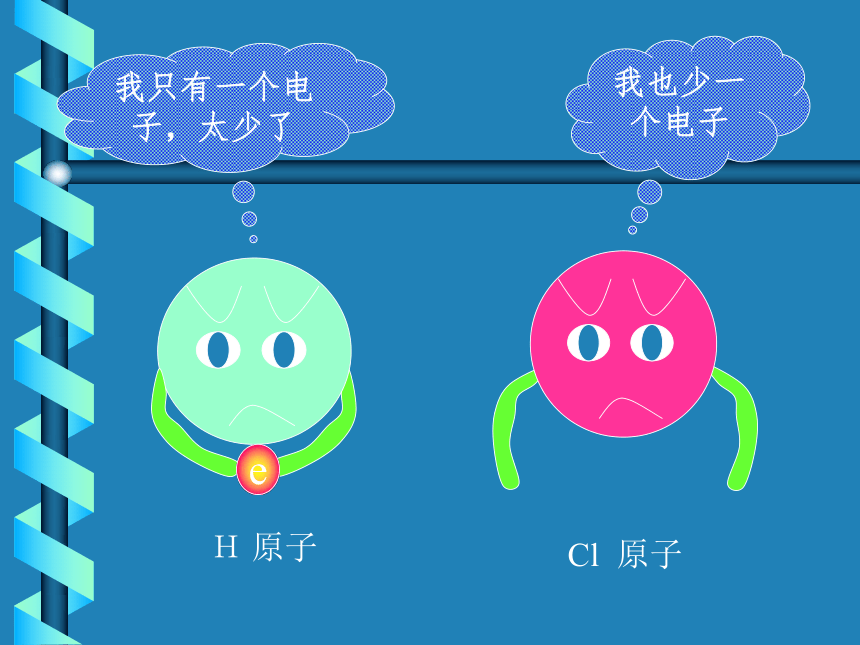
生成氯化氢为例实验为什么呢?一.共价键Cl2 气体分子H2 气体分子分开后,她们为什么不高兴?让我们听听她们说些什么?我只有一个电子,太少了我也少一个电子eH 原子Cl 原子二位好!我有一个好办法.你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有.行吗?愿意愿意H原子,你愿意拿出一个电子共用吗?Cl原子,你愿意拿出一个电子共用吗?我给你们点燃之后,你们要结合在一起,为人类做出自己的贡献.H2+Cl2===2HCl点燃第四节 化学键 (第二课时)化学键离子键
共价键
金属键共价键分析 H2HCl共价键 原子之间通过共用电子对所形成的相互作用,叫做共价键。成键微粒:成键实质:成键条件:注
意原子之间原子共用电子对非金属元素间电子式表示形成过程
H ·· H+→H ·+→ 氯化氢分子的形成: 氢分子的形成: 成键微粒:原子练习用电子式表示下列微粒O2
N2
H2O
NH3
CO2O=OO=C=OH O H结构式如: H2的结构式 H-H
HCl的结构式 H-Cl(不能表示离子化合物)用短杠(-)代替共价分子中的共用电子对所得的式子思考HCl中,为什么H显+1价 ,
为什么Cl显-1价?共用电子对偏向对其吸引力更强的一方共用电子对偏向一方原子
的共价键称为极性键+1 -1+1 -1思考: H2中共用电子对又如何?共用电子对因受到的吸引力大小相等
而居于两原子的正中央,(不偏移)共用电子对不偏向一方原子
的共价键称为非极性键正中央对比巧记为:同非请分析: Na2O2 NaOH 中所含共价键的极性随堂练习 过氧化钠晶体中,过氧根离子
(O2 ) 2-与钠离子以离子键结合;在
过氧根离子中,两个氧原子以共价
键结合。请用电子式表示过氧化钠。随堂练习 氢氧化钠晶体中,钠离子与
氢氧根离子以离子键结合;在氢
氧根离子中,氢与氧以共价键结
合。请用电子式表示氢氧化钠。 [ ] 练习:关于化学键的叙述正确的是 ( )
A 离子化合物可能含有共价键
B 共价化合物可能含有离子键
C 离子化合物中只含有离子键
D 共价化合物中不含有离子键离子化合物: 由阴、阳离
子相互作用而构成的化合物共价化合物: 以共用
电子对形成分子的化合物 (全部)AC离子键和共价键的比较化学键离子键
共价键
金属键
极性键
非极性键 原子之间通过共用电子对所
形成的相互作用,叫做共价键。讨论:用化学键的观点来分析化 学反应的本质是什么? 一个化学反应的
过程,本质上就是旧
化学键断裂和新化学
键形成的过程
A CaCl2 和 Na2S
B Na2O2 和Na2O
C CO2和CS2
D HCl和NaOH下列各组化合物中,
化学键类型都相同的是
( 一般是由活泼金属与非金属形成)思考是否元素原子间只能以离子键结合?
试举例说明。 H2 Cl2 O2 N2 HCl
H2O NH3 CO2属于
非金属元素的单质或化合物它们内部原子又是怎样结合的呢? 以氢气和氯气反应
生成氯化氢为例实验为什么呢?一.共价键Cl2 气体分子H2 气体分子分开后,她们为什么不高兴?让我们听听她们说些什么?我只有一个电子,太少了我也少一个电子eH 原子Cl 原子二位好!我有一个好办法.你们每人拿出一个电子共用,就象共同分享快乐一样共同拥有.行吗?愿意愿意H原子,你愿意拿出一个电子共用吗?Cl原子,你愿意拿出一个电子共用吗?我给你们点燃之后,你们要结合在一起,为人类做出自己的贡献.H2+Cl2===2HCl点燃第四节 化学键 (第二课时)化学键离子键
共价键
金属键共价键分析 H2HCl共价键 原子之间通过共用电子对所形成的相互作用,叫做共价键。成键微粒:成键实质:成键条件:注
意原子之间原子共用电子对非金属元素间电子式表示形成过程
H ·· H+→H ·+→ 氯化氢分子的形成: 氢分子的形成: 成键微粒:原子练习用电子式表示下列微粒O2
N2
H2O
NH3
CO2O=OO=C=OH O H结构式如: H2的结构式 H-H
HCl的结构式 H-Cl(不能表示离子化合物)用短杠(-)代替共价分子中的共用电子对所得的式子思考HCl中,为什么H显+1价 ,
为什么Cl显-1价?共用电子对偏向对其吸引力更强的一方共用电子对偏向一方原子
的共价键称为极性键+1 -1+1 -1思考: H2中共用电子对又如何?共用电子对因受到的吸引力大小相等
而居于两原子的正中央,(不偏移)共用电子对不偏向一方原子
的共价键称为非极性键正中央对比巧记为:同非请分析: Na2O2 NaOH 中所含共价键的极性随堂练习 过氧化钠晶体中,过氧根离子
(O2 ) 2-与钠离子以离子键结合;在
过氧根离子中,两个氧原子以共价
键结合。请用电子式表示过氧化钠。随堂练习 氢氧化钠晶体中,钠离子与
氢氧根离子以离子键结合;在氢
氧根离子中,氢与氧以共价键结
合。请用电子式表示氢氧化钠。 [ ] 练习:关于化学键的叙述正确的是 ( )
A 离子化合物可能含有共价键
B 共价化合物可能含有离子键
C 离子化合物中只含有离子键
D 共价化合物中不含有离子键离子化合物: 由阴、阳离
子相互作用而构成的化合物共价化合物: 以共用
电子对形成分子的化合物 (全部)AC离子键和共价键的比较化学键离子键
共价键
金属键
极性键
非极性键 原子之间通过共用电子对所
形成的相互作用,叫做共价键。讨论:用化学键的观点来分析化 学反应的本质是什么? 一个化学反应的
过程,本质上就是旧
化学键断裂和新化学
键形成的过程
A CaCl2 和 Na2S
B Na2O2 和Na2O
C CO2和CS2
D HCl和NaOH下列各组化合物中,
化学键类型都相同的是
