人教版高中化学必修二:1.2.1 原子核外电子的排布 课件
文档属性
| 名称 | 人教版高中化学必修二:1.2.1 原子核外电子的排布 课件 |  | |
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-03 15:26:27 | ||
图片预览



文档简介
课件17张PPT。第一章 物质结构 元素周期律第二节 元素周期律第1课时 原子核外电子的排布(1) 按照原子量大小排列起来的元素,在性质上呈
现明显的周期性变化。 门捷列夫的周期律(2) 化学性质相似的元素,或者是原子量相近或者
是依次递增相同的数量(3) 各族元素的原子价(化合价)一致。
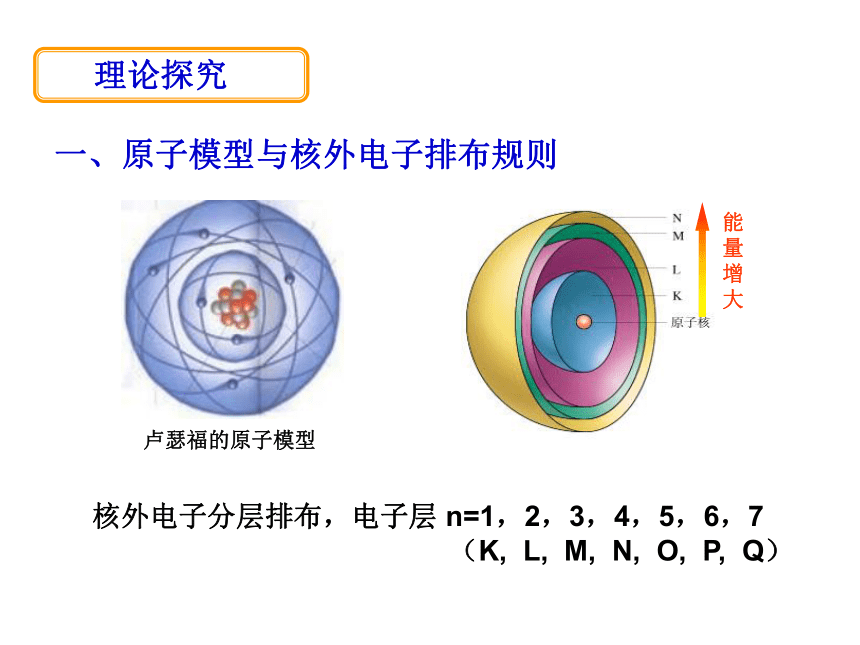
……——《元素性质和原子量的关系》 核外电子分层排布,电子层 n=1,2,3,4,5,6,7
(K, L, M, N, O, P, Q)能
量
增
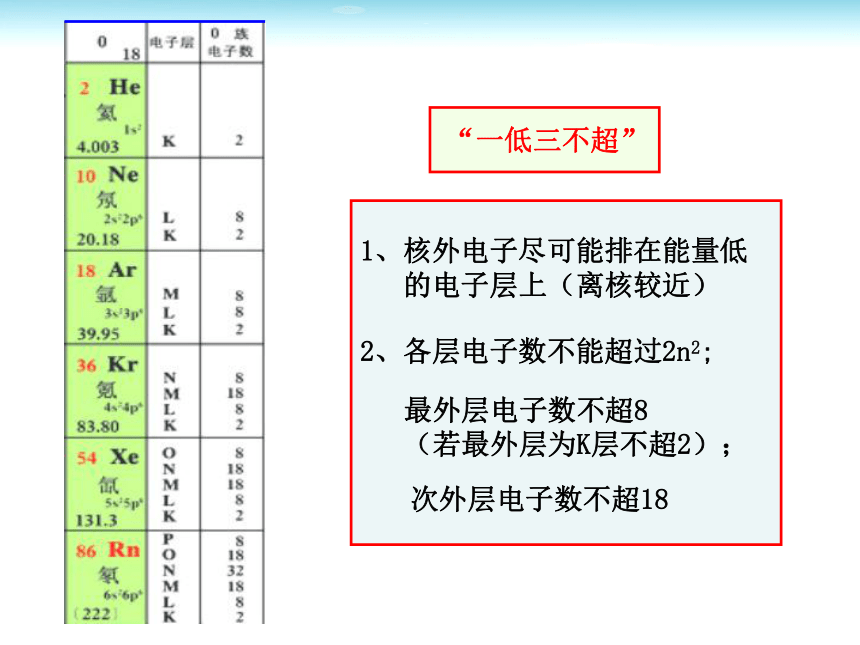
大一、原子模型与核外电子排布规则卢瑟福的原子模型 理论探究 “一低三不超”1、核外电子尽可能排在能量低
的电子层上(离核较近) 2、各层电子数不能超过2n2;最外层电子数不超8
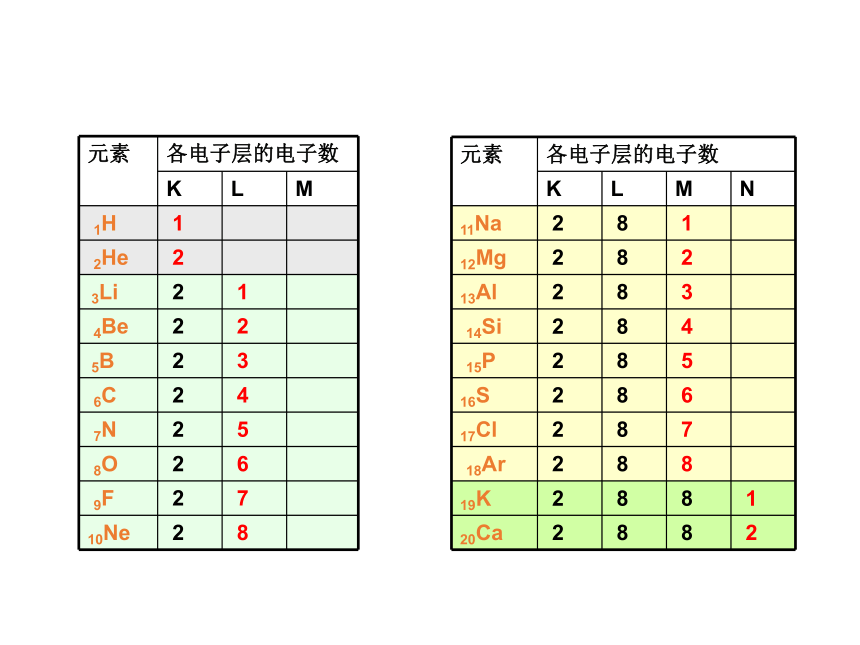
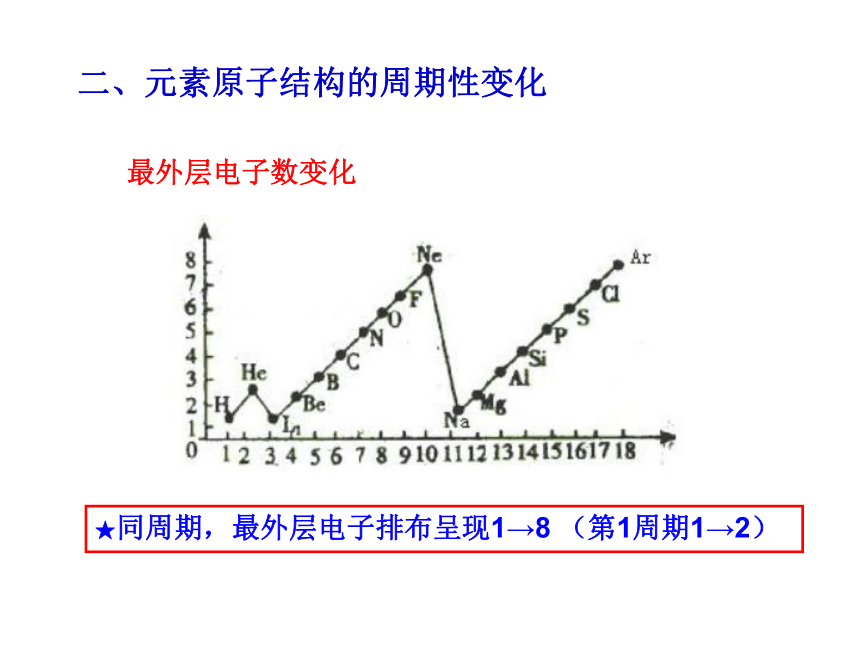
(若最外层为K层不超2);次外层电子数不超18★同周期,最外层电子排布呈现1→8 (第1周期1→2)最外层电子数变化二、元素原子结构的周期性变化★同周期,从左到右,原子半径逐渐减小。
★氢原子最小,零族原子不比较。原子半径的变化★同周期,元素最高正价+1→+7;最低负价-4→-1
最高正价+∣最低负价∣=8
★金属不显负价;O、F不显正价第2周期第3周期元素最高正价、最低负价的变化21→831→8大→小+1 → +7
-4→-1→0随着原子序数的递增,元素原子的电子排布、原子半径和化合价都呈现周期性的变化.2、下列说法中正确的是( )
A.锂的原子结构示意图是 。
B.原子核外电子离核越近,能量越高。
C.某原子L层为K层的3倍,该原子为O。
D.某原子M层电子数为L层电子数的4倍。3、(双选)下列叙述正确的是( )
A. 在所有元素中氢原子半径最小。
B. Na、Mg、Al 原子半径依次增大。
C. P、S、Cl 最高正价依次升高。
D.Na→Cl最高正价由+1→+7;最低负价由-7→-1。 应用巩固CAC 实验探究【实验】(1/3组)
放少许镁带于试管中,加2 mL水,滴入2滴酚酞试液,
观察现象;过一会加热至沸腾,再观察现象。1、钠、镁、铝与水的反应2、镁、铝与盐酸的反应【实验】(2/4组)
取一片铝片和镁带,擦去氧化膜,分别和2 mL(2 mol/L)
盐酸反应。三、元素性质的周期性变化现象:镁与铝均能与盐酸反应产生气泡。但镁反应更剧烈。
Mg + 2HCl === MgCl2 + H2↑
2Al + 6HCl === 2AlCl3+ 3H2↑现象:镁与冷水反应缓慢,与沸水反应较剧烈,产生较多气泡,溶液变为红色。 1、钠、镁、铝与水的反应2、镁、铝与盐酸的反应金属性强弱的比较冷水、剧烈冷水、缓慢剧烈迅速NaOH
强碱性Mg(OH)2
中强碱Al(OH)3
两性氢氧化物金属性:Na > Mg > Al剧烈不反应非金属性强弱的比较SiPSCl高温H2SiO3
弱酸磷蒸气与氢气能反应H3PO4
中强酸需加热H2SO4
强酸光照或点燃HClO4
最强酸非金属性:Si < P < S < Cl根据实验,可得出第3周期元素金属性、非金属性的递变规律:Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强元素的性质随着原子序数的递增而呈周期性的变化元素周期律的实质:
元素性质的周期性变化是由原子核外电子排布呈周期性变化决定的 规律小结④元素性质的周期性变化③元素化合价
的周期性变化②原子半径
的周期性变化 ①核外电子排布的周期性变化短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中A所处的周期序数与族序数相等。
下列判断不正确的是( )
A.原子半径:A>B>C
B.非金属性:BC.元素最高正价:C>D
D.A、D的最高价氧化物的水化物可以相互反应
应用巩固c
现明显的周期性变化。 门捷列夫的周期律(2) 化学性质相似的元素,或者是原子量相近或者
是依次递增相同的数量(3) 各族元素的原子价(化合价)一致。
……——《元素性质和原子量的关系》 核外电子分层排布,电子层 n=1,2,3,4,5,6,7
(K, L, M, N, O, P, Q)能
量
增
大一、原子模型与核外电子排布规则卢瑟福的原子模型 理论探究 “一低三不超”1、核外电子尽可能排在能量低
的电子层上(离核较近) 2、各层电子数不能超过2n2;最外层电子数不超8
(若最外层为K层不超2);次外层电子数不超18★同周期,最外层电子排布呈现1→8 (第1周期1→2)最外层电子数变化二、元素原子结构的周期性变化★同周期,从左到右,原子半径逐渐减小。
★氢原子最小,零族原子不比较。原子半径的变化★同周期,元素最高正价+1→+7;最低负价-4→-1
最高正价+∣最低负价∣=8
★金属不显负价;O、F不显正价第2周期第3周期元素最高正价、最低负价的变化21→831→8大→小+1 → +7
-4→-1→0随着原子序数的递增,元素原子的电子排布、原子半径和化合价都呈现周期性的变化.2、下列说法中正确的是( )
A.锂的原子结构示意图是 。
B.原子核外电子离核越近,能量越高。
C.某原子L层为K层的3倍,该原子为O。
D.某原子M层电子数为L层电子数的4倍。3、(双选)下列叙述正确的是( )
A. 在所有元素中氢原子半径最小。
B. Na、Mg、Al 原子半径依次增大。
C. P、S、Cl 最高正价依次升高。
D.Na→Cl最高正价由+1→+7;最低负价由-7→-1。 应用巩固CAC 实验探究【实验】(1/3组)
放少许镁带于试管中,加2 mL水,滴入2滴酚酞试液,
观察现象;过一会加热至沸腾,再观察现象。1、钠、镁、铝与水的反应2、镁、铝与盐酸的反应【实验】(2/4组)
取一片铝片和镁带,擦去氧化膜,分别和2 mL(2 mol/L)
盐酸反应。三、元素性质的周期性变化现象:镁与铝均能与盐酸反应产生气泡。但镁反应更剧烈。
Mg + 2HCl === MgCl2 + H2↑
2Al + 6HCl === 2AlCl3+ 3H2↑现象:镁与冷水反应缓慢,与沸水反应较剧烈,产生较多气泡,溶液变为红色。 1、钠、镁、铝与水的反应2、镁、铝与盐酸的反应金属性强弱的比较冷水、剧烈冷水、缓慢剧烈迅速NaOH
强碱性Mg(OH)2
中强碱Al(OH)3
两性氢氧化物金属性:Na > Mg > Al剧烈不反应非金属性强弱的比较SiPSCl高温H2SiO3
弱酸磷蒸气与氢气能反应H3PO4
中强酸需加热H2SO4
强酸光照或点燃HClO4
最强酸非金属性:Si < P < S < Cl根据实验,可得出第3周期元素金属性、非金属性的递变规律:Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强元素的性质随着原子序数的递增而呈周期性的变化元素周期律的实质:
元素性质的周期性变化是由原子核外电子排布呈周期性变化决定的 规律小结④元素性质的周期性变化③元素化合价
的周期性变化②原子半径
的周期性变化 ①核外电子排布的周期性变化短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中A所处的周期序数与族序数相等。
下列判断不正确的是( )
A.原子半径:A>B>C
B.非金属性:B
D.A、D的最高价氧化物的水化物可以相互反应
应用巩固c
