人教版高中化学必修二:1.2.2元素周期律 课件
文档属性
| 名称 | 人教版高中化学必修二:1.2.2元素周期律 课件 |  | |
| 格式 | zip | ||
| 文件大小 | 954.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-03 15:28:16 | ||
图片预览




文档简介
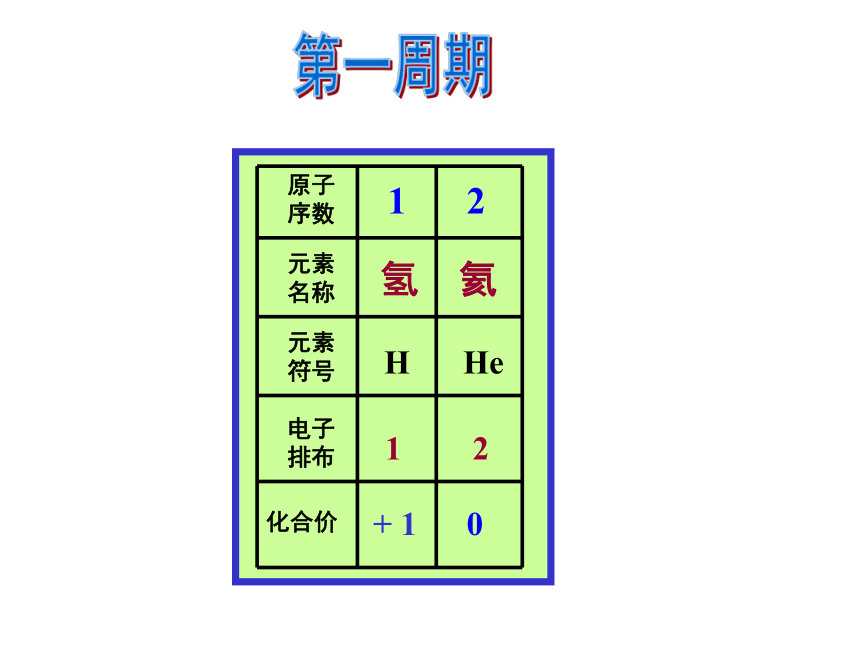
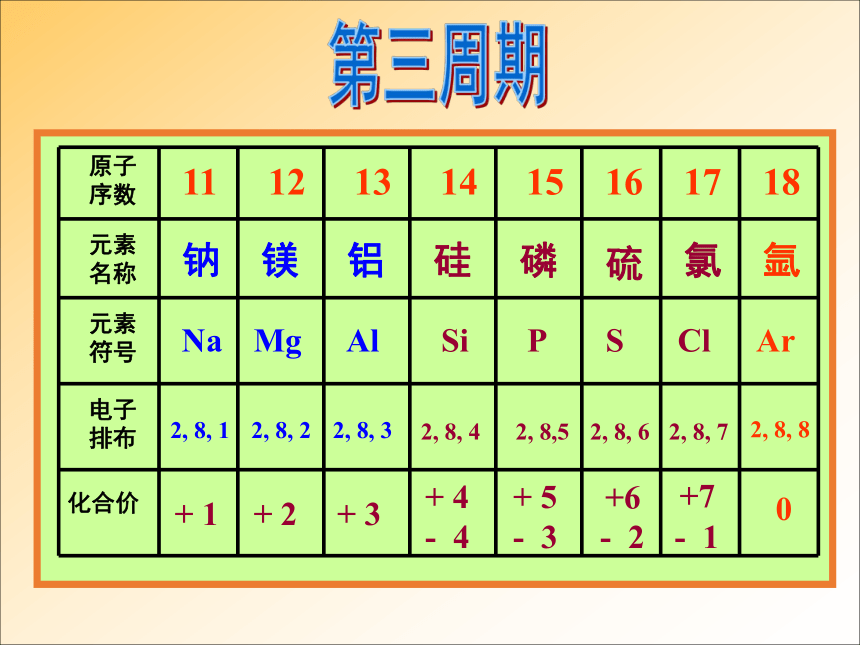
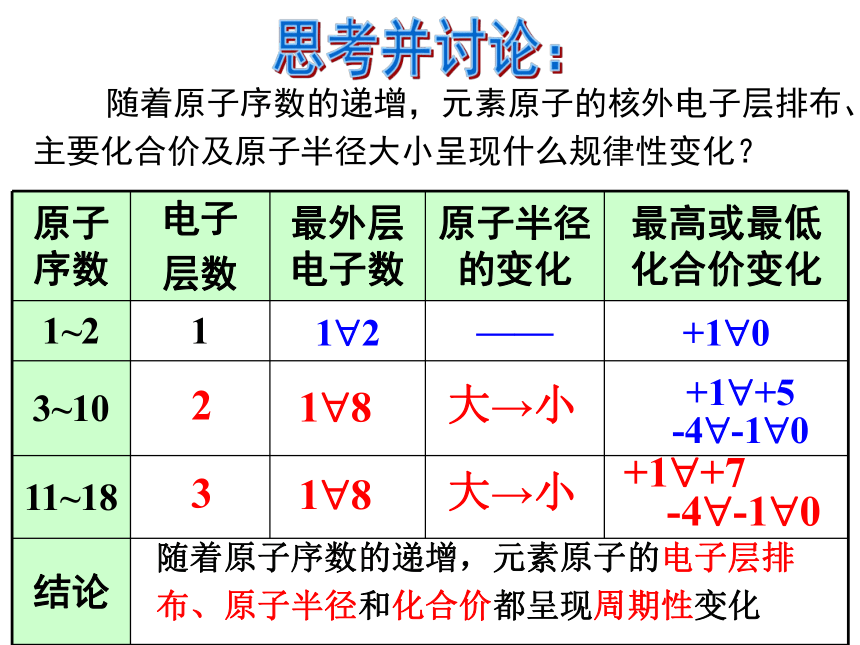
课件22张PPT。第一章 物质结构 元素周期律第二节 元素周期律第2课时 元素周期律二、元素周期律完成教材P14—15 “科学探究”有关问题。+ 1 0 HHe 1 2第一周期2,12,22,32,42,52,62,72,8第二周期2, 8, 12, 8, 22, 8, 32, 8, 42, 8,52, 8, 62, 8, 72, 8, 8第三周期思考并讨论: 随着原子序数的递增,元素原子的核外电子层排布、主要化合价及原子半径大小呈现什么规律性变化?231?81?8+1?+7
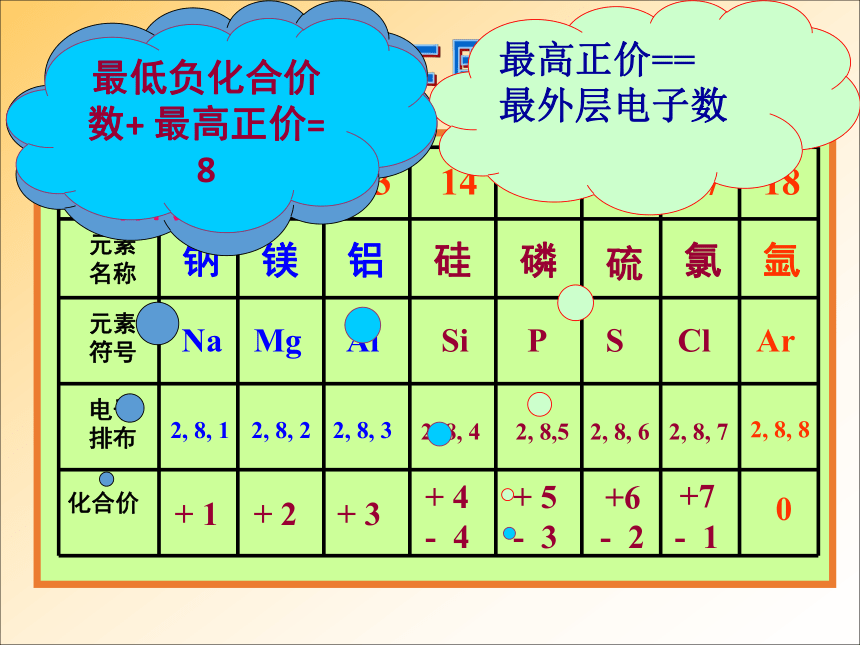
-4?-1?0随着原子序数的递增,元素原子的电子层排布、原子半径和化合价都呈现周期性变化大→小大→小元素周期表中原子半径的变化规律2, 8, 12, 8, 22, 8, 32, 8, 42, 8,52, 8, 62, 8, 72, 8, 8第三周期主族元素的最高正化合价与最外层电子数有何关系?最高正价==
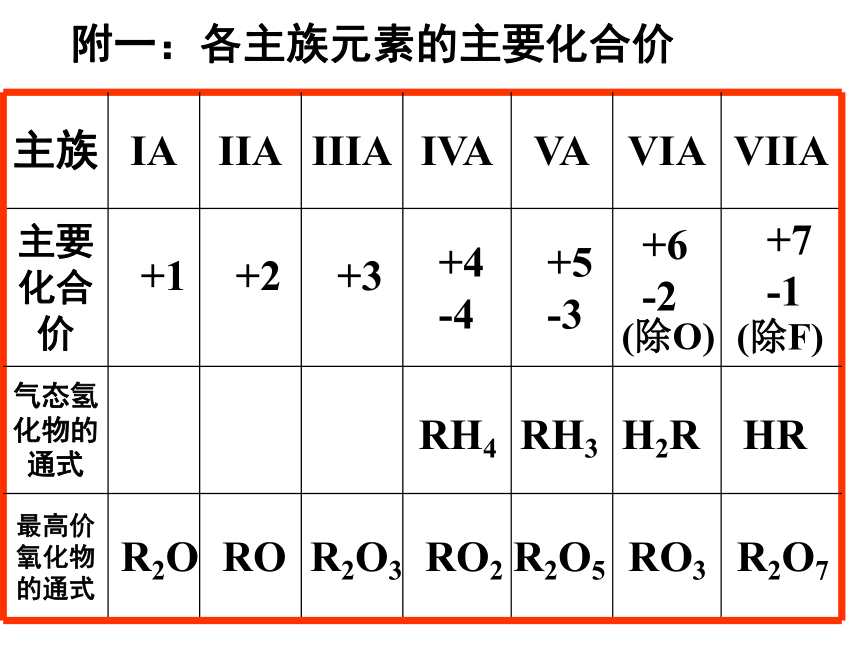
最外层电子数最低负化合价数+ 最高正价= 8附一:各主族元素的主要化合价+1+2+3+4
-4+5
-3+6
-2+7
-1RH4RH3H2RHRR2OROR2O3RO2R2O5RO3R2O7(除O)(除F)1、一般而言,电子层数越多,半径越大;2、当电子层数相同时,质子数越大,半径越小;3、同种元素的不同粒子,电子越多,半径越大。附二:粒子半径大小比较一般规律如:同主族从上到下原子半径逐渐增大。如:同周期从左到右原子半径逐渐减小。如: Na Na+ Cl— Cl Fe 2+ Fe3+ >>>随堂练习1、下列说法中,不正确的是( )
A、在含有多个电子的原子里,电子是分层排布的;
B、在原子核外的各电子层中,能量高的离核近,能量低的离核远;
C、在原子核外的各电子层中,层数大的能量高,层数小的能量低;
D、在原子核外的各电子层中,层数大的离核远,层数小的离核近。B2、某元素原子最外层电子数为次外层电子数的3倍,该元素原子核内质子数为( )
A、13 B、7 C、8 D、10 C随堂练习3、下列元素的原子半径依次减小的是( )
A、Na、Mg、Al B、 F 、O、 N
C、O2- 、 F- 、Na+ D、C 、P 、 SiAC4、某原子共有5个电子层,则其O层最多容纳电子 个,N层最多容纳电子 个。 818 元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢?疑问元素金属性强弱判断依据 1.根据金属单质与水或酸反应置换出氢的难易程度。置换出氢越容易,则金属性越强。
2.根据金属元素最高价氧化物对应的水化物碱性强弱。碱性越强,则金属元素的金属性越强。
3.根据对应阳离子氧化性强弱判断。金属阳离子氧化性越弱,则元素金属性越强。元素非金属性强弱判断依据:1.根据非金属单质与H2化合生成氢化物的难易或氢化物的稳定性程度。越容易与H2化合,则生成的氢化物越稳定,非金属性越强。
2.根据非金属元素最高价氧化物对应的水化物酸性强弱。酸性越强,则元素的非金属性越强。
3. 根据对应阴离子还原性强弱判断。阴离子还原性越弱,则元素非金属性越强。科学探究现象化学方程式 镁与冷水反应缓慢,滴入酚酞试液浅红色。而镁与沸水反应加快,产生气泡,溶液红色加深。镁的金属性比钠弱结论与金属钠对比 镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。镁的金属性比铝强科学探究现象化学方程式 结论列表总结:强碱
两性
氢氧化物剧烈 迅速 非金属性:Si < P < S < Cl科学事实 非金属性:Si < P < S < Cl科学事实NaOH
强碱Mg(OH)2
中强碱H2SiO3
弱酸H3PO4
中强酸H2SO4
强酸HClO4
最强酸
稀有气体元素金属性逐渐减弱,非金属性逐渐增强本节总结: 根据实验,可得出第三周期元素金属性、非金属性的递变规律: Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强 对其他周期元素性质进行研究,也可以得到类似的结论。元素周期律 元素的性质随着原子序数的递增而呈周期性的变化的规律。
-4?-1?0随着原子序数的递增,元素原子的电子层排布、原子半径和化合价都呈现周期性变化大→小大→小元素周期表中原子半径的变化规律2, 8, 12, 8, 22, 8, 32, 8, 42, 8,52, 8, 62, 8, 72, 8, 8第三周期主族元素的最高正化合价与最外层电子数有何关系?最高正价==
最外层电子数最低负化合价数+ 最高正价= 8附一:各主族元素的主要化合价+1+2+3+4
-4+5
-3+6
-2+7
-1RH4RH3H2RHRR2OROR2O3RO2R2O5RO3R2O7(除O)(除F)1、一般而言,电子层数越多,半径越大;2、当电子层数相同时,质子数越大,半径越小;3、同种元素的不同粒子,电子越多,半径越大。附二:粒子半径大小比较一般规律如:同主族从上到下原子半径逐渐增大。如:同周期从左到右原子半径逐渐减小。如: Na Na+ Cl— Cl Fe 2+ Fe3+ >>>随堂练习1、下列说法中,不正确的是( )
A、在含有多个电子的原子里,电子是分层排布的;
B、在原子核外的各电子层中,能量高的离核近,能量低的离核远;
C、在原子核外的各电子层中,层数大的能量高,层数小的能量低;
D、在原子核外的各电子层中,层数大的离核远,层数小的离核近。B2、某元素原子最外层电子数为次外层电子数的3倍,该元素原子核内质子数为( )
A、13 B、7 C、8 D、10 C随堂练习3、下列元素的原子半径依次减小的是( )
A、Na、Mg、Al B、 F 、O、 N
C、O2- 、 F- 、Na+ D、C 、P 、 SiAC4、某原子共有5个电子层,则其O层最多容纳电子 个,N层最多容纳电子 个。 818 元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢?疑问元素金属性强弱判断依据 1.根据金属单质与水或酸反应置换出氢的难易程度。置换出氢越容易,则金属性越强。
2.根据金属元素最高价氧化物对应的水化物碱性强弱。碱性越强,则金属元素的金属性越强。
3.根据对应阳离子氧化性强弱判断。金属阳离子氧化性越弱,则元素金属性越强。元素非金属性强弱判断依据:1.根据非金属单质与H2化合生成氢化物的难易或氢化物的稳定性程度。越容易与H2化合,则生成的氢化物越稳定,非金属性越强。
2.根据非金属元素最高价氧化物对应的水化物酸性强弱。酸性越强,则元素的非金属性越强。
3. 根据对应阴离子还原性强弱判断。阴离子还原性越弱,则元素非金属性越强。科学探究现象化学方程式 镁与冷水反应缓慢,滴入酚酞试液浅红色。而镁与沸水反应加快,产生气泡,溶液红色加深。镁的金属性比钠弱结论与金属钠对比 镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。镁的金属性比铝强科学探究现象化学方程式 结论列表总结:强碱
两性
氢氧化物剧烈 迅速 非金属性:Si < P < S < Cl科学事实 非金属性:Si < P < S < Cl科学事实NaOH
强碱Mg(OH)2
中强碱H2SiO3
弱酸H3PO4
中强酸H2SO4
强酸HClO4
最强酸
稀有气体元素金属性逐渐减弱,非金属性逐渐增强本节总结: 根据实验,可得出第三周期元素金属性、非金属性的递变规律: Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强 对其他周期元素性质进行研究,也可以得到类似的结论。元素周期律 元素的性质随着原子序数的递增而呈周期性的变化的规律。
