人教版高中化学必修二2.2 化学能与电能 课件
文档属性
| 名称 | 人教版高中化学必修二2.2 化学能与电能 课件 |  | |
| 格式 | zip | ||
| 文件大小 | 8.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-03 15:46:36 | ||
图片预览







文档简介
课件39张PPT。第二章 化学反应与能量 第二节 化学能与电能 学习目标定位
1、熟悉能源的分类和化学能与电能的转化关系。
2、初步认识原电池的概念。
3,掌握构成原电池的条件。
4、了解原电池的工作原理。会判断原电池的正极、负极,会正确书写电极反应式
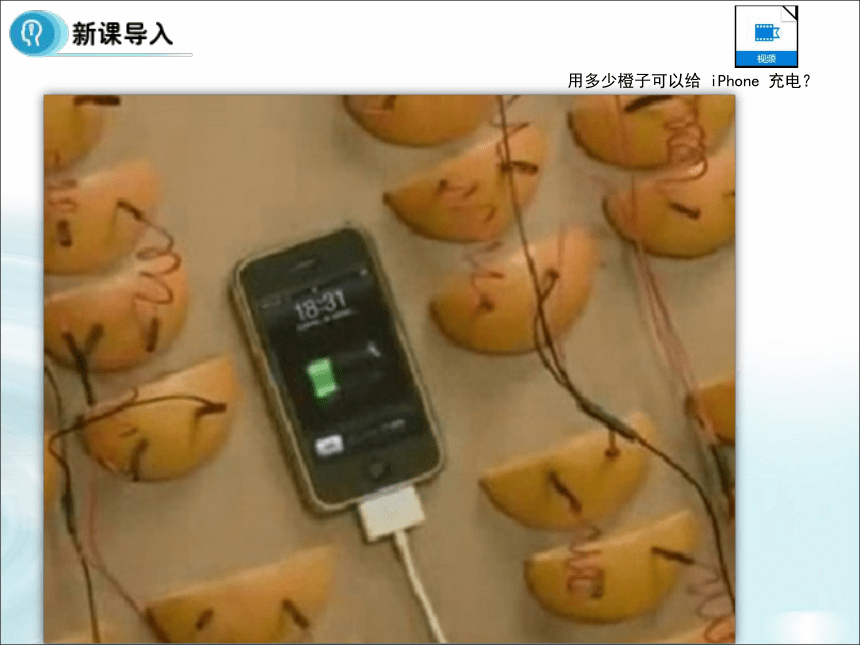
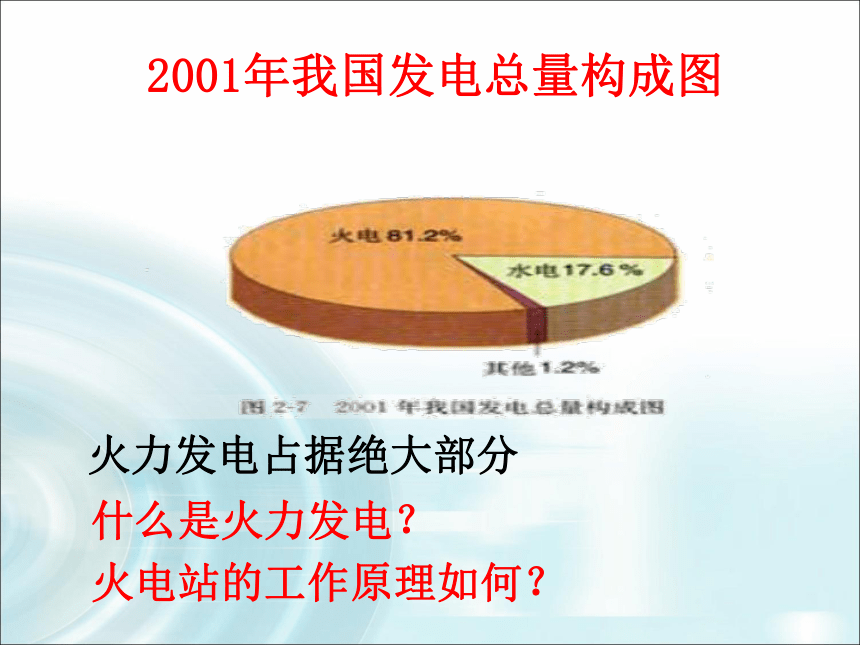
5、熟知原电池的应用。用多少橙子可以给 iPhone 充电?2001年我国发电总量构成图火力发电占据绝大部分什么是火力发电?
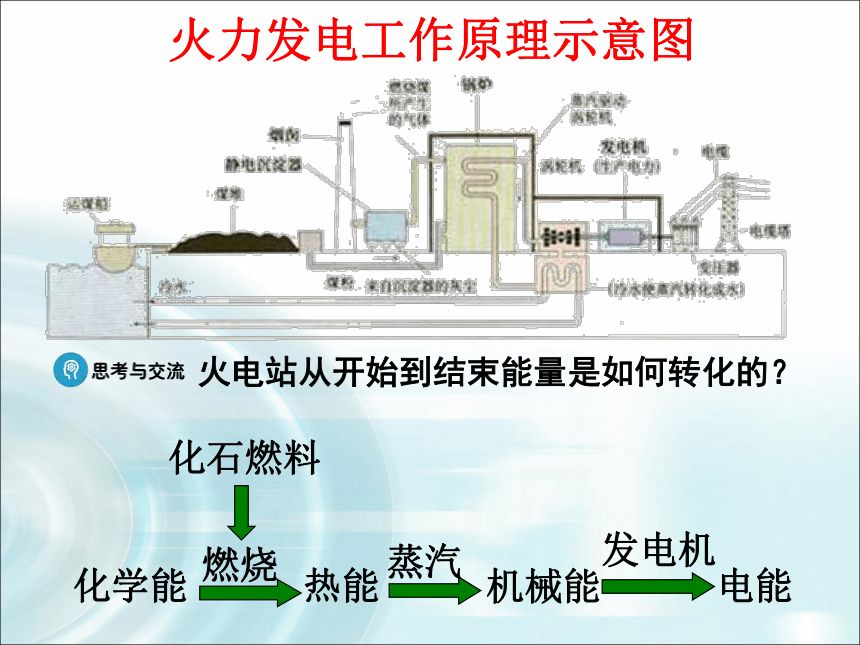
火电站的工作原理如何?火力发电工作原理示意图火电站从开始到结束能量是如何转化的?化石燃料化学能燃烧热能蒸汽机械能电能发电机火力发电存在的缺点?存
在
缺
点煤炭是非可再生资源排出大量温室气体可能导致酸雨能量转化效率低电能:是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源,又称电力。归纳总结一次能源与二次能源对比直接从自然界中取得的能源由一次能源经过加工、转化得
到的能源煤石油天然气1.下列说法不正确的是( )
A.根据一次能源和二次能源的划分,氢气为二次能源
B.电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源
C.火力发电是化学能间接转化为电能的过程
D.水力发电是将化学能转化为电能的过程
解析 水力发电是将水的机械能转化为电能的过程。活学活用D2.下列各项中,属于一次能源的是( )
①煤 ②石油 ③天然气 ④煤气 ⑤电力
A.①②③ B.①②④
C.②③⑤ D.③④⑤
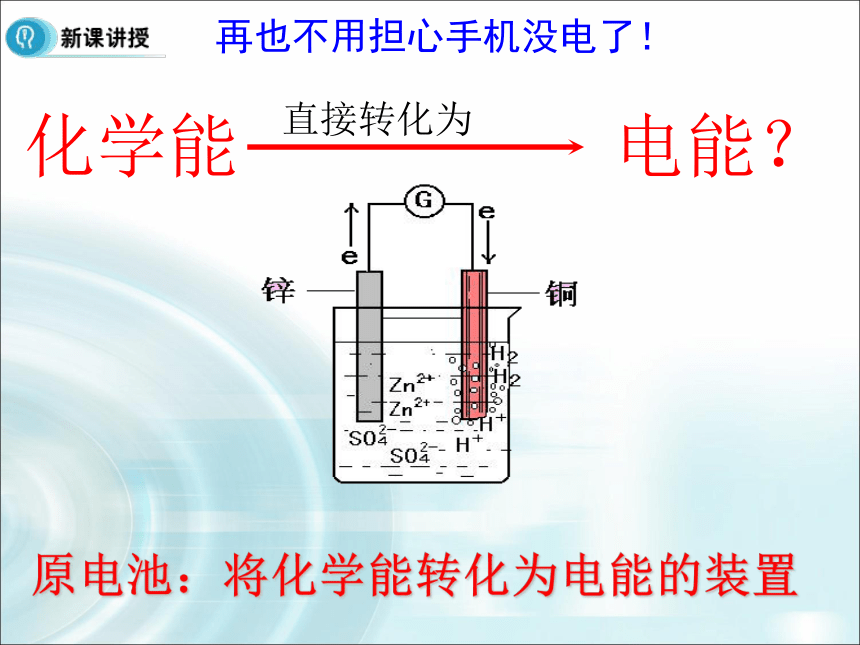
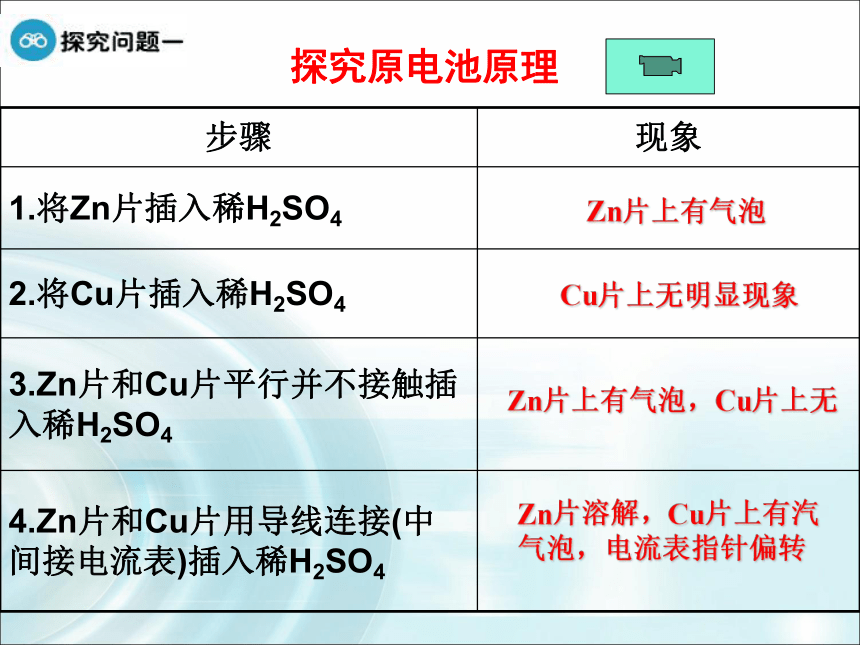
解析 煤、石油、天然气等没有经过加工或转换而直接从自然界中取得,称为一次能源;煤气、电力、汽油、煤油、焦炭等,是在一次能源基础上经过加工转换而来的,称为二次能源。A化学能 电能? 直接转化为再也不用担心手机没电了!原电池:将化学能转化为电能的装置探究原电池原理Zn片上有气泡Cu片上无明显现象Zn片上有气泡,Cu片上无Zn片溶解,Cu片上有汽气泡,电流表指针偏转5)电子流动的方向如何?从哪里来到哪里去?3)什么样的反应就一定有电子的转移呢?4)电流流动的方向如何?6)硫酸溶液中的阴、阳离子应该怎样运动?1)电流计指针为什么会发生偏转?2) 从能量变化的角度分析这是一种什么装置?负极正极铜锌原电池原理动画锌铜原电池原理电极反应
Zn-2e-= Zn2+
(氧化反应)电极反应
2H+ + 2e-=H2↑
(还原反应)电池总反应: Zn+2H+=Zn2++H2↑
Zn+H2SO4=ZnSO4+H2↑外电路:电子由负极→正极,
电流由正极→负极。内电路:阴离子移向负极,
阳离子移向正极。Zn-2e-=Zn2+2H++2e-=H2↑氧化反应还原反应负极正极Zn+2H+=Zn2++H2↑ 锌铜原电池原理实验探究形成原电池的条件(可以)(可以)(可以)(不可以)形成条件一:
活泼性不同的两个电极负极:较活泼的金属
正极:较不活泼的金属、石墨等形成条件二:电极需插进电解质溶液中实验探究形成原电池的条件形成条件三:必须形成闭合回路实验探究形成原电池的条件(不可以)实验探究形成原电池的条件形成条件四:必须存在自发的氧化还原反应3.构成原电池的条件(1)有活泼性不同的两个电极(2)两电极都接触电解质溶液(3)正极、负极、电解质溶液构成闭合回路( 4 )在电极表面上能发生自发进行的氧化还原反应。氧化还原反应组成条件 工作原理 定义原电池中浮(负极)只羊(氧化)原电池注意:前提必须有一个能够自发进行的氧化还原反应练习1:下列装置哪些可以形成原电池( )Zn CuFe C(石墨) Zn CuZn ZnFe 陶瓷Fe CuSi C(石墨) 稀H2SO4 CuSO4 溶液 稀H2SO4 稀H2SO4
A B C DZn Cu稀H2SO4 CuSO4溶液 酒精 稀H2SO4
E F G HABC是否形成原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式。①②③(×)(×)(√)④(√)(单液)铜锌原电池中时间和电流图
(从开始的1.0mA降到0.mA)一是电流微弱 二是供电时间短,放电效率低; 三是锌极板有大量气泡,干扰
铜极板现象的观察。 该原电池还有哪些缺点?1、该装置不能提供持续稳定的电流,
请讨论可能的原因是什么?
2、上述原电池该如何改进??盐桥:在U型管中装满用饱和KCl溶液和琼胶作成的冻胶。
①使实验装置形成闭合回路②使Zn盐和Cu盐溶液一直保持电中性负极反应式:Zn-2e-===Zn2+正极反应式Cu2++2e-===Cu电池总反应的离子方程式Zn+Cu2+=Zn2++Cu2、实验现象:①锌片溶解,铜片加厚变亮;②电流表指针发生偏转;③CuSO4溶液的颜色变浅
1、盐桥的作用:(双液)铜锌原电池中时间和电流图
(从开始的3.8mA一直保持不变)供电时间更长、
锌极板没有大量气泡盐桥能说明内电路中离子的迁移 但电流密度依然较小,
不足以使小灯泡发亮 2、基于盐桥的作用,你知道上述原电池装置
还可以怎么改进?提出课题——用更有说服力的实验来证实
具有实际价值的电池探究电池效率的因素,
放大电池的电流密度,
延长电池的工作时间,
。。。。。。。在锌片和铜片之间放一块海绵,用棉线或橡皮筋固定好。用导线把小灯泡和锌片、铜片连接起来,插入盛有稀硫酸的烧杯中。再向烧杯中加入1~2g高锰酸钾晶体去极化(或重铬酸钾晶体,或5~10mL6%H202溶液),振荡。
3、(去极化)原电池实验 极化现象原因:
铜锌原电池工作的过程中,Zn极(负极)金属溶解后,电极附近的浓度增大,从而减缓负极金属的溶解速率,电极被极化.即电极附近Zn2+浓度太大而扩散不出去极化剂解释:加入强氧化剂,它可以使Zn电极部分形成一层氧化膜,从而大大改善Zn电极金属的溶解速率,减缓电极-溶液界面化学反应速度,去掉极化,使电极电位回归到正常.通常还有一种办法就是将溶液强烈搅拌或升温,让离子快速扩散.练习1请指出正负极名称,并写出电极反应式.2H++2e-=H2↑负极:总反应:正极:Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑练习2:Mg-Al-H2SO4中 是正极,
是负极
Mg-Al-NaOH中 是正极 是负极MgAlAlMg 练习3 1:把A、B、C、D4块金属片浸入稀硫酸中,用导线两两相连组成原电池。
若A、B相连时,A为负极;
C、D相连时,D上产生大量气泡;
A、C相连时,电流由C经导线流向A;
B、D相连时,电子由D经导线流向B,
则此4种金属的活动性由强到弱的顺序为( )
① A>B>C>D ② A>C>D>B
③ C>A>B>D ④ B>A>C>D② A>BC>DA>CD>B 4、设计原电池 利用 Cu+2FeCl3= CuCl2+2FeCl2 的氧化还原反应设计原电池,画出图 ,并写出电极反应式。负极:正极:Cu—2e - = Cu2+2Fe3+ +2e- =2Fe2+氧化反应还原反应正极:负极:Fe-2e - =Fe2+Cu2++2e- =Cu请根据离子反应Fe+Cu2+=Fe2++Cu设计一个原电池。Fe+CuSO4=Cu+FeSO4讨论4:银器皿日久表面逐渐变黑色,这是由于生成了
硫化银的缘故,有人设计用原电池原理加以除去,其处
理方法是:将一定浓度的食盐溶液放入一铝制容器中,
放置一段时间后,黑色会褪去而银不会损失。试回答:
(1)在此原电池中,负极发生的反应为
_______________________,正极发生的反应为
_______________________.
(2)反应过程中会产生臭味,原电池总反应的方程式
为_______________________。2Al- 6e-=2Al3+3Ag2S+6e-=6Ag +3S2-3Ag2S+2Al+6H2O=2Al(OH)3↓+3H2S+6Ag锂电池低碳世博电动车间接:直接:装置原电池概
念构成条件工作原理化学能与电能
1、熟悉能源的分类和化学能与电能的转化关系。
2、初步认识原电池的概念。
3,掌握构成原电池的条件。
4、了解原电池的工作原理。会判断原电池的正极、负极,会正确书写电极反应式
5、熟知原电池的应用。用多少橙子可以给 iPhone 充电?2001年我国发电总量构成图火力发电占据绝大部分什么是火力发电?
火电站的工作原理如何?火力发电工作原理示意图火电站从开始到结束能量是如何转化的?化石燃料化学能燃烧热能蒸汽机械能电能发电机火力发电存在的缺点?存
在
缺
点煤炭是非可再生资源排出大量温室气体可能导致酸雨能量转化效率低电能:是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源,又称电力。归纳总结一次能源与二次能源对比直接从自然界中取得的能源由一次能源经过加工、转化得
到的能源煤石油天然气1.下列说法不正确的是( )
A.根据一次能源和二次能源的划分,氢气为二次能源
B.电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源
C.火力发电是化学能间接转化为电能的过程
D.水力发电是将化学能转化为电能的过程
解析 水力发电是将水的机械能转化为电能的过程。活学活用D2.下列各项中,属于一次能源的是( )
①煤 ②石油 ③天然气 ④煤气 ⑤电力
A.①②③ B.①②④
C.②③⑤ D.③④⑤
解析 煤、石油、天然气等没有经过加工或转换而直接从自然界中取得,称为一次能源;煤气、电力、汽油、煤油、焦炭等,是在一次能源基础上经过加工转换而来的,称为二次能源。A化学能 电能? 直接转化为再也不用担心手机没电了!原电池:将化学能转化为电能的装置探究原电池原理Zn片上有气泡Cu片上无明显现象Zn片上有气泡,Cu片上无Zn片溶解,Cu片上有汽气泡,电流表指针偏转5)电子流动的方向如何?从哪里来到哪里去?3)什么样的反应就一定有电子的转移呢?4)电流流动的方向如何?6)硫酸溶液中的阴、阳离子应该怎样运动?1)电流计指针为什么会发生偏转?2) 从能量变化的角度分析这是一种什么装置?负极正极铜锌原电池原理动画锌铜原电池原理电极反应
Zn-2e-= Zn2+
(氧化反应)电极反应
2H+ + 2e-=H2↑
(还原反应)电池总反应: Zn+2H+=Zn2++H2↑
Zn+H2SO4=ZnSO4+H2↑外电路:电子由负极→正极,
电流由正极→负极。内电路:阴离子移向负极,
阳离子移向正极。Zn-2e-=Zn2+2H++2e-=H2↑氧化反应还原反应负极正极Zn+2H+=Zn2++H2↑ 锌铜原电池原理实验探究形成原电池的条件(可以)(可以)(可以)(不可以)形成条件一:
活泼性不同的两个电极负极:较活泼的金属
正极:较不活泼的金属、石墨等形成条件二:电极需插进电解质溶液中实验探究形成原电池的条件形成条件三:必须形成闭合回路实验探究形成原电池的条件(不可以)实验探究形成原电池的条件形成条件四:必须存在自发的氧化还原反应3.构成原电池的条件(1)有活泼性不同的两个电极(2)两电极都接触电解质溶液(3)正极、负极、电解质溶液构成闭合回路( 4 )在电极表面上能发生自发进行的氧化还原反应。氧化还原反应组成条件 工作原理 定义原电池中浮(负极)只羊(氧化)原电池注意:前提必须有一个能够自发进行的氧化还原反应练习1:下列装置哪些可以形成原电池( )Zn CuFe C(石墨) Zn CuZn ZnFe 陶瓷Fe CuSi C(石墨) 稀H2SO4 CuSO4 溶液 稀H2SO4 稀H2SO4
A B C DZn Cu稀H2SO4 CuSO4溶液 酒精 稀H2SO4
E F G HABC是否形成原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式。①②③(×)(×)(√)④(√)(单液)铜锌原电池中时间和电流图
(从开始的1.0mA降到0.mA)一是电流微弱 二是供电时间短,放电效率低; 三是锌极板有大量气泡,干扰
铜极板现象的观察。 该原电池还有哪些缺点?1、该装置不能提供持续稳定的电流,
请讨论可能的原因是什么?
2、上述原电池该如何改进??盐桥:在U型管中装满用饱和KCl溶液和琼胶作成的冻胶。
①使实验装置形成闭合回路②使Zn盐和Cu盐溶液一直保持电中性负极反应式:Zn-2e-===Zn2+正极反应式Cu2++2e-===Cu电池总反应的离子方程式Zn+Cu2+=Zn2++Cu2、实验现象:①锌片溶解,铜片加厚变亮;②电流表指针发生偏转;③CuSO4溶液的颜色变浅
1、盐桥的作用:(双液)铜锌原电池中时间和电流图
(从开始的3.8mA一直保持不变)供电时间更长、
锌极板没有大量气泡盐桥能说明内电路中离子的迁移 但电流密度依然较小,
不足以使小灯泡发亮 2、基于盐桥的作用,你知道上述原电池装置
还可以怎么改进?提出课题——用更有说服力的实验来证实
具有实际价值的电池探究电池效率的因素,
放大电池的电流密度,
延长电池的工作时间,
。。。。。。。在锌片和铜片之间放一块海绵,用棉线或橡皮筋固定好。用导线把小灯泡和锌片、铜片连接起来,插入盛有稀硫酸的烧杯中。再向烧杯中加入1~2g高锰酸钾晶体去极化(或重铬酸钾晶体,或5~10mL6%H202溶液),振荡。
3、(去极化)原电池实验 极化现象原因:
铜锌原电池工作的过程中,Zn极(负极)金属溶解后,电极附近的浓度增大,从而减缓负极金属的溶解速率,电极被极化.即电极附近Zn2+浓度太大而扩散不出去极化剂解释:加入强氧化剂,它可以使Zn电极部分形成一层氧化膜,从而大大改善Zn电极金属的溶解速率,减缓电极-溶液界面化学反应速度,去掉极化,使电极电位回归到正常.通常还有一种办法就是将溶液强烈搅拌或升温,让离子快速扩散.练习1请指出正负极名称,并写出电极反应式.2H++2e-=H2↑负极:总反应:正极:Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑练习2:Mg-Al-H2SO4中 是正极,
是负极
Mg-Al-NaOH中 是正极 是负极MgAlAlMg 练习3 1:把A、B、C、D4块金属片浸入稀硫酸中,用导线两两相连组成原电池。
若A、B相连时,A为负极;
C、D相连时,D上产生大量气泡;
A、C相连时,电流由C经导线流向A;
B、D相连时,电子由D经导线流向B,
则此4种金属的活动性由强到弱的顺序为( )
① A>B>C>D ② A>C>D>B
③ C>A>B>D ④ B>A>C>D② A>BC>DA>CD>B 4、设计原电池 利用 Cu+2FeCl3= CuCl2+2FeCl2 的氧化还原反应设计原电池,画出图 ,并写出电极反应式。负极:正极:Cu—2e - = Cu2+2Fe3+ +2e- =2Fe2+氧化反应还原反应正极:负极:Fe-2e - =Fe2+Cu2++2e- =Cu请根据离子反应Fe+Cu2+=Fe2++Cu设计一个原电池。Fe+CuSO4=Cu+FeSO4讨论4:银器皿日久表面逐渐变黑色,这是由于生成了
硫化银的缘故,有人设计用原电池原理加以除去,其处
理方法是:将一定浓度的食盐溶液放入一铝制容器中,
放置一段时间后,黑色会褪去而银不会损失。试回答:
(1)在此原电池中,负极发生的反应为
_______________________,正极发生的反应为
_______________________.
(2)反应过程中会产生臭味,原电池总反应的方程式
为_______________________。2Al- 6e-=2Al3+3Ag2S+6e-=6Ag +3S2-3Ag2S+2Al+6H2O=2Al(OH)3↓+3H2S+6Ag锂电池低碳世博电动车间接:直接:装置原电池概
念构成条件工作原理化学能与电能
