人教版高中化学必修二 1.1.3 碱金属元素和卤素 课件
文档属性
| 名称 | 人教版高中化学必修二 1.1.3 碱金属元素和卤素 课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 799.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-03 00:00:00 | ||
图片预览









文档简介
课件38张PPT。IA族——碱金属元素
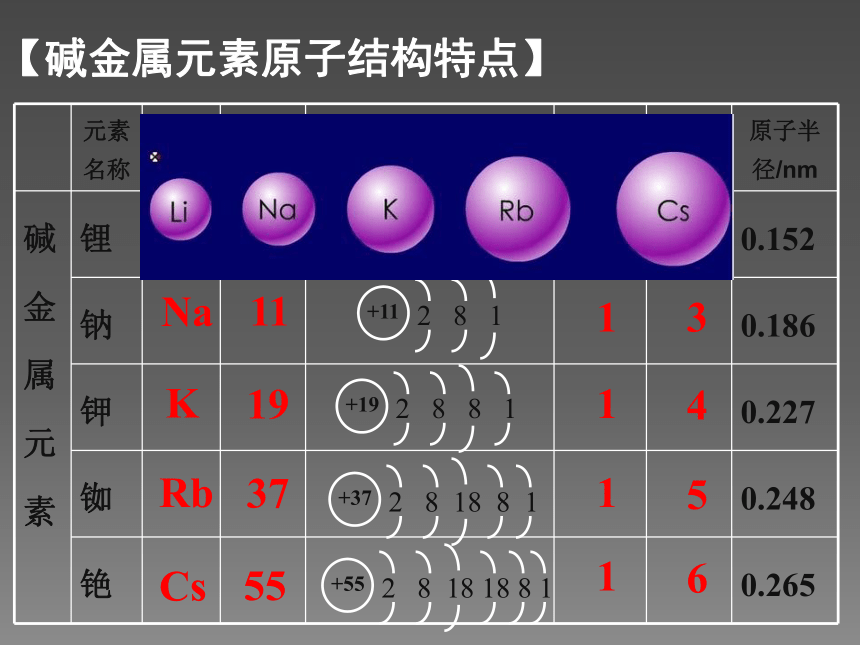
【碱金属元素原子结构特点】LiNaKRbCs3111937551111123456思考:
碱金属元素其原子结构有何相似性和递变性? 最外层电子数均为 ,均易 电子,化合价升高为+1,被氧化,做还原剂,具有强 性;1失去还原 随着核电荷数的递增,电子层数逐渐 ,原子半径逐渐 ,越来越容易失去电子。(1)相似性:(2)递变性:增多增大【碱金属元素原子结构特点】思考:为什么随着电子层增多,金属的化学性质
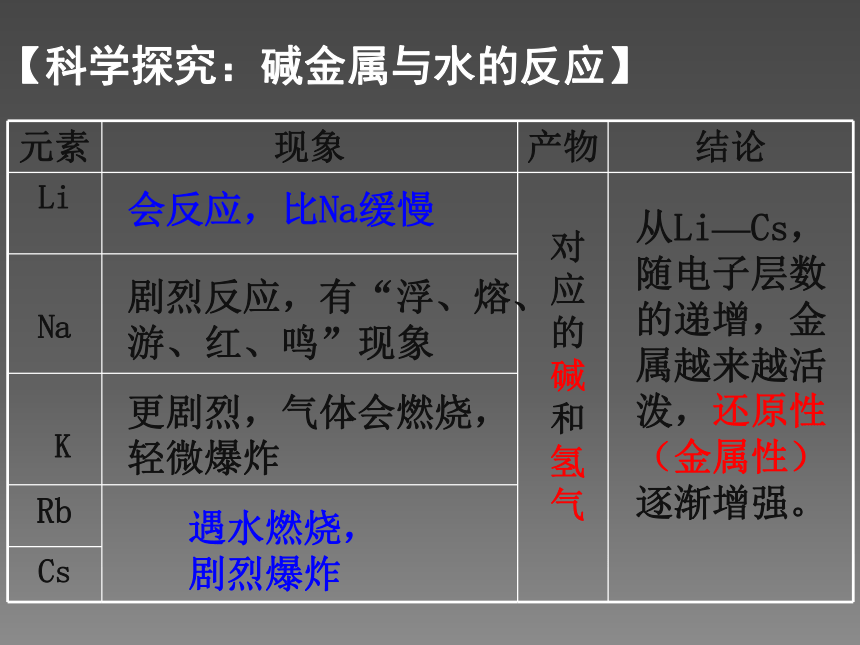
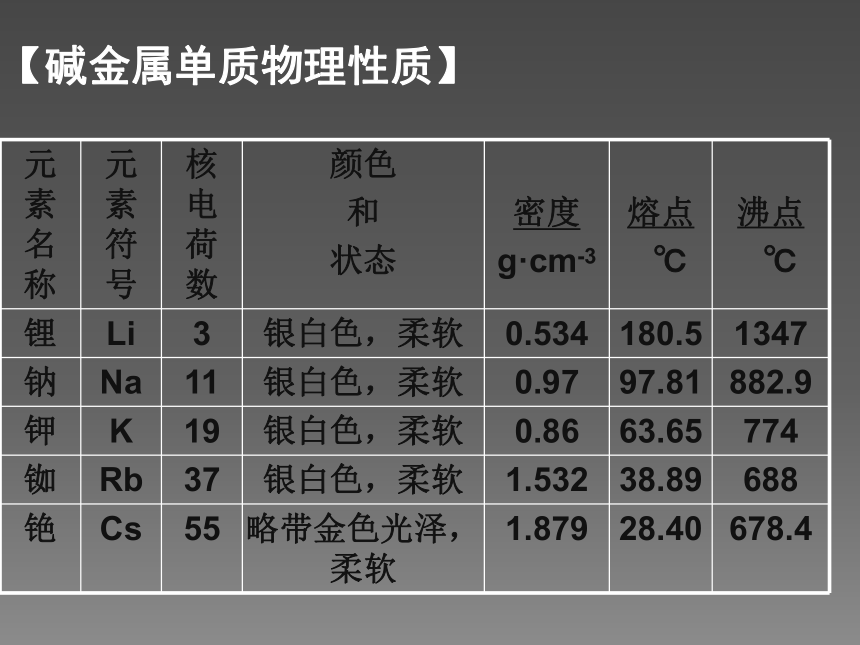
会越来越活泼呢?金属——失电子能力——还原性——活泼性【碱金属元素原子结构特点】 取一小块钾,擦干表面的煤油后放在石棉网上加热,观察现象。同钠与氧气的反应比较。 钠在空气中的燃烧钾在空气中的燃烧【科学探究:碱金属与氧气反应】钠、钾化学性质比较黄淡黄紫【科学探究:碱金属与氧气反应】 Rb、Cs与O2反应更剧烈,结合的氧越来越多,产物更复杂。(1)与 O2反应——生成氧化物【碱金属单质化学性质】从Li—Cs,随电子层数的递增,金属越来越活泼,还原性(金属性)逐渐增强。会反应,比Na缓慢 遇水燃烧,剧烈爆炸 对应的碱和氢气剧烈反应,有“浮、熔、游、红、鸣”现象更剧烈,气体会燃烧,轻微爆炸【科学探究:碱金属与水的反应】产物碱性:LiOH <NaOH <KOH < RbOH < CsOH2Li + 2H2O = 2LiOH + H2 ↑(较慢)2Na + 2H2O = 2NaOH + H2 ↑(激烈)2K + 2H2O = 2KOH + H2 ↑(很激烈)结论:金属越活泼,与水反应越剧烈,产生的碱碱性越强。【碱金属单质化学性质】(2)与 H2O反应——生成碱和氢气【碱金属单质物理性质】 从上到下,熔沸点逐渐降低,密度增大。(K例外)(1)相似性:(2)递变性: 都是柔软的有金属光泽的金属,硬度小、密度小、易导电、导热,如液态钠可以作为核反应堆的传热介质。【碱金属单质物理性质】 碱金属元素从上到下(Li、Na、K、Rb、Cs),随着核电荷数的增加,元素原子的电子层数逐渐 ,原子半径逐渐 ,原子核对最外层电子的引力逐渐 ,原子失电子能力逐渐 ,元素的金属性逐渐 ,与水和氧气反应越来越 ,生成的氧化物越来越 。最高价氧化物对应水化物的碱性越来越 。增多增大减弱增强增强剧烈复杂强【总结:碱金属元素的递变规律】同主族金属,最外层电子数相同,从上到下,电子层数增多,半径增大。
从上到下
失电子能力增强,还原性增强,越活泼。
(金属性强,还原性强,失电子能力强)【简单记忆】VIIA族——卤族元素 (简称卤素)卤素原子结构示意图:
交流·探究:卤素在化学性质上的相似性和递变性?【学与问】 最外层电子数均为 ,均易 电子,化合价 ,被 ,有强 性。7得到氧化增多增大 随着核电荷数的递增,电子层数渐 ,
原子半径逐渐 。(1)相似性:(2)递变性:还原降低【卤素原子结构特点】 金属越容易失去电子,越活泼,还原性越强,反应越剧烈。那么非金属呢?由F到I,非金属性逐渐 。
化学反应越来越 。减弱剧烈 ,条件越来越苛刻【卤素单质化学性质】(1)与H2反应反应越来越不剧烈HF > HCl > HBr > HI剧烈程度:生成的氢化物的稳定性:越来越不稳定通式: X2 + H2 = 2HX反应条件:反应越来难(苛刻)【卤素单质化学性质】(1)相似性:(2)递变性: 均为双原子分子,参与反应时容易得到一个电子,化合价降低为-1,体现氧化性。颜色:状态:密度:熔沸点:逐渐加深气 →液→固逐渐增大依次增高【卤素单质的物理性质】 1、Br2是易挥发的深红棕色液体
唯一一种液态非金属单质2、 I2易升华,紫黑色固体,遇淀粉溶液变蓝色。【卤素单质性质特殊性】2NaBr + Cl2 = 2NaCl + Br2
(溶液由无色变成橙黄色)
2KI + Cl2 = 2KCl + I2
(溶液由无色变成棕黄色)
2KI + Br2 = 2KBr + I2
(溶液由无色变棕黄色)由上述反应可比较卤素单质____性强弱。氧化氧化性: F2 > Cl2 > Br2 >I2★从F → I ,元素的非金属性逐渐减弱。【卤素单质之间的置换反应】 卤族元素周期表从上到下(F、Cl、Br、I),随着核电荷数的增加,元素原子的电子层数逐渐 ,原子半径逐渐 ,原子核对最外层电子的引力逐渐 ,原子得电子能力逐渐 ,元素的非金属性逐渐 ,与氢气越来越 反应,生成氢化物越来越 。增多增大减弱减弱减弱难不稳定【总结:卤族元素的递变规律】【应用:元素非金属性强弱判断依据】(1)非金属单质与氢气化合的难易程度;形成气态氢化物的稳定性;氢化物稳定性越强,非金属性越强;
比较元素非金属性强弱,其实质是看元素原子得电子的难易,越容易得电子,非金属性越强,反之非金属性越弱(方法3种)(2)最高价氧化物对应水化物酸性强弱;(3)单质间的置换反应。【应用:元素金属性强弱判断依据】(1)金属单质与水或酸反应置换出氢的难易程度; 比较元素金属性强弱,其实质是看元素原子失电子的难易,越容易失电子,金属性越强,反之金属性越弱。(方法3种)(2)金属元素最高价氧化物对应水化物(碱)碱性强弱【Cu(OH)2、Fe(OH)3】(3)金属单质间的置换反应。 同主族:元素金属性、非金属性的递变Li
Na
K
Rb
Cs
Fr
F
Cl
Br
I
At
IAⅦA金属性增强非金属性减弱从上到下,原子核对外层电子的引力减弱,失电子能力逐渐增强,得电子能力逐渐减弱。
【谨记】金属性——还原性——失电子能力
非金属性——氧化性——得电子能力1、钠和锂有相似的化学性质,下列说法中能较好地解释这个事实的是( )
A.都是金属元素;
B.原子半径相差不大;
C.最外层电子数相同 ;
D.化合价相同。C【随堂练习】2、第ⅦA元素是重要的成盐元素,其氢化物稳定性最大的是( )
A. HF B.HCl C.HBr D.HI 3、根据元素周期律,碱金属元素的下列性质从上到下依次递增的有
A.金属性 B.化合价
C.原子半径 D.单质的还原性4、下列说法不正确的是
A.钾的金属性比钠强
B.溴的金属性比氯强
C.VIIA族中原子半径最小的是氟
D. 第IA族中,原子半径最小的是钠【随堂练习】【复习1:原子的构成】相对原子质量 = 质子数 + 中子数 质量数——核电荷数——
(核内质子数)——元素符号【1、质量数】质量数(A)=质子数(Z)+中子数(N) 定义:忽略电子的质量,将原子核内所有质子和
中子的相对质量取近似整数值加起来所得
的数值,叫做质量数,符号A。
A35101340181835110117【练一练】想一想:同种元素原子的质子数相同,中子数是不是一定相同呢? 元素是具有相同核电荷数(质子数)的同一类原子的总称。【复习2:元素的定义】核素的定义: 具有一定数目的质子和一定数目的中子的一种原子。 氢元素的三种原子111012【2、核素】核素的理解:
(1)一种核素就是一种原子。
(2)质子数和中子数共同决定核素的种类
(3)绝大多数元素都包括多种核素,所以核素的种类多于元素的种类。 【2、核素】【3、同位素】(1)定义:质子数相同而中子数不同的同一元素的不同原子互称同位素。(2)特点: 三同、三不同①三同:同种元素(同质子数)
同位置、化学性质相同②三不同:不同原子、中子数不同、
物理性质不同【元素、核素、同位素之间的关系】1.同一种元素,可以有若干种不同的核素;
2.同位素是同一元素的不同核素之间的互称。 同素异形体?1、以下为同位素的是( )
A. D2和H2 B. CO和CO2
C. 金刚石和石墨 D. 和
2、下列叙述正确的是( )
A. 所有元素的原子核均由质子和中子构成
B. 是一种同位素
C. 铀有三种同位素,即有三种铀原子
D. 核素就是元素DC【随堂练习】3、据报道,上海某医院正在研究用放射性的一种
碘 治疗肿瘤。该碘原子的核内中子数与核外
电子数之差是( )A、72 B、19 C、53 D、125B4、在考古中常通过测定14C来鉴定文物年代。下列有关14C的说法正确的是( )
A.质子数为7 B.中子数为8
C.核外电子数为7 D.原子序数为14【随堂练习】
碱金属元素其原子结构有何相似性和递变性? 最外层电子数均为 ,均易 电子,化合价升高为+1,被氧化,做还原剂,具有强 性;1失去还原 随着核电荷数的递增,电子层数逐渐 ,原子半径逐渐 ,越来越容易失去电子。(1)相似性:(2)递变性:增多增大【碱金属元素原子结构特点】思考:为什么随着电子层增多,金属的化学性质
会越来越活泼呢?金属——失电子能力——还原性——活泼性【碱金属元素原子结构特点】 取一小块钾,擦干表面的煤油后放在石棉网上加热,观察现象。同钠与氧气的反应比较。 钠在空气中的燃烧钾在空气中的燃烧【科学探究:碱金属与氧气反应】钠、钾化学性质比较黄淡黄紫【科学探究:碱金属与氧气反应】 Rb、Cs与O2反应更剧烈,结合的氧越来越多,产物更复杂。(1)与 O2反应——生成氧化物【碱金属单质化学性质】从Li—Cs,随电子层数的递增,金属越来越活泼,还原性(金属性)逐渐增强。会反应,比Na缓慢 遇水燃烧,剧烈爆炸 对应的碱和氢气剧烈反应,有“浮、熔、游、红、鸣”现象更剧烈,气体会燃烧,轻微爆炸【科学探究:碱金属与水的反应】产物碱性:LiOH <NaOH <KOH < RbOH < CsOH2Li + 2H2O = 2LiOH + H2 ↑(较慢)2Na + 2H2O = 2NaOH + H2 ↑(激烈)2K + 2H2O = 2KOH + H2 ↑(很激烈)结论:金属越活泼,与水反应越剧烈,产生的碱碱性越强。【碱金属单质化学性质】(2)与 H2O反应——生成碱和氢气【碱金属单质物理性质】 从上到下,熔沸点逐渐降低,密度增大。(K例外)(1)相似性:(2)递变性: 都是柔软的有金属光泽的金属,硬度小、密度小、易导电、导热,如液态钠可以作为核反应堆的传热介质。【碱金属单质物理性质】 碱金属元素从上到下(Li、Na、K、Rb、Cs),随着核电荷数的增加,元素原子的电子层数逐渐 ,原子半径逐渐 ,原子核对最外层电子的引力逐渐 ,原子失电子能力逐渐 ,元素的金属性逐渐 ,与水和氧气反应越来越 ,生成的氧化物越来越 。最高价氧化物对应水化物的碱性越来越 。增多增大减弱增强增强剧烈复杂强【总结:碱金属元素的递变规律】同主族金属,最外层电子数相同,从上到下,电子层数增多,半径增大。
从上到下
失电子能力增强,还原性增强,越活泼。
(金属性强,还原性强,失电子能力强)【简单记忆】VIIA族——卤族元素 (简称卤素)卤素原子结构示意图:
交流·探究:卤素在化学性质上的相似性和递变性?【学与问】 最外层电子数均为 ,均易 电子,化合价 ,被 ,有强 性。7得到氧化增多增大 随着核电荷数的递增,电子层数渐 ,
原子半径逐渐 。(1)相似性:(2)递变性:还原降低【卤素原子结构特点】 金属越容易失去电子,越活泼,还原性越强,反应越剧烈。那么非金属呢?由F到I,非金属性逐渐 。
化学反应越来越 。减弱剧烈 ,条件越来越苛刻【卤素单质化学性质】(1)与H2反应反应越来越不剧烈HF > HCl > HBr > HI剧烈程度:生成的氢化物的稳定性:越来越不稳定通式: X2 + H2 = 2HX反应条件:反应越来难(苛刻)【卤素单质化学性质】(1)相似性:(2)递变性: 均为双原子分子,参与反应时容易得到一个电子,化合价降低为-1,体现氧化性。颜色:状态:密度:熔沸点:逐渐加深气 →液→固逐渐增大依次增高【卤素单质的物理性质】 1、Br2是易挥发的深红棕色液体
唯一一种液态非金属单质2、 I2易升华,紫黑色固体,遇淀粉溶液变蓝色。【卤素单质性质特殊性】2NaBr + Cl2 = 2NaCl + Br2
(溶液由无色变成橙黄色)
2KI + Cl2 = 2KCl + I2
(溶液由无色变成棕黄色)
2KI + Br2 = 2KBr + I2
(溶液由无色变棕黄色)由上述反应可比较卤素单质____性强弱。氧化氧化性: F2 > Cl2 > Br2 >I2★从F → I ,元素的非金属性逐渐减弱。【卤素单质之间的置换反应】 卤族元素周期表从上到下(F、Cl、Br、I),随着核电荷数的增加,元素原子的电子层数逐渐 ,原子半径逐渐 ,原子核对最外层电子的引力逐渐 ,原子得电子能力逐渐 ,元素的非金属性逐渐 ,与氢气越来越 反应,生成氢化物越来越 。增多增大减弱减弱减弱难不稳定【总结:卤族元素的递变规律】【应用:元素非金属性强弱判断依据】(1)非金属单质与氢气化合的难易程度;形成气态氢化物的稳定性;氢化物稳定性越强,非金属性越强;
比较元素非金属性强弱,其实质是看元素原子得电子的难易,越容易得电子,非金属性越强,反之非金属性越弱(方法3种)(2)最高价氧化物对应水化物酸性强弱;(3)单质间的置换反应。【应用:元素金属性强弱判断依据】(1)金属单质与水或酸反应置换出氢的难易程度; 比较元素金属性强弱,其实质是看元素原子失电子的难易,越容易失电子,金属性越强,反之金属性越弱。(方法3种)(2)金属元素最高价氧化物对应水化物(碱)碱性强弱【Cu(OH)2、Fe(OH)3】(3)金属单质间的置换反应。 同主族:元素金属性、非金属性的递变Li
Na
K
Rb
Cs
Fr
F
Cl
Br
I
At
IAⅦA金属性增强非金属性减弱从上到下,原子核对外层电子的引力减弱,失电子能力逐渐增强,得电子能力逐渐减弱。
【谨记】金属性——还原性——失电子能力
非金属性——氧化性——得电子能力1、钠和锂有相似的化学性质,下列说法中能较好地解释这个事实的是( )
A.都是金属元素;
B.原子半径相差不大;
C.最外层电子数相同 ;
D.化合价相同。C【随堂练习】2、第ⅦA元素是重要的成盐元素,其氢化物稳定性最大的是( )
A. HF B.HCl C.HBr D.HI 3、根据元素周期律,碱金属元素的下列性质从上到下依次递增的有
A.金属性 B.化合价
C.原子半径 D.单质的还原性4、下列说法不正确的是
A.钾的金属性比钠强
B.溴的金属性比氯强
C.VIIA族中原子半径最小的是氟
D. 第IA族中,原子半径最小的是钠【随堂练习】【复习1:原子的构成】相对原子质量 = 质子数 + 中子数 质量数——核电荷数——
(核内质子数)——元素符号【1、质量数】质量数(A)=质子数(Z)+中子数(N) 定义:忽略电子的质量,将原子核内所有质子和
中子的相对质量取近似整数值加起来所得
的数值,叫做质量数,符号A。
A35101340181835110117【练一练】想一想:同种元素原子的质子数相同,中子数是不是一定相同呢? 元素是具有相同核电荷数(质子数)的同一类原子的总称。【复习2:元素的定义】核素的定义: 具有一定数目的质子和一定数目的中子的一种原子。 氢元素的三种原子111012【2、核素】核素的理解:
(1)一种核素就是一种原子。
(2)质子数和中子数共同决定核素的种类
(3)绝大多数元素都包括多种核素,所以核素的种类多于元素的种类。 【2、核素】【3、同位素】(1)定义:质子数相同而中子数不同的同一元素的不同原子互称同位素。(2)特点: 三同、三不同①三同:同种元素(同质子数)
同位置、化学性质相同②三不同:不同原子、中子数不同、
物理性质不同【元素、核素、同位素之间的关系】1.同一种元素,可以有若干种不同的核素;
2.同位素是同一元素的不同核素之间的互称。 同素异形体?1、以下为同位素的是( )
A. D2和H2 B. CO和CO2
C. 金刚石和石墨 D. 和
2、下列叙述正确的是( )
A. 所有元素的原子核均由质子和中子构成
B. 是一种同位素
C. 铀有三种同位素,即有三种铀原子
D. 核素就是元素DC【随堂练习】3、据报道,上海某医院正在研究用放射性的一种
碘 治疗肿瘤。该碘原子的核内中子数与核外
电子数之差是( )A、72 B、19 C、53 D、125B4、在考古中常通过测定14C来鉴定文物年代。下列有关14C的说法正确的是( )
A.质子数为7 B.中子数为8
C.核外电子数为7 D.原子序数为14【随堂练习】
