人教版高中化学必修二3.3 生活中两种常见的有机物---乙醇
文档属性
| 名称 | 人教版高中化学必修二3.3 生活中两种常见的有机物---乙醇 |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-03 17:14:55 | ||
图片预览




文档简介
课件29张PPT。乙醇一、乙醇的物理性质颜 色:
气 味:
状 态:
密 度:
挥发性:
溶解性:无色透明特殊香味液体比水小
200C时的密度是0.7893g/cm3和水可以以任意比互溶
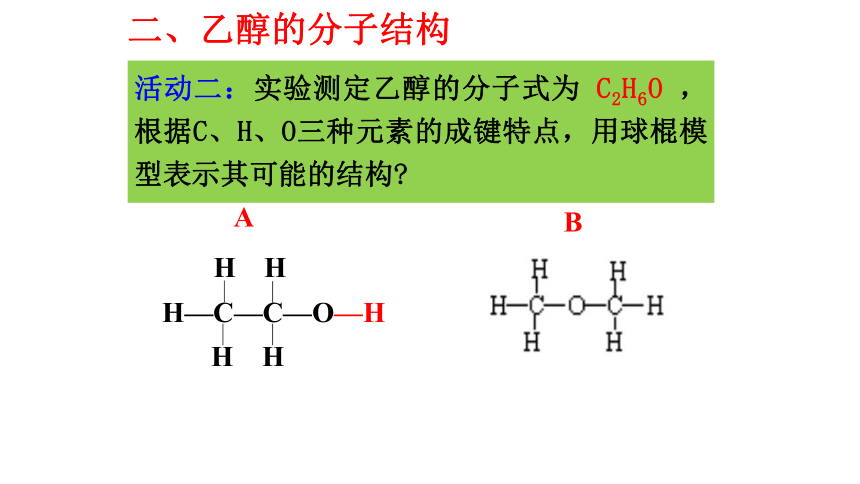
能够溶解多种无机物和有机物沸点78℃,易挥发活动一:观察一瓶酒精,阅读课本内容,归纳总结乙
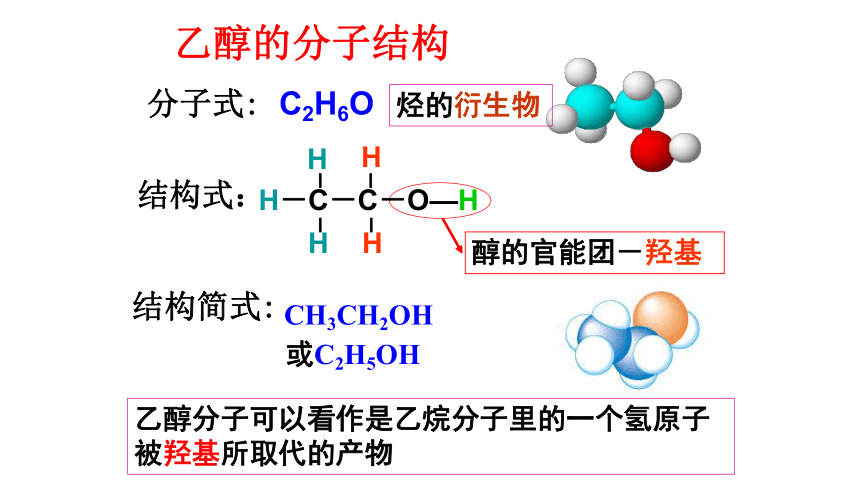
醇的物理性质。 二、乙醇的分子结构BA活动二:实验测定乙醇的分子式为 C2H6O ,根据C、H、O三种元素的成键特点,用球棍模型表示其可能的结构?H―O―H烃类
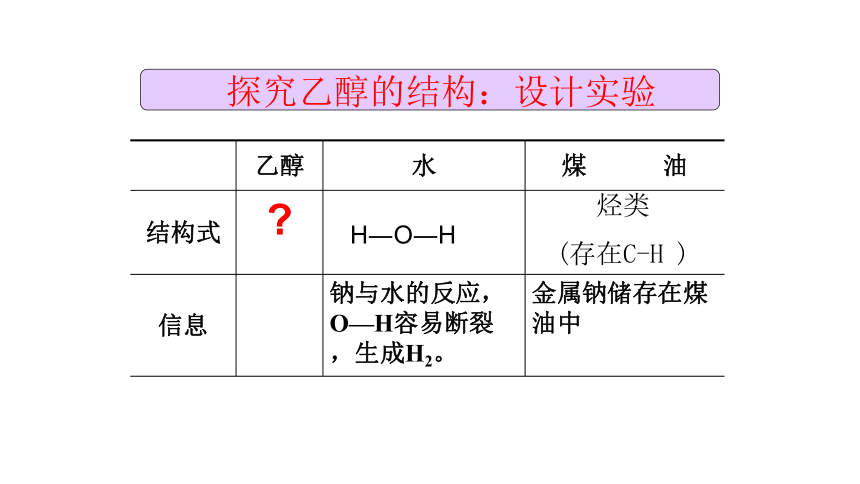
(存在C-H ) 探究乙醇的结构:设计实验
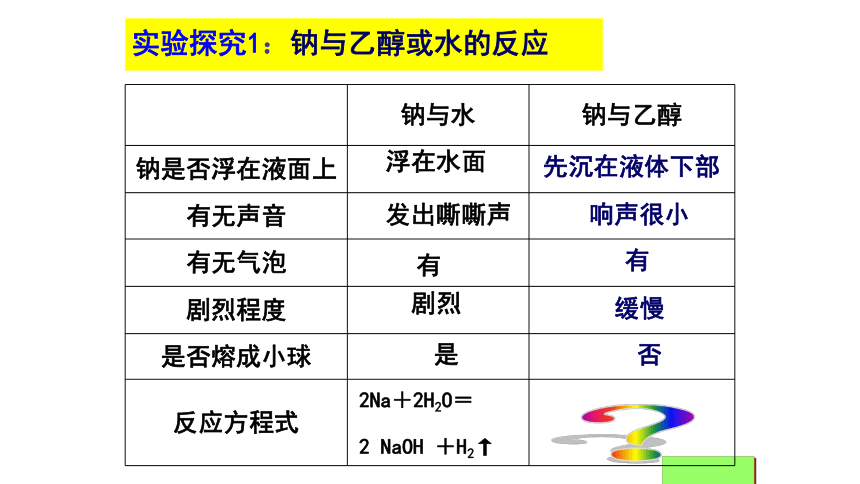
1.在试管中取约4ml的乙醇,加入一黄豆粒大小新切的、用滤纸吸干表面煤油的金属钠,观察实验现象,类比钠与水的反应,完成对比表格。
2.对比思考:对比钠与水、钠与乙醇的反应,结合水分子的结构,推测乙醇结构。实验探究1:钠与乙醇或水的反应实验探究1:钠与乙醇或水的反应剧烈缓慢?2Na+2H2O=
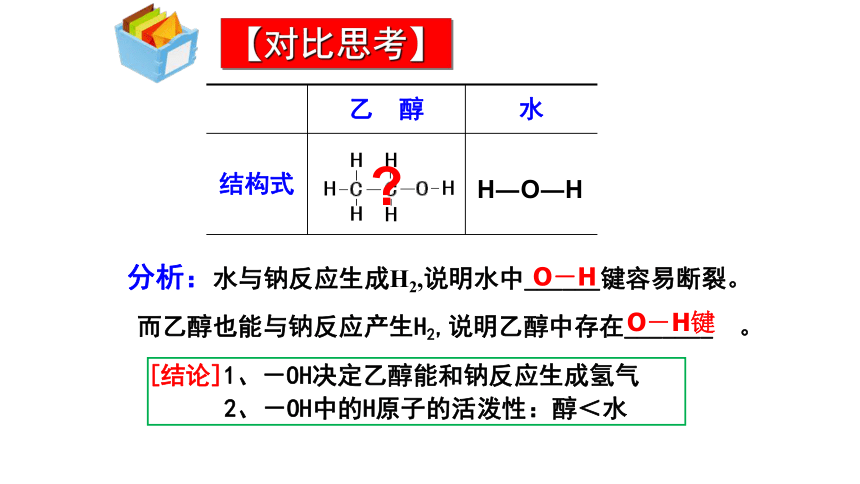
2 NaOH +H2↑先沉在液体下部响声很小有浮在水面发出嘶嘶声有是否分析:水与钠反应生成H2,说明水中______键容易断裂。而乙醇也能与钠反应产生H2,说明乙醇中存在_______ 。H―O―HO―HO―H键 ?【对比思考】[结论]1、-OH决定乙醇能和钠反应生成氢气
2、-OH中的H原子的活泼性:醇<水分子式:结构式: 结构简式:CH3CH2OH或C2H5OH醇的官能团-羟基乙醇的分子结构C2H6O
乙醇分子可以看作是乙烷分子里的一个氢原子被羟基所取代的产物烃的衍生物 决定有机化合物的化学性质的原子或原子团叫做官能团。卤素原子(-X) 硝基
(-NO2) 羟基
(-OH)烃的衍生物:烃分子中的氢原子被其它原子或原子团取代而生成的一系列化合物。 碳碳双键
( ) 1、乙醇与钠的反应注意 Ⅰ.断O-H键,发生置换反应
Ⅱ.氢原子活泼性:酸>水>醇
Ⅲ.此反应可检验—OH的存在,可计算分子中—OH数目 ( —OH 与H2的物质的量之比为2:1)2、氧化反应① 燃烧(完全氧化)现象:发出淡蓝色火焰,并放出大量热 实验现象:红热的铜丝,移离火焰 ,迅速伸入乙醇中,铜丝 ,反复多次产生 气味。铜丝变黑变红产生刺激性气味CH3CHO 乙醛+ H2O 总反应方程式:②①①+②×2变黑又变红刺激性 乙醇催化氧化规律:去掉—OH上的H和—OH所在碳原子上的H乙醇催化氧化机理:①②③④⑤乙醛的结构式结构简式 CH3CHO 人喝酒后会产生恶心欲吐、昏迷不适等醉酒症状。你知道酒精中毒的罪魁祸首是什么吗?你知道吗? 乙醛的毒性是乙醇的10倍。高浓度乙醛有麻醉作用,使体内某些反应停止,部分组织坏死。从而令人头晕头痛、嗜睡昏迷。 伤及肝脏、心脑血管及脑神经系统。是乙醇在体内氧化后的产物乙醛!乙醇乙醛乙酸CO2+H2O世界卫生组织的事故调查显示,大约50%-60%的交通事故与酒后驾驶有关。 ③与强氧化剂反应1)完全氧化(燃烧反应)
C2H6O + 3O2 → 2CO2 + 3H2O
2)催化氧化——氧化成乙醛
3)与强氧化剂反应——直接氧化成乙酸
被酸性高锰酸钾或重铬酸钾溶液等强氧化剂直接氧化为乙酸点燃小结:乙醇的几种不同氧化方式课堂反馈乙醇分子中不同的化学键如图:
化学反应中乙醇的断键位置
(1)与活泼金属反应键 断裂
(2) CH3CH2OH 燃烧键 断裂
(3)在Cu或Ag催化下和O2反应键 断裂①②③④⑤①① ③全部作燃料 —— 飞机、汽车、火锅、酒精灯等作消毒剂 —— 医用酒精等乙醇的用途制酒精型饮料工业制取乙酸本节重点知识你掌握了吗?1、下列物质可使酸性高锰酸钾溶液褪色, 不
能使溴水褪色的是( )
A、甲烷 B、乙烯
C、乙醇 D、苯C练 习 2、比较乙烷和乙醇的结构,下列说法错误的是( )
A.两个碳原子都以单键相连
B.分子里都含有6个完全相同的氢原子
C. 乙醇可以看成是乙烷分子中的一个氢原子被羟基取代后的产物
D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼 B 3、等物质的量的下列醇与足量的金属钠反应,产生气体最多的是( )
A.CH3OH B. C2H5OH
C.CH2 CH CH2 D. CH2 CH2
OHOHOHOHOH能力提升C4.丙烯醇(CH2=CHCH2OH)可跟哪些物质发生化学反应 ( )
①溴水 ②钠 ③氧气 ④酸性高锰酸钾溶液
A.只有②③④ B.只有②③
C.只有①③ D.全部
能力提升D1.?教材P76-1.2.3.8,及新学案第一课时。
2.?调查酗酒的危害性,对此提出你的建议或看法。
3.去图书馆或上网查阅乙醇的工业制法。作业布置 再见谢谢!
气 味:
状 态:
密 度:
挥发性:
溶解性:无色透明特殊香味液体比水小
200C时的密度是0.7893g/cm3和水可以以任意比互溶
能够溶解多种无机物和有机物沸点78℃,易挥发活动一:观察一瓶酒精,阅读课本内容,归纳总结乙
醇的物理性质。 二、乙醇的分子结构BA活动二:实验测定乙醇的分子式为 C2H6O ,根据C、H、O三种元素的成键特点,用球棍模型表示其可能的结构?H―O―H烃类
(存在C-H ) 探究乙醇的结构:设计实验
1.在试管中取约4ml的乙醇,加入一黄豆粒大小新切的、用滤纸吸干表面煤油的金属钠,观察实验现象,类比钠与水的反应,完成对比表格。
2.对比思考:对比钠与水、钠与乙醇的反应,结合水分子的结构,推测乙醇结构。实验探究1:钠与乙醇或水的反应实验探究1:钠与乙醇或水的反应剧烈缓慢?2Na+2H2O=
2 NaOH +H2↑先沉在液体下部响声很小有浮在水面发出嘶嘶声有是否分析:水与钠反应生成H2,说明水中______键容易断裂。而乙醇也能与钠反应产生H2,说明乙醇中存在_______ 。H―O―HO―HO―H键 ?【对比思考】[结论]1、-OH决定乙醇能和钠反应生成氢气
2、-OH中的H原子的活泼性:醇<水分子式:结构式: 结构简式:CH3CH2OH或C2H5OH醇的官能团-羟基乙醇的分子结构C2H6O
乙醇分子可以看作是乙烷分子里的一个氢原子被羟基所取代的产物烃的衍生物 决定有机化合物的化学性质的原子或原子团叫做官能团。卤素原子(-X) 硝基
(-NO2) 羟基
(-OH)烃的衍生物:烃分子中的氢原子被其它原子或原子团取代而生成的一系列化合物。 碳碳双键
( ) 1、乙醇与钠的反应注意 Ⅰ.断O-H键,发生置换反应
Ⅱ.氢原子活泼性:酸>水>醇
Ⅲ.此反应可检验—OH的存在,可计算分子中—OH数目 ( —OH 与H2的物质的量之比为2:1)2、氧化反应① 燃烧(完全氧化)现象:发出淡蓝色火焰,并放出大量热 实验现象:红热的铜丝,移离火焰 ,迅速伸入乙醇中,铜丝 ,反复多次产生 气味。铜丝变黑变红产生刺激性气味CH3CHO 乙醛+ H2O 总反应方程式:②①①+②×2变黑又变红刺激性 乙醇催化氧化规律:去掉—OH上的H和—OH所在碳原子上的H乙醇催化氧化机理:①②③④⑤乙醛的结构式结构简式 CH3CHO 人喝酒后会产生恶心欲吐、昏迷不适等醉酒症状。你知道酒精中毒的罪魁祸首是什么吗?你知道吗? 乙醛的毒性是乙醇的10倍。高浓度乙醛有麻醉作用,使体内某些反应停止,部分组织坏死。从而令人头晕头痛、嗜睡昏迷。 伤及肝脏、心脑血管及脑神经系统。是乙醇在体内氧化后的产物乙醛!乙醇乙醛乙酸CO2+H2O世界卫生组织的事故调查显示,大约50%-60%的交通事故与酒后驾驶有关。 ③与强氧化剂反应1)完全氧化(燃烧反应)
C2H6O + 3O2 → 2CO2 + 3H2O
2)催化氧化——氧化成乙醛
3)与强氧化剂反应——直接氧化成乙酸
被酸性高锰酸钾或重铬酸钾溶液等强氧化剂直接氧化为乙酸点燃小结:乙醇的几种不同氧化方式课堂反馈乙醇分子中不同的化学键如图:
化学反应中乙醇的断键位置
(1)与活泼金属反应键 断裂
(2) CH3CH2OH 燃烧键 断裂
(3)在Cu或Ag催化下和O2反应键 断裂①②③④⑤①① ③全部作燃料 —— 飞机、汽车、火锅、酒精灯等作消毒剂 —— 医用酒精等乙醇的用途制酒精型饮料工业制取乙酸本节重点知识你掌握了吗?1、下列物质可使酸性高锰酸钾溶液褪色, 不
能使溴水褪色的是( )
A、甲烷 B、乙烯
C、乙醇 D、苯C练 习 2、比较乙烷和乙醇的结构,下列说法错误的是( )
A.两个碳原子都以单键相连
B.分子里都含有6个完全相同的氢原子
C. 乙醇可以看成是乙烷分子中的一个氢原子被羟基取代后的产物
D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼 B 3、等物质的量的下列醇与足量的金属钠反应,产生气体最多的是( )
A.CH3OH B. C2H5OH
C.CH2 CH CH2 D. CH2 CH2
OHOHOHOHOH能力提升C4.丙烯醇(CH2=CHCH2OH)可跟哪些物质发生化学反应 ( )
①溴水 ②钠 ③氧气 ④酸性高锰酸钾溶液
A.只有②③④ B.只有②③
C.只有①③ D.全部
能力提升D1.?教材P76-1.2.3.8,及新学案第一课时。
2.?调查酗酒的危害性,对此提出你的建议或看法。
3.去图书馆或上网查阅乙醇的工业制法。作业布置 再见谢谢!
