粤教版九年级下册化学8.2常见的酸和碱(共36张PPT)
文档属性
| 名称 | 粤教版九年级下册化学8.2常见的酸和碱(共36张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 7.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-04 14:54:19 | ||
图片预览







文档简介
(共36张PPT)
CH3COOH
果 酸
8.2 常见的酸和碱
第一课时
学习目标
1、知道几种常见酸和碱的主要性质和用途
2、了解浓硫酸的吸水性、脱水性和强腐蚀性。
3、了解浓硫酸稀释的实验方法。
上节回顾
1.酸能使紫色石蕊试液变 色,不能使无色酚酞变色;碱能使紫色石蕊试液变 色,使无色酚酞变 色。
2.溶液的酸碱度通常用 表示。pH<7时,溶液显 性;
pH=7时,溶液显 性;
pH>7时,溶液显 性。
红
红
蓝
pH
碱
中
酸
强调
酸性溶液不一定是酸,如NH4Cl溶液
碱性溶液不一定是碱,如Na2CO3溶液
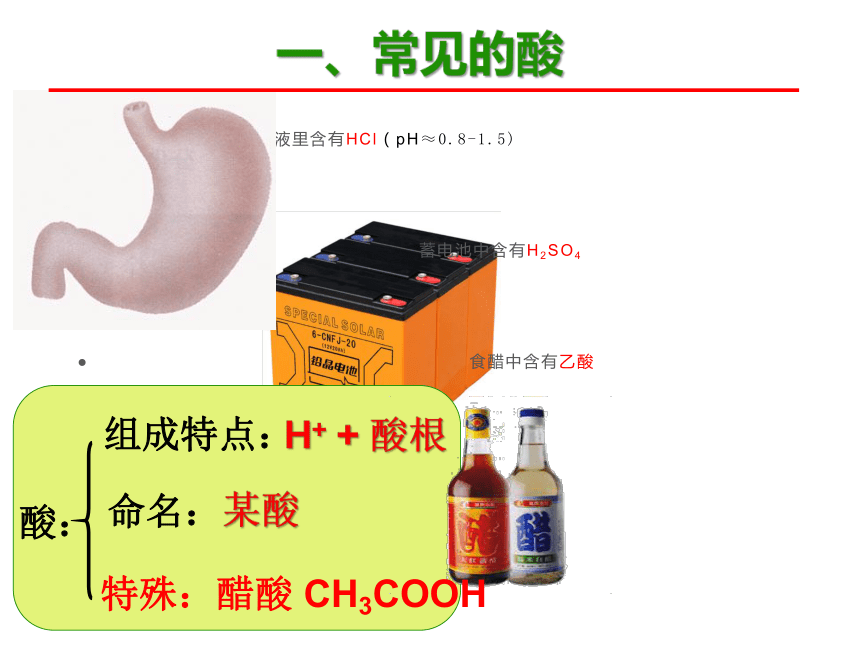
胃液里含有HCl(pH≈0.8-1.5)
蓄电池中含有H2SO4
食醋中含有乙酸
一、常见的酸
酸:
组成特点:
命名:
某酸
H+ + 酸根
特殊:醋酸 CH3COOH
硝酸
盐酸
硫酸
一、常见的酸
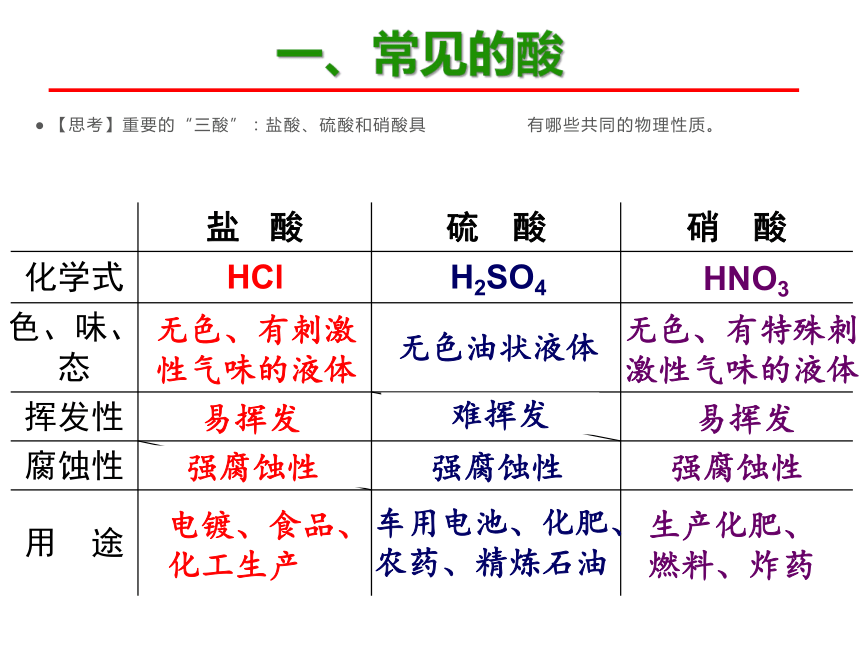
【思考】重要的“三酸”:盐酸、硫酸和硝酸具 有哪些共同的物理性质。
盐 酸 硫 酸 硝 酸
化学式
色、味、态
挥发性
腐蚀性
用 途
HCl
H2SO4
HNO3
无色、有刺激性气味的液体
无色油状液体
无色、有特殊刺激性气味的液体
易挥发
易挥发
强腐蚀性
电镀、食品、化工生产
车用电池、化肥、农药、精炼石油
生产化肥、燃料、炸药
强腐蚀性
一、常见的酸
强腐蚀性
难挥发
【小组讨论】1、在一个倒置钟罩内放置甲、乙两个小烧杯。甲烧杯中盛有浓盐酸,乙烧杯中盛有紫色石蕊溶液。一段时间后将会观察到______________________,这是因为_________________________________________ ____________________________________________________________________________
2、将一定质量的浓盐酸敞口放置,数天后,浓盐酸的质量分数发生怎样的变化?
浓HCl有挥发性,易挥发出溶质,溶质的质量减少,溶质的质量分数减小。
乙烧杯中紫色石蕊变红
浓HCl易挥发,挥发出的氯化氢气体
分子扩散到乙烧杯溶液中,紫色石蕊
溶液遇酸变红。
操作:
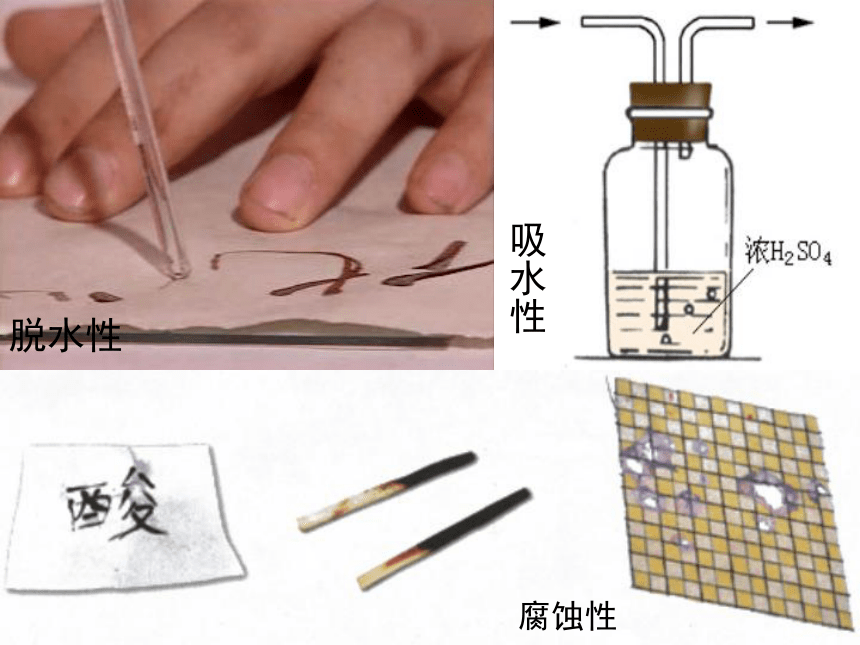
(1)用蘸有浓硫酸的玻璃棒,在放于表面皿中的纸上写字,观察变化。
(2)在表面皿上放置一小块肉皮,往肉皮上滴一些浓硫酸。
(3)取10g蔗糖放入烧杯中,加少量水使它润湿后,注入10mL浓硫酸,搅拌,观察现象。
二、浓硫酸的特性(难点)
【观察活动】
目的:学习浓硫酸的特性
脱水性
吸水性
腐蚀性
1、浓硫酸很快使蔗糖、纸张等脱水,变成碳,可见它有很强的脱水性。
脱水性
吸水性
强腐蚀性
C
H
O
H
二、浓硫酸的特性(难点)
这是一个化学变化
浓H2SO4
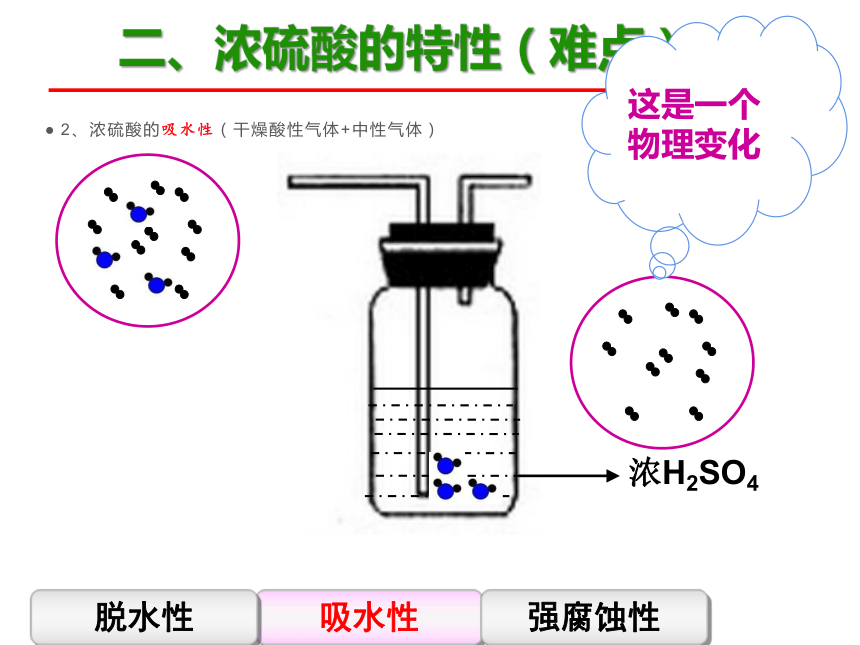
2、浓硫酸的吸水性(干燥酸性气体+中性气体)
吸水性
脱水性
强腐蚀性
二、浓硫酸的特性(难点)
这是一个物理变化
3、浓硫酸的强腐蚀性
浓硫酸有强腐蚀性,如果不慎沾上浓硫酸,应立即用布拭去,再用大量水冲洗。
浓硫酸是危险品,保管和使用都要格外小心。
强腐蚀性
吸水性
脱水性
二、浓硫酸的特性(难点)
【小组讨论】浓硫酸长期放置,质量分数如何变化。
二、浓硫酸的特性(难点)
因为浓硫酸有吸水性,长期敞口放置易吸收空气中水分,溶剂质量增加,溶液质量增加,溶质的质量分数减小 。
【观察活动】
1、为什么不能这样稀释浓硫酸?(提示信息:a水的密度小于浓硫酸的密度。b浓硫酸溶解时放出大量的热。)
三、浓硫酸的稀释(重点)
【观察活动】
2、浓硫酸的正确稀释
将浓硫酸沿着杯壁,缓慢地注入水中,并不停搅拌。
三、浓硫酸的稀释(重点)
酸入水,沿器壁,慢慢倒,不断搅。
1、如图,打开分液漏斗活塞,让水滴入锥形瓶中,可以看到锥形瓶中出现_____________________ ___________________的现象,同时U型管中乙处___________。这个事实告诉我们:为了防止发生事故,在稀释浓硫酸时,一定要_____________________________,并不断搅拌。
水浮在浓硫酸上,立即
沸腾,硫酸滴液飞溅
水面上升
将浓硫酸沿着杯壁慢慢注入水中
翠花,上小菜~
0.5℃
173℃
稀释浓硫酸时为什么会产生大量热量
Q吸 < Q放
粒子扩散
粒子水合
2.下列物质敞口放一段时间,质量会减少的是 ( )
A.浓硫酸 B.大理石
C.稀硫酸 D.浓盐酸
D
B
3.下列叙述正确的是 ( )
A.打开浓盐酸的试剂瓶盖,瓶口出现白烟
B.用浓硫酸在白纸上写字,白纸上的字迹慢慢变黑
C.把鼻孔凑到容器口闻气体的气味
D.稀硫酸沾到皮肤或衣服上,处理无需处理
翠花,上小菜~
*
4、
(1)用 ________画了一只猫;
(2)使白纸出现黑猫的物质是_______;表现该物质具有______性。
稀硫酸
浓硫酸
脱水
翠花,上小菜~
作业,你别跑!
1.复习本节课所学知识;
2.完成同步练习册P26练习1中第1、2、3、7、8题;
P28 练习2中第1、3、6。
第二课时
8.2 常见的酸和碱
学习目标
1、知道几种常见酸 主要性质和用途。
2、掌握稀酸的化学性质。
3、初步认识酸的化学反应类型。
上节回顾
1.化学中最重要的三酸?
2.浓硫酸具有哪些特性?其中哪些是化学变化?
HCl
HNO3
H2SO4
3.稀释浓硫酸应该如何操作?
有两瓶未贴标签的稀HCl和NaCl溶液(中性溶液),请同学们想想有哪些方法可以鉴别出来?
你提出的这些方案的依据什么?
你的方案一:用紫色石蕊溶液
依据:紫色石蕊遇酸性溶液变红色
加紫色
石蕊溶液 加无色
酚酞溶液
稀HCl
稀H2SO4
结论:酸能使紫色石蕊试液变红;
使无色酚酞试液不变色(仍为无色)
变红色
变红色
不变色
不变色
1、酸与指示剂的作用
使紫色的石蕊溶液变红色,但不能使无色的酚酞溶液变色。这是稀酸的化学通性之一。
你的方案二:用较活泼的金属来鉴别
依据:金属活动顺序,排在酸前面的金属能 置换出酸中的氢
2、酸与活泼金属反应
与稀盐酸反应 与稀硫酸反应
镁 现象
反应的化学方程式
锌 现象
反应的化学方程式
铁 现象
反应的化学方程式
铜 现象
观察,发现上述化学反应方程式有什么特点?
不反应
不反应
剧烈反应,产生大量气泡
剧烈反应,产生大量气泡
反应较剧烈,产生较多气泡
反应比较慢,产生少量气泡
反应比较慢,产生少量气泡
Mg +2 HCl = MgCl2 + H2↑
Zn +2 HCl = ZnCl2 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Fe + H2SO4 = FeSO4 + H2↑
Fe +2 HCl = FeCl2 + H2↑
反应较剧烈,产生较多气泡
2、酸与活泼金属反应
例如:较活泼金属(如铁)跟稀硫酸的置换反应:
Fe + H2SO4 = FeSO4 + H2 ↑
(金属) (酸) (盐) (氢气)
FeSO4
这类由 金属离子 和 酸 根离子 组成的化合物通称为盐。
FeSO4
Fe 2+
SO4 2-
+
(金属离子)
(酸根离子)
CuSO4、CaCO3、NaCl、KNO3等均属于盐。
化学方程式:
Mg + 2HCl = MgCl2 + H2 ↑
Zn + 2HCl = ZnCl2 + H2 ↑
2Al + 3 H2SO4 = Al2(SO4)3 + 3 H2 ↑
(金属) (酸) (盐) (氢气)
硝酸性质较特殊它与金属反应时,一般不生成氢气,而是氮氧化物
2、酸与活泼金属反应
结论:酸能跟较活泼金属(如镁、铝、锌和铁)
发生置换反应,放出氢气,并生成盐。
酸 + 较活泼金属 盐 + 氢气
有两瓶未贴标签的稀HCl和NaCl溶液(中性溶液),请同学们想想有哪些方法可以鉴别出来?
你还知道方案三么?
你的方案三:用金属氧化物来鉴别
【实验1】在试管中,加入少量氧化铜粉末,再加入约2ml稀硫酸,在酒精灯上加热,不停振荡,观察变化现象。
现象:黑色粉末逐渐减少,无色溶液变蓝色。
化学方程式:
CuO + H2SO4 = Cu SO4 + H2O
(金属氧化物)(酸) (盐) (水)
【实验2】 把生锈的铁钉浸入盛有稀硫酸溶液的试管中,过一段时间后,取出,洗净,并观察它的变化
现象:铁锈消失,同时无色溶液变黄色。
化学方程式:
Fe2O3 + 3 H2SO4 = Fe2(SO4)3 + 3H2O
(金属氧化物)(酸) (盐) (水)
3、酸与金属氧化物反应
结论:酸能跟某些金属氧化物反应,生成盐和水
酸 + 金属氧化物 盐 + 水
4、酸与某些盐反应
拓展:将稀盐酸与硝酸银进行实验
现象:生成白色沉淀(此实验常用于检验Cl- 阅读 P231)。
化学方程式:
HCl + AgNO3 = AgCl ↓ + HNO3
(酸) (盐) (新盐) (新酸)
2HCl + CaCO3 = CaCl2 + H2O+CO2 ↑
2HCl + CaCO3 = CaCl2 + H2CO3
∟ H2O+CO2 ↑
回顾:实验室制备二氧化碳的化学反应:
(酸) (盐) (新盐) (新酸)
结论:酸能跟某些盐反应,生成其他酸和盐。
长话短说——酸的化学通性
项目 反应情况
1.使紫色石蕊溶液 变红
2.跟活泼金属 发生置换反应,放出氢气,并生成盐。
3.跟金属氧化物 发生反应生成盐和水。
4.跟某些盐 发生反应生成新酸和新盐
作业,你别跑!
1.复习本节课所学知识;
2.完成同步练习册P26练习1及 P28 练习2 剩余题目。
CH3COOH
果 酸
8.2 常见的酸和碱
第一课时
学习目标
1、知道几种常见酸和碱的主要性质和用途
2、了解浓硫酸的吸水性、脱水性和强腐蚀性。
3、了解浓硫酸稀释的实验方法。
上节回顾
1.酸能使紫色石蕊试液变 色,不能使无色酚酞变色;碱能使紫色石蕊试液变 色,使无色酚酞变 色。
2.溶液的酸碱度通常用 表示。pH<7时,溶液显 性;
pH=7时,溶液显 性;
pH>7时,溶液显 性。
红
红
蓝
pH
碱
中
酸
强调
酸性溶液不一定是酸,如NH4Cl溶液
碱性溶液不一定是碱,如Na2CO3溶液
胃液里含有HCl(pH≈0.8-1.5)
蓄电池中含有H2SO4
食醋中含有乙酸
一、常见的酸
酸:
组成特点:
命名:
某酸
H+ + 酸根
特殊:醋酸 CH3COOH
硝酸
盐酸
硫酸
一、常见的酸
【思考】重要的“三酸”:盐酸、硫酸和硝酸具 有哪些共同的物理性质。
盐 酸 硫 酸 硝 酸
化学式
色、味、态
挥发性
腐蚀性
用 途
HCl
H2SO4
HNO3
无色、有刺激性气味的液体
无色油状液体
无色、有特殊刺激性气味的液体
易挥发
易挥发
强腐蚀性
电镀、食品、化工生产
车用电池、化肥、农药、精炼石油
生产化肥、燃料、炸药
强腐蚀性
一、常见的酸
强腐蚀性
难挥发
【小组讨论】1、在一个倒置钟罩内放置甲、乙两个小烧杯。甲烧杯中盛有浓盐酸,乙烧杯中盛有紫色石蕊溶液。一段时间后将会观察到______________________,这是因为_________________________________________ ____________________________________________________________________________
2、将一定质量的浓盐酸敞口放置,数天后,浓盐酸的质量分数发生怎样的变化?
浓HCl有挥发性,易挥发出溶质,溶质的质量减少,溶质的质量分数减小。
乙烧杯中紫色石蕊变红
浓HCl易挥发,挥发出的氯化氢气体
分子扩散到乙烧杯溶液中,紫色石蕊
溶液遇酸变红。
操作:
(1)用蘸有浓硫酸的玻璃棒,在放于表面皿中的纸上写字,观察变化。
(2)在表面皿上放置一小块肉皮,往肉皮上滴一些浓硫酸。
(3)取10g蔗糖放入烧杯中,加少量水使它润湿后,注入10mL浓硫酸,搅拌,观察现象。
二、浓硫酸的特性(难点)
【观察活动】
目的:学习浓硫酸的特性
脱水性
吸水性
腐蚀性
1、浓硫酸很快使蔗糖、纸张等脱水,变成碳,可见它有很强的脱水性。
脱水性
吸水性
强腐蚀性
C
H
O
H
二、浓硫酸的特性(难点)
这是一个化学变化
浓H2SO4
2、浓硫酸的吸水性(干燥酸性气体+中性气体)
吸水性
脱水性
强腐蚀性
二、浓硫酸的特性(难点)
这是一个物理变化
3、浓硫酸的强腐蚀性
浓硫酸有强腐蚀性,如果不慎沾上浓硫酸,应立即用布拭去,再用大量水冲洗。
浓硫酸是危险品,保管和使用都要格外小心。
强腐蚀性
吸水性
脱水性
二、浓硫酸的特性(难点)
【小组讨论】浓硫酸长期放置,质量分数如何变化。
二、浓硫酸的特性(难点)
因为浓硫酸有吸水性,长期敞口放置易吸收空气中水分,溶剂质量增加,溶液质量增加,溶质的质量分数减小 。
【观察活动】
1、为什么不能这样稀释浓硫酸?(提示信息:a水的密度小于浓硫酸的密度。b浓硫酸溶解时放出大量的热。)
三、浓硫酸的稀释(重点)
【观察活动】
2、浓硫酸的正确稀释
将浓硫酸沿着杯壁,缓慢地注入水中,并不停搅拌。
三、浓硫酸的稀释(重点)
酸入水,沿器壁,慢慢倒,不断搅。
1、如图,打开分液漏斗活塞,让水滴入锥形瓶中,可以看到锥形瓶中出现_____________________ ___________________的现象,同时U型管中乙处___________。这个事实告诉我们:为了防止发生事故,在稀释浓硫酸时,一定要_____________________________,并不断搅拌。
水浮在浓硫酸上,立即
沸腾,硫酸滴液飞溅
水面上升
将浓硫酸沿着杯壁慢慢注入水中
翠花,上小菜~
0.5℃
173℃
稀释浓硫酸时为什么会产生大量热量
Q吸 < Q放
粒子扩散
粒子水合
2.下列物质敞口放一段时间,质量会减少的是 ( )
A.浓硫酸 B.大理石
C.稀硫酸 D.浓盐酸
D
B
3.下列叙述正确的是 ( )
A.打开浓盐酸的试剂瓶盖,瓶口出现白烟
B.用浓硫酸在白纸上写字,白纸上的字迹慢慢变黑
C.把鼻孔凑到容器口闻气体的气味
D.稀硫酸沾到皮肤或衣服上,处理无需处理
翠花,上小菜~
*
4、
(1)用 ________画了一只猫;
(2)使白纸出现黑猫的物质是_______;表现该物质具有______性。
稀硫酸
浓硫酸
脱水
翠花,上小菜~
作业,你别跑!
1.复习本节课所学知识;
2.完成同步练习册P26练习1中第1、2、3、7、8题;
P28 练习2中第1、3、6。
第二课时
8.2 常见的酸和碱
学习目标
1、知道几种常见酸 主要性质和用途。
2、掌握稀酸的化学性质。
3、初步认识酸的化学反应类型。
上节回顾
1.化学中最重要的三酸?
2.浓硫酸具有哪些特性?其中哪些是化学变化?
HCl
HNO3
H2SO4
3.稀释浓硫酸应该如何操作?
有两瓶未贴标签的稀HCl和NaCl溶液(中性溶液),请同学们想想有哪些方法可以鉴别出来?
你提出的这些方案的依据什么?
你的方案一:用紫色石蕊溶液
依据:紫色石蕊遇酸性溶液变红色
加紫色
石蕊溶液 加无色
酚酞溶液
稀HCl
稀H2SO4
结论:酸能使紫色石蕊试液变红;
使无色酚酞试液不变色(仍为无色)
变红色
变红色
不变色
不变色
1、酸与指示剂的作用
使紫色的石蕊溶液变红色,但不能使无色的酚酞溶液变色。这是稀酸的化学通性之一。
你的方案二:用较活泼的金属来鉴别
依据:金属活动顺序,排在酸前面的金属能 置换出酸中的氢
2、酸与活泼金属反应
与稀盐酸反应 与稀硫酸反应
镁 现象
反应的化学方程式
锌 现象
反应的化学方程式
铁 现象
反应的化学方程式
铜 现象
观察,发现上述化学反应方程式有什么特点?
不反应
不反应
剧烈反应,产生大量气泡
剧烈反应,产生大量气泡
反应较剧烈,产生较多气泡
反应比较慢,产生少量气泡
反应比较慢,产生少量气泡
Mg +2 HCl = MgCl2 + H2↑
Zn +2 HCl = ZnCl2 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Fe + H2SO4 = FeSO4 + H2↑
Fe +2 HCl = FeCl2 + H2↑
反应较剧烈,产生较多气泡
2、酸与活泼金属反应
例如:较活泼金属(如铁)跟稀硫酸的置换反应:
Fe + H2SO4 = FeSO4 + H2 ↑
(金属) (酸) (盐) (氢气)
FeSO4
这类由 金属离子 和 酸 根离子 组成的化合物通称为盐。
FeSO4
Fe 2+
SO4 2-
+
(金属离子)
(酸根离子)
CuSO4、CaCO3、NaCl、KNO3等均属于盐。
化学方程式:
Mg + 2HCl = MgCl2 + H2 ↑
Zn + 2HCl = ZnCl2 + H2 ↑
2Al + 3 H2SO4 = Al2(SO4)3 + 3 H2 ↑
(金属) (酸) (盐) (氢气)
硝酸性质较特殊它与金属反应时,一般不生成氢气,而是氮氧化物
2、酸与活泼金属反应
结论:酸能跟较活泼金属(如镁、铝、锌和铁)
发生置换反应,放出氢气,并生成盐。
酸 + 较活泼金属 盐 + 氢气
有两瓶未贴标签的稀HCl和NaCl溶液(中性溶液),请同学们想想有哪些方法可以鉴别出来?
你还知道方案三么?
你的方案三:用金属氧化物来鉴别
【实验1】在试管中,加入少量氧化铜粉末,再加入约2ml稀硫酸,在酒精灯上加热,不停振荡,观察变化现象。
现象:黑色粉末逐渐减少,无色溶液变蓝色。
化学方程式:
CuO + H2SO4 = Cu SO4 + H2O
(金属氧化物)(酸) (盐) (水)
【实验2】 把生锈的铁钉浸入盛有稀硫酸溶液的试管中,过一段时间后,取出,洗净,并观察它的变化
现象:铁锈消失,同时无色溶液变黄色。
化学方程式:
Fe2O3 + 3 H2SO4 = Fe2(SO4)3 + 3H2O
(金属氧化物)(酸) (盐) (水)
3、酸与金属氧化物反应
结论:酸能跟某些金属氧化物反应,生成盐和水
酸 + 金属氧化物 盐 + 水
4、酸与某些盐反应
拓展:将稀盐酸与硝酸银进行实验
现象:生成白色沉淀(此实验常用于检验Cl- 阅读 P231)。
化学方程式:
HCl + AgNO3 = AgCl ↓ + HNO3
(酸) (盐) (新盐) (新酸)
2HCl + CaCO3 = CaCl2 + H2O+CO2 ↑
2HCl + CaCO3 = CaCl2 + H2CO3
∟ H2O+CO2 ↑
回顾:实验室制备二氧化碳的化学反应:
(酸) (盐) (新盐) (新酸)
结论:酸能跟某些盐反应,生成其他酸和盐。
长话短说——酸的化学通性
项目 反应情况
1.使紫色石蕊溶液 变红
2.跟活泼金属 发生置换反应,放出氢气,并生成盐。
3.跟金属氧化物 发生反应生成盐和水。
4.跟某些盐 发生反应生成新酸和新盐
作业,你别跑!
1.复习本节课所学知识;
2.完成同步练习册P26练习1及 P28 练习2 剩余题目。
