粤教版九年级下册化学8.4常用的盐(共51张PPT)
文档属性
| 名称 | 粤教版九年级下册化学8.4常用的盐(共51张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 19.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-04 15:00:38 | ||
图片预览










文档简介
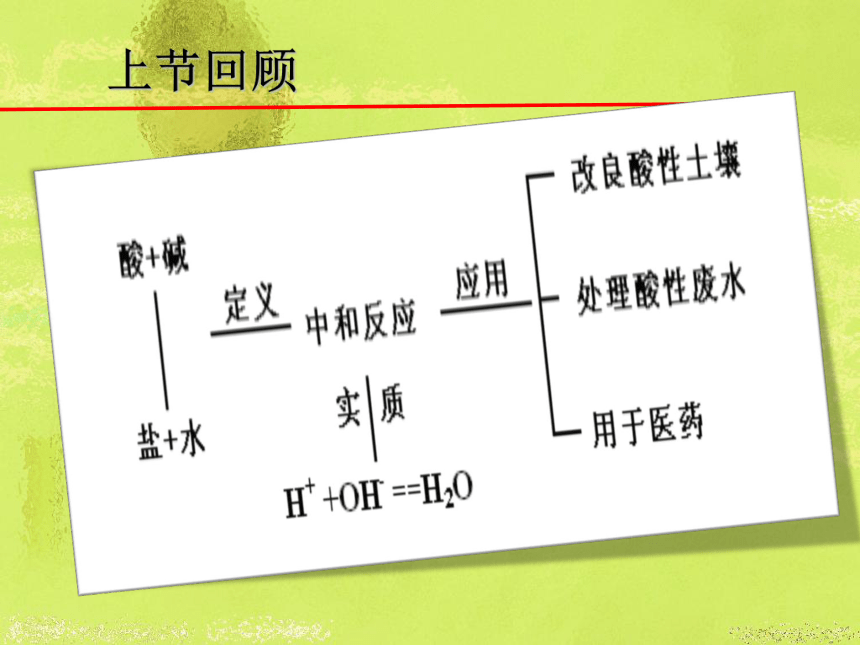
课件51张PPT。8.4 常见的盐上节回顾1.了解食盐、纯碱、碳酸钙和碳酸氢钠的性状及在日常生活中的用途。
2.了解盐的组成特点及其化学通性,了解硫酸根离子的检验方法。
3.了解复分解反应发生条件,学会判断复分解汾阳能否发生。学习目标盐的组成例如: 这类由 金属离子 和 酸 根离子 组成的化合物通称为盐。 FeSO4Fe 2+SO4 2-+(金属离子)(酸根离子)CuSO4、CaCO3、NaCl、KNO3等均属于盐。 常见的盐明矾晶体 用钡餐观察
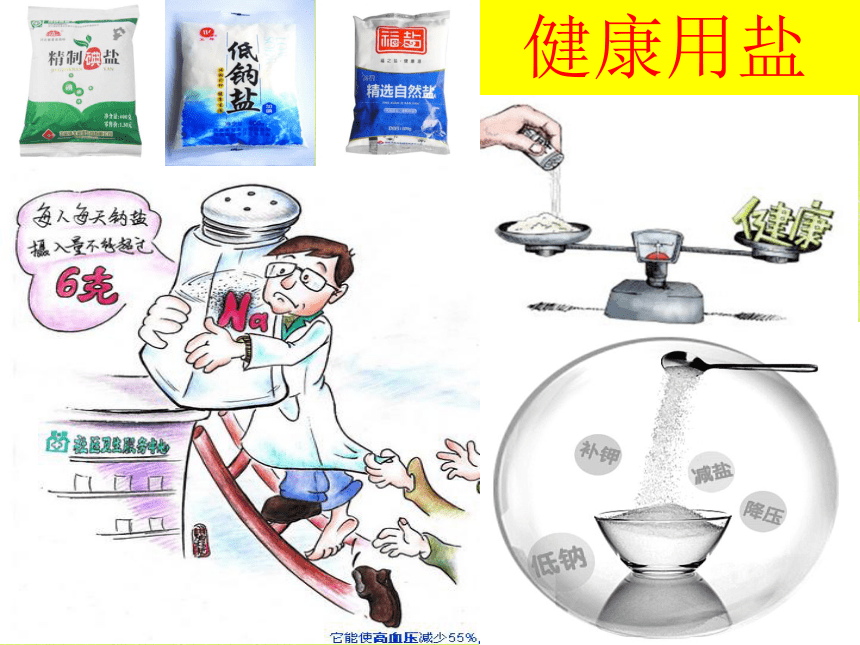
肠内情况 石盐标本 五水硫酸铜晶体 食盐一、认识几种常见的盐食盐的用途 氯化钠日常生活用于调味和腌菜、肉,医药上的生理盐水0.9%的氯化钠溶液,工业上是化工原料,制取氯气、盐酸、纯碱。健康用盐2、碳酸钙(CaCO3)白色粉末,不溶于水大理石和石灰石的主要成分一、认识几种常见的盐CaCO3+2HCl=CaCl2+H2O+CO2↑(1)碳酸钙与酸反应(2)碳酸钙高温分解(实验室制二氧化碳的原理)(工业上高温煅烧石灰石,制得生石灰和二氧化碳)用途——重要的建筑材料,是炼铁、制造水泥等工业原料一、认识几种常见的盐⑴ 白色粉末,易溶于水。3、碳酸钠(Na2CO3) 实验1:往碳酸钠溶液中滴入酚酞试剂,发现什么现
象?说明什么? 溶液变红,说明碳酸钠溶液呈碱性⑵ 碳酸钠的水溶液呈碱性。2HCl+Na2CO3==2NaCl+H2O+CO2↑实验2:往碳酸钠溶液中滴加盐酸,观察现象。俗名:纯碱、苏打纯碱的用途 4. NaHCO3一、认识几种常见的盐俗名:小苏打白色粉末 可溶于水,溶液显碱性 首先在面粉里放些水,再加上酵母、糖和NaHCO3,和匀后盖起来,让它发酵。酵母遇到潮湿的面团,它们把面粉里的淀粉分解成葡萄糖、有机酸和二氧化碳,有机酸和NaHCO3 反应放出二氧化碳。这些二氧化碳都想从面团里跑出来,可是粘韧的面团把它们阻拦住了。慢慢地二氧化碳气体越来越多,把面团顶了起来,于是,面团就发胖胀大了。等面团发酵好了,做成一个个馒头,上蒸笼去蒸
馒头里的二氧化碳气体,受热后膨胀起来,最后从面团里跑出来,馒头里留下了无数的小洞,馒头蒸熟了,也就变得又大又松了。原来,馒头里的小洞,都是二氧化碳居住过的小房子。
馒头里的“小房子”是谁造的?碳酸氢钠的用途Na2SO4
K2CO3
Mg(NO3)2
FeCl3
NH4Cl阴离子是酸根离子根据阳离子不同,盐可以分为钠盐、钾盐、镁盐、铁盐、铵盐等。根据阴离子不同,盐可以分为硫酸盐、碳酸盐、硝酸盐、盐酸盐等。阳离子是金属离子(或铵根离子)二、盐的组成与分类不同的盐可以由对应的酸和碱发生中和反应得到NaOHH2SO4KOHMg(OH)2HNO3Fe(OH)3HClHNO3HClNaOHH2SO4Ba(OH)2H2SO4H2SO4Ca(OH)2Cu(OH)2不同的盐可以由对应的酸和碱发生中和反应得到三、盐的化学性质①金属+盐→新盐+新金属位于前面位于后面盐溶液无可溶性置换反应②盐与酸的反应
2FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaClCuSO4 + Ca(OH)2 = Cu(OH)2↓ + CaSO42HCl + CaCO3 = CaCl2 + H2CO3
∟ H2O+CO2 ↑
(酸) (盐) (新盐) (新酸)(盐) (碱) (新碱) (新盐) ④盐与盐的反应③盐与碱的反应Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl 盐1 盐2 新盐1 新盐2 复分解反应某混合物中可能含有可溶性硫酸盐,碳酸盐,及硝酸盐为了检验其中是否含有硫酸盐,某同学去少量混合物溶于水后,向其中加入氯化钡溶液,发现有白色沉淀生成。由此得出该混合物中含有硫酸盐的结论。你认为这一结论可靠吗?为什么?应该怎样检验?【实验8-15】 少量的Na2SO4溶液中滴加Ba(NO3)2溶液 少量的Na2CO3 溶液中滴加Ba(NO3)2 溶液实验现象:实验现象:化学方程式:化学方程式:产生白色沉淀。产生白色沉淀。Na2SO4+ Ba(NO3)2Na NO3 + BaSO4↓2Na2CO3+ Ba(NO3)22Na NO3 + BaCO3↓滴加稀硝酸,沉淀不溶解滴加稀硝酸,沉淀溶解。【实验8-16】【实验8-17(1)】【实验8-17(2)】某混合物中可能含有可溶性硫酸盐,碳酸盐,及硝酸盐为了检验其中是否含有硫酸盐,某同学去少量混合物溶于水后,向其中加入氯化钡溶液,发现有白色沉淀生成。由此得出该混合物中含有硫酸盐的结论。你认为这一结论可靠吗?为什么?应该怎样检验?几种常见离子的检验1.碳酸根离子的检验①滴加稀盐酸,现象:有气泡产生②通入澄清石灰水,现象:生成白色浑浊2.硫酸根离子的检验①滴加硝酸钡,现象:生成白色沉淀②滴加稀硝酸,现象:沉淀不溶解部分常用规律总结四、复分解反应 [概念回顾]酸碱盐金属氧化物中和俺和您们不一样哦盐金属1.复分解反应知识网络酸碱指示剂置换置换所有的酸、碱、盐都能两两发生复分解么?2、复分解反应的条件3H2SO4 + Fe2O3 = Fe2(SO4)3+3HCl + NaOH = NaCl + 2NaOH + CuSO4 = Na2SO4+ NaCl + AgNO3 = NaNO3 +2HCl + CaCO3 = CaCl2 + H2O+ 观察下列化学方程式,注意其反应生成物有哪些特征?H2OH2OCO2 ↑AgCl ↓ Cu(OH)2↓2、复分解反应的条件首先:反应物之间要能互溶其次:生成物中有气体、沉淀或水(1)无酸参加必须都溶于水。
(2)有酸参加可不溶水(酸不用碳酸)复分解,两头顾,先顾头,后顾尾。
顾头要看溶解性,顾尾气体、沉淀、水。有酸参加可不溶,无酸参加都要溶。 符合这样的条件为什么就能发生复分解反应呢?让我们从微观角度来看一下这些反应!酸 (H+ + 酸根离子)碱 ( 金属离子 + OH- )盐 ( 金属离子 +酸根离子)微观角度看溶液中的酸碱盐:Na+OH-H+NO3-H2ONaOH溶液和稀HNO3反应看图探究结论:
有水生成的复分解反应实质是 H+和OH-反应实质:旁观者:NO3-和Na+看图探究Na+Na+CO32-Cl-H+Cl-H+H2O碳酸钠和稀盐酸反应结论:
有co2生成的复分解反应实质是CO32-和H+反应CO2实质:旁观者:Cl-和Na+CO2看图探究Ba2+SO42-Cl-Cl-Na+Na+BaSO4氯化钡与硫酸钠反应结论:
有BaSO4沉淀生成的复分解反应实质是
Ba2+和SO42-反应实质:旁观者:Cl-和Na+小结: 由此看来,酸碱盐之间的复分解反应,实质是离子间的互换反应,两种离子之间如果能结合成难溶性的碱或盐、不稳定的酸或碱(分解放出气体)、或难电离的水,反应发生,反之,反应就不发生。 物质间发生复分解后溶液中存在哪些离子或物质呢?Ca2+、OH- H+、SO4 2 -Ca2+、SO42-反应前反应后溶液中离子种类发生改变 Ca(OH)2+ H2SO4——CaSO4+2H2O——溶液中反应的离子变化√H+、SO42-Na+、CO3 2 -Na+、SO42-反应前反应后溶液中离子种类发生改变 H2SO4+Na2CO3——Na2SO4+ + H2O——√溶液中反应的离子变化Ca2+、OH- Na+、CO3 2 -Na+、OH-反应前反应后溶液中离子种类发生改变 Ca(OH)2+ Na2CO3—— 2NaOH+——CaCO3↓√溶液中反应的离子变化 Na2SO4 + KNO3 ——K2SO4 + NaNO3×Na+、SO42- K+、NO3-K+、SO42-反应前反应后溶液中离子种类没有改变Na+、NO3-溶液中反应的离子变化复分解反应发生的条件、实质或有气体(↑)或有水(H2O)有沉淀(↓)复分解反应才能发生生成物中实质:溶液中离子种类发生改变离子种类发生了改变,数目也发生了变化,就说这样的离子不能共存下列各组物质的溶液混合后不能发生反应的是
A. NaCl和 H2SO4 B. NaOH 和HCl
C. Na2CO3 和H2SO4 D. AgNO3和NaClNa+、CO32-、H+ 、SO42-Ag+、NO3-、Na+、 Cl-Na+、Cl-、H+ 、SO42-Na+、 OH- 、H+ 、 Cl-例1.CO2 ↑ + H2O 哪些物质是难溶物质呢?口诀钾钠铵盐硝酸盐,均能溶于水中间。
硫酸盐中钡不溶,氯化盐中银不溶。 碳酸钾钠氨盐溶,氢氧钾钠钙钡溶。
常见五酸都易溶
另外:AgCl、BaSO4不仅不溶于水,而且还不溶于稀硝酸
盐的溶解性沉淀物可简要概括为:
“六白一蓝一红褐”
CO32- + Ca 2+ → CaCO3↓ 白色沉淀
CO32- + Ba 2+ → BaCO3↓ 白色沉淀
Clˉ + Ag+ → AgCl↓ 白色沉淀
SO42- + Ba 2+ → BaSO4↓ 白色沉淀
OHˉ + Mg 2+ → Mg(OH) 2↓ 白色沉淀
OHˉ + Al 3+ → Al(OH) 3↓ 白色沉淀
OHˉ + Cu 2+ → Cu(OH) 2↓ 蓝色沉淀
OHˉ + Fe 3+ → Fe(OH) 3↓ 红褐色沉淀
部分常用规律总结哑泉水之谜◆三国时,诸葛亮为了擒拿南王孟获,率军南征至云南西洱河,误饮哑泉水【含CuSO4 】,将士们全都中毒说不出话来。后来幸得一智者指教,复饮安乐泉水【Ca(OH)2】 ,“随即吐出恶涎,便能言语”。
请用化学方程式解释: CuSO4+Ca(OH)2==Cu(OH)2↓+CaSO4 练习(能反应的写出化学方程式)
1.BaCl2+H2SO4--
2.Na2CO3+ HCl --
3.K2SO4+HCl--
4.FeCl3+ NaOH--
5.KCl+AgNO3--
6.K2SO4+NaNO3--
7.Fe(OH)3+ HNO3--
8.Ba(OH)2+ HCl--BaSO4↓+2HClAgCl↓+ KNO3A.HCl 和 Ca(OH)2B.Na2CO3 和 H2SO4C.Ca(OH)2 和 Na2CO3 D.KCl 和 CuSO4A.在复分解反应中,没有单质参与
B.化合反应一定要加热
C.置换反应一定有新的单质生成
D.中和反应一定有水生成D B 识的提高,市场上出现了“加碘盐”、“叶绿素锌钠盐”、“低
钠盐”等。某种低钠盐由 NaCl、KCl、MgSO4 三种物质组成,用
它进行以下实验(假设每步均恰好完全反应)。(1)写出步骤①的化学方程式:______________________。
(2)当 X 是 AgNO3 时,白色沉淀 C 是______,其化学方程
式是:__________________________________(写其中的一条)。
当 X 是 NaOH 时,白色沉淀 C 是__________,其化学方程式是:
___________________________________。5.食盐是人们生活中不可缺少的调味剂,随着人们健康意MgSO4+BaCl2===MgCl2+BaSO4↓ AgCl NaCl+AgNO3===AgCl↓+NaNO3 Mg(OH)2 MgCl2+2NaOH===Mg(OH)2↓+2NaCl
2.了解盐的组成特点及其化学通性,了解硫酸根离子的检验方法。
3.了解复分解反应发生条件,学会判断复分解汾阳能否发生。学习目标盐的组成例如: 这类由 金属离子 和 酸 根离子 组成的化合物通称为盐。 FeSO4Fe 2+SO4 2-+(金属离子)(酸根离子)CuSO4、CaCO3、NaCl、KNO3等均属于盐。 常见的盐明矾晶体 用钡餐观察
肠内情况 石盐标本 五水硫酸铜晶体 食盐一、认识几种常见的盐食盐的用途 氯化钠日常生活用于调味和腌菜、肉,医药上的生理盐水0.9%的氯化钠溶液,工业上是化工原料,制取氯气、盐酸、纯碱。健康用盐2、碳酸钙(CaCO3)白色粉末,不溶于水大理石和石灰石的主要成分一、认识几种常见的盐CaCO3+2HCl=CaCl2+H2O+CO2↑(1)碳酸钙与酸反应(2)碳酸钙高温分解(实验室制二氧化碳的原理)(工业上高温煅烧石灰石,制得生石灰和二氧化碳)用途——重要的建筑材料,是炼铁、制造水泥等工业原料一、认识几种常见的盐⑴ 白色粉末,易溶于水。3、碳酸钠(Na2CO3) 实验1:往碳酸钠溶液中滴入酚酞试剂,发现什么现
象?说明什么? 溶液变红,说明碳酸钠溶液呈碱性⑵ 碳酸钠的水溶液呈碱性。2HCl+Na2CO3==2NaCl+H2O+CO2↑实验2:往碳酸钠溶液中滴加盐酸,观察现象。俗名:纯碱、苏打纯碱的用途 4. NaHCO3一、认识几种常见的盐俗名:小苏打白色粉末 可溶于水,溶液显碱性 首先在面粉里放些水,再加上酵母、糖和NaHCO3,和匀后盖起来,让它发酵。酵母遇到潮湿的面团,它们把面粉里的淀粉分解成葡萄糖、有机酸和二氧化碳,有机酸和NaHCO3 反应放出二氧化碳。这些二氧化碳都想从面团里跑出来,可是粘韧的面团把它们阻拦住了。慢慢地二氧化碳气体越来越多,把面团顶了起来,于是,面团就发胖胀大了。等面团发酵好了,做成一个个馒头,上蒸笼去蒸
馒头里的二氧化碳气体,受热后膨胀起来,最后从面团里跑出来,馒头里留下了无数的小洞,馒头蒸熟了,也就变得又大又松了。原来,馒头里的小洞,都是二氧化碳居住过的小房子。
馒头里的“小房子”是谁造的?碳酸氢钠的用途Na2SO4
K2CO3
Mg(NO3)2
FeCl3
NH4Cl阴离子是酸根离子根据阳离子不同,盐可以分为钠盐、钾盐、镁盐、铁盐、铵盐等。根据阴离子不同,盐可以分为硫酸盐、碳酸盐、硝酸盐、盐酸盐等。阳离子是金属离子(或铵根离子)二、盐的组成与分类不同的盐可以由对应的酸和碱发生中和反应得到NaOHH2SO4KOHMg(OH)2HNO3Fe(OH)3HClHNO3HClNaOHH2SO4Ba(OH)2H2SO4H2SO4Ca(OH)2Cu(OH)2不同的盐可以由对应的酸和碱发生中和反应得到三、盐的化学性质①金属+盐→新盐+新金属位于前面位于后面盐溶液无可溶性置换反应②盐与酸的反应
2FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaClCuSO4 + Ca(OH)2 = Cu(OH)2↓ + CaSO42HCl + CaCO3 = CaCl2 + H2CO3
∟ H2O+CO2 ↑
(酸) (盐) (新盐) (新酸)(盐) (碱) (新碱) (新盐) ④盐与盐的反应③盐与碱的反应Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl 盐1 盐2 新盐1 新盐2 复分解反应某混合物中可能含有可溶性硫酸盐,碳酸盐,及硝酸盐为了检验其中是否含有硫酸盐,某同学去少量混合物溶于水后,向其中加入氯化钡溶液,发现有白色沉淀生成。由此得出该混合物中含有硫酸盐的结论。你认为这一结论可靠吗?为什么?应该怎样检验?【实验8-15】 少量的Na2SO4溶液中滴加Ba(NO3)2溶液 少量的Na2CO3 溶液中滴加Ba(NO3)2 溶液实验现象:实验现象:化学方程式:化学方程式:产生白色沉淀。产生白色沉淀。Na2SO4+ Ba(NO3)2Na NO3 + BaSO4↓2Na2CO3+ Ba(NO3)22Na NO3 + BaCO3↓滴加稀硝酸,沉淀不溶解滴加稀硝酸,沉淀溶解。【实验8-16】【实验8-17(1)】【实验8-17(2)】某混合物中可能含有可溶性硫酸盐,碳酸盐,及硝酸盐为了检验其中是否含有硫酸盐,某同学去少量混合物溶于水后,向其中加入氯化钡溶液,发现有白色沉淀生成。由此得出该混合物中含有硫酸盐的结论。你认为这一结论可靠吗?为什么?应该怎样检验?几种常见离子的检验1.碳酸根离子的检验①滴加稀盐酸,现象:有气泡产生②通入澄清石灰水,现象:生成白色浑浊2.硫酸根离子的检验①滴加硝酸钡,现象:生成白色沉淀②滴加稀硝酸,现象:沉淀不溶解部分常用规律总结四、复分解反应 [概念回顾]酸碱盐金属氧化物中和俺和您们不一样哦盐金属1.复分解反应知识网络酸碱指示剂置换置换所有的酸、碱、盐都能两两发生复分解么?2、复分解反应的条件3H2SO4 + Fe2O3 = Fe2(SO4)3+3HCl + NaOH = NaCl + 2NaOH + CuSO4 = Na2SO4+ NaCl + AgNO3 = NaNO3 +2HCl + CaCO3 = CaCl2 + H2O+ 观察下列化学方程式,注意其反应生成物有哪些特征?H2OH2OCO2 ↑AgCl ↓ Cu(OH)2↓2、复分解反应的条件首先:反应物之间要能互溶其次:生成物中有气体、沉淀或水(1)无酸参加必须都溶于水。
(2)有酸参加可不溶水(酸不用碳酸)复分解,两头顾,先顾头,后顾尾。
顾头要看溶解性,顾尾气体、沉淀、水。有酸参加可不溶,无酸参加都要溶。 符合这样的条件为什么就能发生复分解反应呢?让我们从微观角度来看一下这些反应!酸 (H+ + 酸根离子)碱 ( 金属离子 + OH- )盐 ( 金属离子 +酸根离子)微观角度看溶液中的酸碱盐:Na+OH-H+NO3-H2ONaOH溶液和稀HNO3反应看图探究结论:
有水生成的复分解反应实质是 H+和OH-反应实质:旁观者:NO3-和Na+看图探究Na+Na+CO32-Cl-H+Cl-H+H2O碳酸钠和稀盐酸反应结论:
有co2生成的复分解反应实质是CO32-和H+反应CO2实质:旁观者:Cl-和Na+CO2看图探究Ba2+SO42-Cl-Cl-Na+Na+BaSO4氯化钡与硫酸钠反应结论:
有BaSO4沉淀生成的复分解反应实质是
Ba2+和SO42-反应实质:旁观者:Cl-和Na+小结: 由此看来,酸碱盐之间的复分解反应,实质是离子间的互换反应,两种离子之间如果能结合成难溶性的碱或盐、不稳定的酸或碱(分解放出气体)、或难电离的水,反应发生,反之,反应就不发生。 物质间发生复分解后溶液中存在哪些离子或物质呢?Ca2+、OH- H+、SO4 2 -Ca2+、SO42-反应前反应后溶液中离子种类发生改变 Ca(OH)2+ H2SO4——CaSO4+2H2O——溶液中反应的离子变化√H+、SO42-Na+、CO3 2 -Na+、SO42-反应前反应后溶液中离子种类发生改变 H2SO4+Na2CO3——Na2SO4+ + H2O——√溶液中反应的离子变化Ca2+、OH- Na+、CO3 2 -Na+、OH-反应前反应后溶液中离子种类发生改变 Ca(OH)2+ Na2CO3—— 2NaOH+——CaCO3↓√溶液中反应的离子变化 Na2SO4 + KNO3 ——K2SO4 + NaNO3×Na+、SO42- K+、NO3-K+、SO42-反应前反应后溶液中离子种类没有改变Na+、NO3-溶液中反应的离子变化复分解反应发生的条件、实质或有气体(↑)或有水(H2O)有沉淀(↓)复分解反应才能发生生成物中实质:溶液中离子种类发生改变离子种类发生了改变,数目也发生了变化,就说这样的离子不能共存下列各组物质的溶液混合后不能发生反应的是
A. NaCl和 H2SO4 B. NaOH 和HCl
C. Na2CO3 和H2SO4 D. AgNO3和NaClNa+、CO32-、H+ 、SO42-Ag+、NO3-、Na+、 Cl-Na+、Cl-、H+ 、SO42-Na+、 OH- 、H+ 、 Cl-例1.CO2 ↑ + H2O 哪些物质是难溶物质呢?口诀钾钠铵盐硝酸盐,均能溶于水中间。
硫酸盐中钡不溶,氯化盐中银不溶。 碳酸钾钠氨盐溶,氢氧钾钠钙钡溶。
常见五酸都易溶
另外:AgCl、BaSO4不仅不溶于水,而且还不溶于稀硝酸
盐的溶解性沉淀物可简要概括为:
“六白一蓝一红褐”
CO32- + Ca 2+ → CaCO3↓ 白色沉淀
CO32- + Ba 2+ → BaCO3↓ 白色沉淀
Clˉ + Ag+ → AgCl↓ 白色沉淀
SO42- + Ba 2+ → BaSO4↓ 白色沉淀
OHˉ + Mg 2+ → Mg(OH) 2↓ 白色沉淀
OHˉ + Al 3+ → Al(OH) 3↓ 白色沉淀
OHˉ + Cu 2+ → Cu(OH) 2↓ 蓝色沉淀
OHˉ + Fe 3+ → Fe(OH) 3↓ 红褐色沉淀
部分常用规律总结哑泉水之谜◆三国时,诸葛亮为了擒拿南王孟获,率军南征至云南西洱河,误饮哑泉水【含CuSO4 】,将士们全都中毒说不出话来。后来幸得一智者指教,复饮安乐泉水【Ca(OH)2】 ,“随即吐出恶涎,便能言语”。
请用化学方程式解释: CuSO4+Ca(OH)2==Cu(OH)2↓+CaSO4 练习(能反应的写出化学方程式)
1.BaCl2+H2SO4--
2.Na2CO3+ HCl --
3.K2SO4+HCl--
4.FeCl3+ NaOH--
5.KCl+AgNO3--
6.K2SO4+NaNO3--
7.Fe(OH)3+ HNO3--
8.Ba(OH)2+ HCl--BaSO4↓+2HClAgCl↓+ KNO3A.HCl 和 Ca(OH)2B.Na2CO3 和 H2SO4C.Ca(OH)2 和 Na2CO3 D.KCl 和 CuSO4A.在复分解反应中,没有单质参与
B.化合反应一定要加热
C.置换反应一定有新的单质生成
D.中和反应一定有水生成D B 识的提高,市场上出现了“加碘盐”、“叶绿素锌钠盐”、“低
钠盐”等。某种低钠盐由 NaCl、KCl、MgSO4 三种物质组成,用
它进行以下实验(假设每步均恰好完全反应)。(1)写出步骤①的化学方程式:______________________。
(2)当 X 是 AgNO3 时,白色沉淀 C 是______,其化学方程
式是:__________________________________(写其中的一条)。
当 X 是 NaOH 时,白色沉淀 C 是__________,其化学方程式是:
___________________________________。5.食盐是人们生活中不可缺少的调味剂,随着人们健康意MgSO4+BaCl2===MgCl2+BaSO4↓ AgCl NaCl+AgNO3===AgCl↓+NaNO3 Mg(OH)2 MgCl2+2NaOH===Mg(OH)2↓+2NaCl
