九年级化学上册 3.4 物质构成的表示式 粤教版(共21张ppt)
文档属性
| 名称 | 九年级化学上册 3.4 物质构成的表示式 粤教版(共21张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 868.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-05 09:24:58 | ||
图片预览







文档简介
3.4
物质组成的表示方法
1.化学式:
注意:每种纯净物的组成是固定不变的,所以表示每种物质组成的化学式只有一个,混合物没有化学式。
用元素符号和数字的组合来表示物质组成的式子
H2O
H2O2
水的化学式:
过氧化氢的化学式:
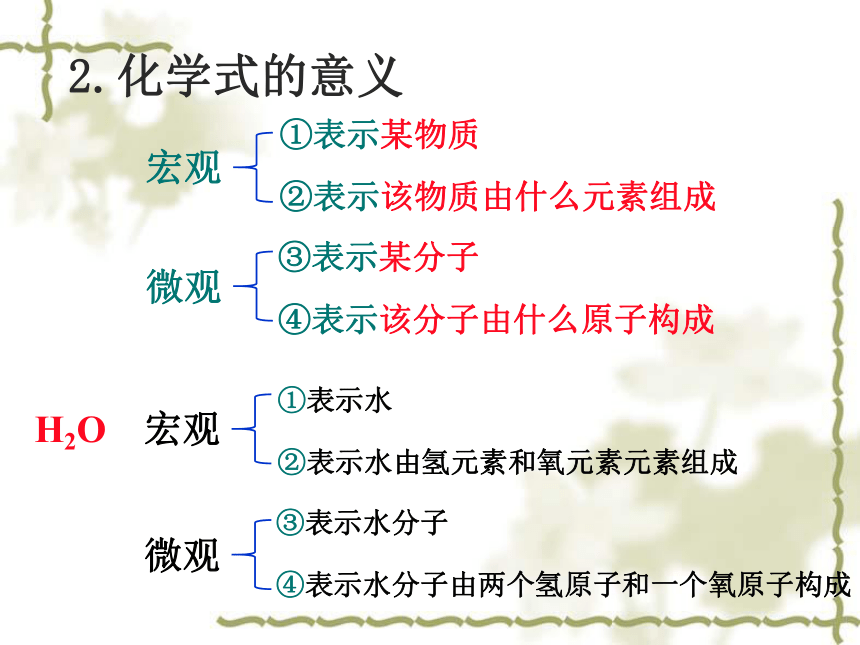
2.化学式的意义
①表示某物质
②表示该物质由什么元素组成
③表示某分子
④表示该分子由什么原子构成
H2O
①表示水
②表示水由氢元素和氧元素元素组成
③表示水分子
④表示水分子由两个氢原子和一个氧原子构成
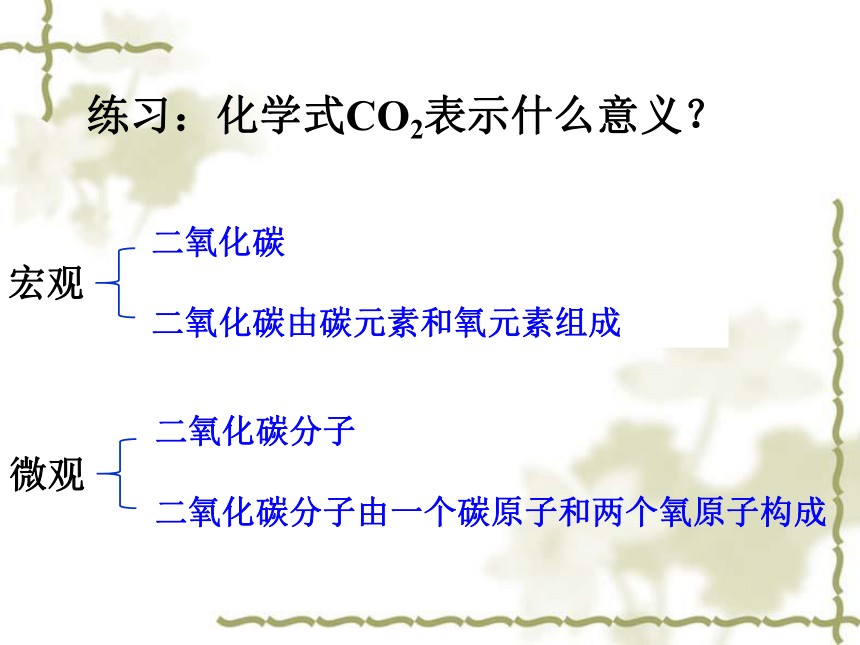
二氧化碳
二氧化碳由碳元素和氧元素组成
二氧化碳分子
二氧化碳分子由一个碳原子和两个氧原子构成
练习:化学式CO2表示什么意义?
要表示2个以上的分子时,可在化学式前面加上相应的数字。这种表示仅由微观的含义。
2O2
表示2个氧分子
4H2O
表示4个水分子
练习册 P50
铁(Fe)铜(Cu)钠(Na)汞(Hg)等
氦气(He)氖气(Ne)氩气(Ar)
碳(C)硅(Si)磷(P)硫(S)
3.单质化学式的书写:
(1)由原子直接构成的单质
a.金属
b.稀有气体
c.部分固态非金属单质
(用元素符号表示)
(2)分子构成的单质(在相应的元素符号的右下角写出分子所含原子的数目)
c.固态:碘(I2)
b.液态:溴(Br2)
a.气态非金属单质:
氢气(H2)、氧气(O2)氮气(N2)、氯气(Cl2)
1.化合价有正价和负价,金属与非金属形成化合物时,金属显正价,非金属显负价。
2.氢元素通常显+1价,氧元素通常显-2价,许多非金属元素与氧元素形成化合物时,则显正价。
3.部分金属可显不同的化合价。
4.有一些化合物中,常常含有带电的原子团,叫做根,它们常作为一个整体参加反应。
5.化合物里正负化合价代数和为0。单质中元素的化合价为0。
4.元素的化合价
(1)化合价规律
(2)化合价口诀
一价氢氯钾钠银,二价氧钙钡镁锌
三铝四硅五氮磷,二三铁,二四碳
二四六价硫齐全,铜汞二价最常见
负价:
氯负一,氧负二,氢氧根显负一价
酸根所有皆为负,一硝三磷二硫碳
化合价应标在元素符号的正上方,正负在前,数字在后
(3)表示方法
H2 O2 NaCl CO2 H2SO 4
0 0 +1 -1 +4 -2 +1 +6 -2
根据化学式进行计算
1.相对分子质量
各原子的相对原子质量的总和
注意:相对分子质量也是比值,是相对质量,单位为“1”,省略不写。
水(H2O)的相对分子质量为:
1 × 2 + 16 × 1 = 18
碳酸氢铵(NH4HCO3)的相对分子质量为:
14 × 1 + 1 × 5 + 12 × 1 + 16 × 3 = 79
2.元素的质量比
元素的质量比等于各元素的相对原子质量乘以原子个数之比
计算 H2O 中氢元素和氧元素的质量比
H : O = (1×2) : (16×1) = 2:16 = 1:8
计算 H2SO4 中各元素的质量比
H : S : O = (1×2) : (32×1) : (16×4) = 2:32:64
= 1:16:32
3.元素的质量分数
某元素的质量分数 =
该元素的相对原子质量 ×
该原子个数
化合物的相对分子质量
计算 H2O 中氧元素的质量分数
氧元素的质量分数=
氧元素的相对原子质量 ×
氧原子个数
水的相对分子质量
×100%
×100%
×100%
= 88.9%
4.元素的质量
元素的质量 = 化合物的质量 × 该元素的质量分数
计算 36g H2O 中氧元素的质量
氧元素的质量 =
水的质量 × 氧元素的质量分数
= 36g × 88.9%
= 32.0%
1.相对分子质量
各原子的相对原子质量的总和
注意:相对分子质量也是比值,是相对质量,单位为“1”,省略不写。
2.元素的质量比
元素的质量比等于各元素的相对原子质量乘以原子个数之比
(2)2KMnO4 = ____________________________
(1)CO(NH2)2 = ____________________________
(1)CO(NH2)2 中各元素的质量比
C : O : N : H =____________________________
(2)NH4 NO3中各元素的质量比
N : H : O =____________________________
3.元素的质量分数
某元素的质量分数 =
该元素的相对原子质量 ×
该原子个数
化合物的相对分子质量
×100%
(1)NH4NO3中氮元素的质量分数
(2)CO(NH2)2中氮元素的质量分数
4.元素的质量
元素的质量 = 化合物的质量 × 该元素的质量分数
(1)计算36gH2O 中氧元素的质量
(2)计算60gCO(NH2)2中氮元素的质量
H 氢元素、一个氢原子 2H 两个氢原子
O 氧元素、一个氧原子 2O 两个氧原子
N 氮元素、一个氮原子 2N 两个氮原子
Cl 氯元素、一个氯原子 2Cl 两个氯原子
H2 一个氢分子 2H2 两个氢分子
O2 一个氧分子 2O2 两个氧分子
N2 一个氮分子 2N2 两个氮分子
Cl 一个氯分子 2Cl2 两个氯分子
H+ 一个氢离子 O2- 一个氧离子
Cl- 一个氯离子 Mg2+ 一个镁离子
Cu2+ 一个铜离子 Al3+ 一个铝离子
Fe2+ 一个亚铁离子 Fe3+ 一个铁离子
OH- 一个氢氧根离子 NH4+ 一个铵根离子
NO3- 一个硝酸根离子 SO42- 一个硫酸根离子
CO32- 一个碳酸根离子
P2O5
五氧化二磷中磷元素的化合价为+5:
+5
硫酸中硫元素的化合价为+6:
H2SO4
+6
物质组成的表示方法
1.化学式:
注意:每种纯净物的组成是固定不变的,所以表示每种物质组成的化学式只有一个,混合物没有化学式。
用元素符号和数字的组合来表示物质组成的式子
H2O
H2O2
水的化学式:
过氧化氢的化学式:
2.化学式的意义
①表示某物质
②表示该物质由什么元素组成
③表示某分子
④表示该分子由什么原子构成
H2O
①表示水
②表示水由氢元素和氧元素元素组成
③表示水分子
④表示水分子由两个氢原子和一个氧原子构成
二氧化碳
二氧化碳由碳元素和氧元素组成
二氧化碳分子
二氧化碳分子由一个碳原子和两个氧原子构成
练习:化学式CO2表示什么意义?
要表示2个以上的分子时,可在化学式前面加上相应的数字。这种表示仅由微观的含义。
2O2
表示2个氧分子
4H2O
表示4个水分子
练习册 P50
铁(Fe)铜(Cu)钠(Na)汞(Hg)等
氦气(He)氖气(Ne)氩气(Ar)
碳(C)硅(Si)磷(P)硫(S)
3.单质化学式的书写:
(1)由原子直接构成的单质
a.金属
b.稀有气体
c.部分固态非金属单质
(用元素符号表示)
(2)分子构成的单质(在相应的元素符号的右下角写出分子所含原子的数目)
c.固态:碘(I2)
b.液态:溴(Br2)
a.气态非金属单质:
氢气(H2)、氧气(O2)氮气(N2)、氯气(Cl2)
1.化合价有正价和负价,金属与非金属形成化合物时,金属显正价,非金属显负价。
2.氢元素通常显+1价,氧元素通常显-2价,许多非金属元素与氧元素形成化合物时,则显正价。
3.部分金属可显不同的化合价。
4.有一些化合物中,常常含有带电的原子团,叫做根,它们常作为一个整体参加反应。
5.化合物里正负化合价代数和为0。单质中元素的化合价为0。
4.元素的化合价
(1)化合价规律
(2)化合价口诀
一价氢氯钾钠银,二价氧钙钡镁锌
三铝四硅五氮磷,二三铁,二四碳
二四六价硫齐全,铜汞二价最常见
负价:
氯负一,氧负二,氢氧根显负一价
酸根所有皆为负,一硝三磷二硫碳
化合价应标在元素符号的正上方,正负在前,数字在后
(3)表示方法
H2 O2 NaCl CO2 H2SO 4
0 0 +1 -1 +4 -2 +1 +6 -2
根据化学式进行计算
1.相对分子质量
各原子的相对原子质量的总和
注意:相对分子质量也是比值,是相对质量,单位为“1”,省略不写。
水(H2O)的相对分子质量为:
1 × 2 + 16 × 1 = 18
碳酸氢铵(NH4HCO3)的相对分子质量为:
14 × 1 + 1 × 5 + 12 × 1 + 16 × 3 = 79
2.元素的质量比
元素的质量比等于各元素的相对原子质量乘以原子个数之比
计算 H2O 中氢元素和氧元素的质量比
H : O = (1×2) : (16×1) = 2:16 = 1:8
计算 H2SO4 中各元素的质量比
H : S : O = (1×2) : (32×1) : (16×4) = 2:32:64
= 1:16:32
3.元素的质量分数
某元素的质量分数 =
该元素的相对原子质量 ×
该原子个数
化合物的相对分子质量
计算 H2O 中氧元素的质量分数
氧元素的质量分数=
氧元素的相对原子质量 ×
氧原子个数
水的相对分子质量
×100%
×100%
×100%
= 88.9%
4.元素的质量
元素的质量 = 化合物的质量 × 该元素的质量分数
计算 36g H2O 中氧元素的质量
氧元素的质量 =
水的质量 × 氧元素的质量分数
= 36g × 88.9%
= 32.0%
1.相对分子质量
各原子的相对原子质量的总和
注意:相对分子质量也是比值,是相对质量,单位为“1”,省略不写。
2.元素的质量比
元素的质量比等于各元素的相对原子质量乘以原子个数之比
(2)2KMnO4 = ____________________________
(1)CO(NH2)2 = ____________________________
(1)CO(NH2)2 中各元素的质量比
C : O : N : H =____________________________
(2)NH4 NO3中各元素的质量比
N : H : O =____________________________
3.元素的质量分数
某元素的质量分数 =
该元素的相对原子质量 ×
该原子个数
化合物的相对分子质量
×100%
(1)NH4NO3中氮元素的质量分数
(2)CO(NH2)2中氮元素的质量分数
4.元素的质量
元素的质量 = 化合物的质量 × 该元素的质量分数
(1)计算36gH2O 中氧元素的质量
(2)计算60gCO(NH2)2中氮元素的质量
H 氢元素、一个氢原子 2H 两个氢原子
O 氧元素、一个氧原子 2O 两个氧原子
N 氮元素、一个氮原子 2N 两个氮原子
Cl 氯元素、一个氯原子 2Cl 两个氯原子
H2 一个氢分子 2H2 两个氢分子
O2 一个氧分子 2O2 两个氧分子
N2 一个氮分子 2N2 两个氮分子
Cl 一个氯分子 2Cl2 两个氯分子
H+ 一个氢离子 O2- 一个氧离子
Cl- 一个氯离子 Mg2+ 一个镁离子
Cu2+ 一个铜离子 Al3+ 一个铝离子
Fe2+ 一个亚铁离子 Fe3+ 一个铁离子
OH- 一个氢氧根离子 NH4+ 一个铵根离子
NO3- 一个硝酸根离子 SO42- 一个硫酸根离子
CO32- 一个碳酸根离子
P2O5
五氧化二磷中磷元素的化合价为+5:
+5
硫酸中硫元素的化合价为+6:
H2SO4
+6
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
