苏教版高中化学必修二2.3.3 电能转化化学能(27张ppt)
文档属性
| 名称 | 苏教版高中化学必修二2.3.3 电能转化化学能(27张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 286.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-05 00:00:00 | ||
图片预览




文档简介
课件27张PPT。 第三课时
电能转化为化学能 在生产和生活中我们不但要利用化学反应,使化学能转化为电能,而且要利用化学反应使电能转化为化学能。电能转化为化学能一般通过电解的方法来完成。我们已学过的化学课程里涉及利用电解反应来制取新物质的例子吗?电解水水H2、O22H2O==2H2 ? +O2 ?电解食盐水H2O、NaClNaOH 、
H2 、 Cl22NaCl +2H2O= 2NaOH
+H2 ? + Cl2 ?电解融熔
氯化钠NaClNa、 Cl22NaCl = 2NaCl+ Cl2 ?电解融熔
氧化铝Al2O3Al 、 O22Al2O3==2Al +3 O2 ?
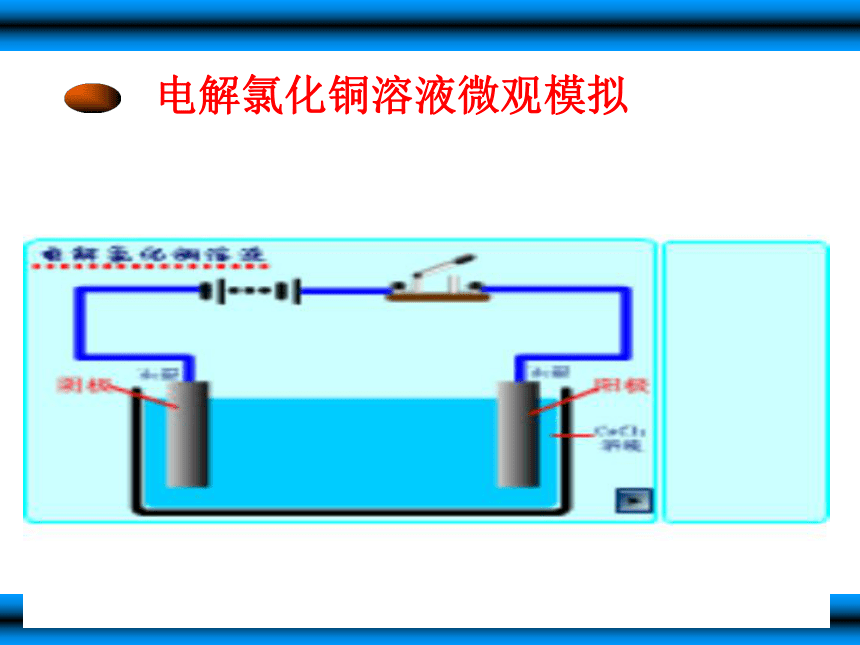
在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象。(1)接电源负极的石墨棒上有________ ,
电极反应为________。
(2)接电源正极的石墨棒上有________ ,
电极反应为________。
(3)电解反应的化学方程式________。
(4)在上述电解反应中,被氧化的物质是____,
被还原的物质是____。
(5)比较电解饱和氯化钠溶液与电解饱和氯化铜溶液,
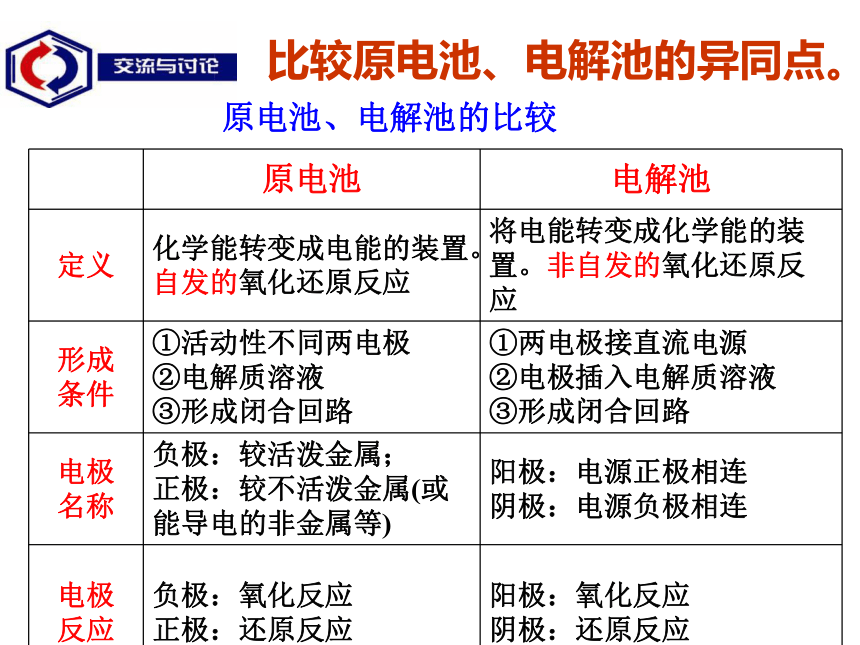
有什么不同?为什么?有铜析出Cu2+ + 2e- = Cu有Cl2放出2Cl- - 2e- = Cl2CuCl2 == Cu + Cl2 ? CuCl2CuCl2因参与电解的微粒不同。三.电解原理及电解池 3.电极名称和电极反应 与电源负极相连的电极叫阴极,阴极上发生还原反应。
与电源正极相连的电极叫阳极,阳极上发生氧化反应。 构成电解池有什么条件?构成条件: (1)与外加电源相连的两个电极 (2)有电解质溶液 (3)形成闭合回路
1.电解:使电流通过电解质溶液而在阴、阳两极引起
氧化还原反应的过程.2.电解池:借助于电流引起氧化还原反应的装置,
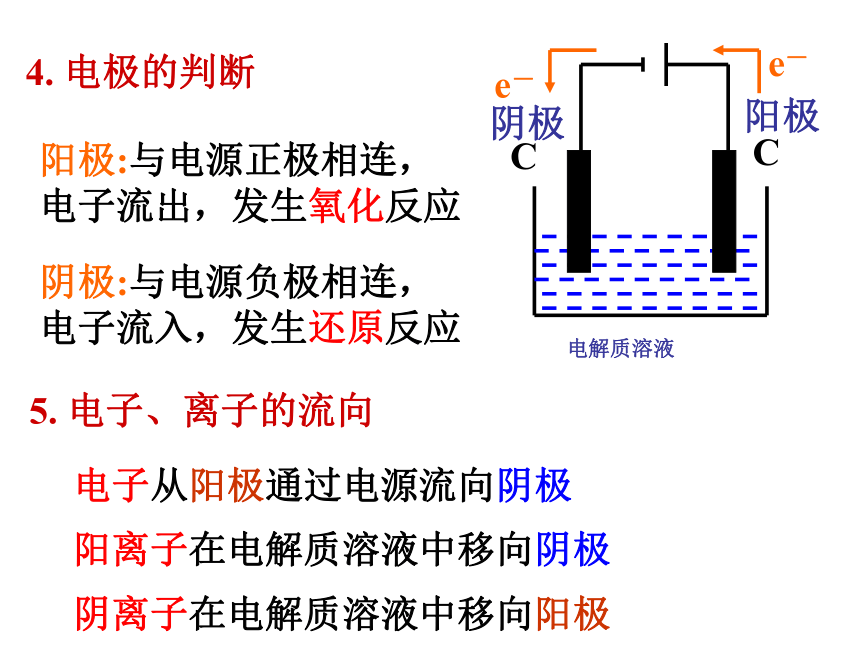
即把 电能转化为化学能的装置叫电解池或电解槽阴极:与电源负极相连,
电子流入,发生还原反应阳极:与电源正极相连,
电子流出,发生氧化反应4. 电极的判断5. 电子、离子的流向电子从阳极通过电源流向阴极
阳离子在电解质溶液中移向阴极
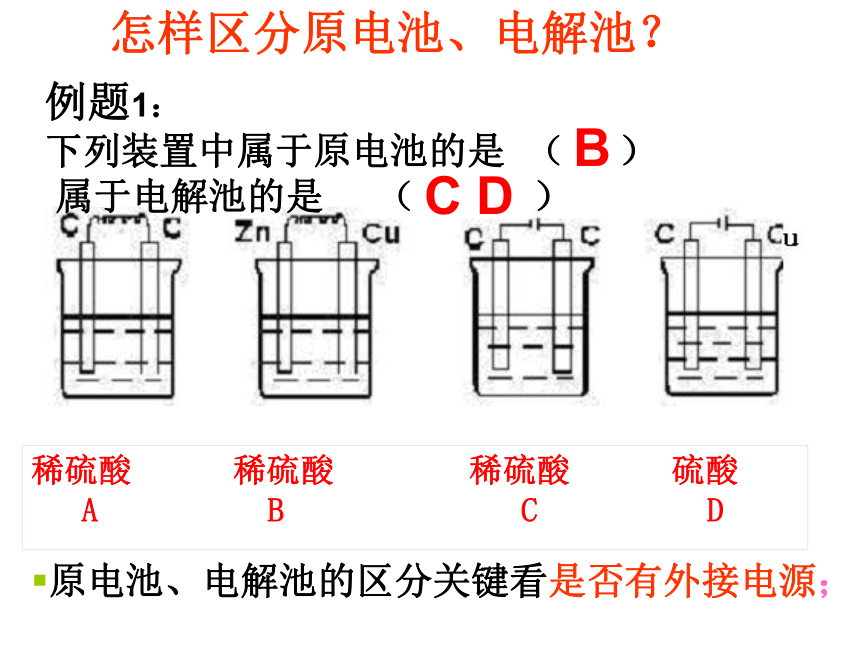
阴离子在电解质溶液中移向阳极比较原电池、电解池的异同点。原电池、电解池的比较稀硫酸 稀硫酸 稀硫酸 硫酸
A B C D
例题1:
下列装置中属于原电池的是 ( )
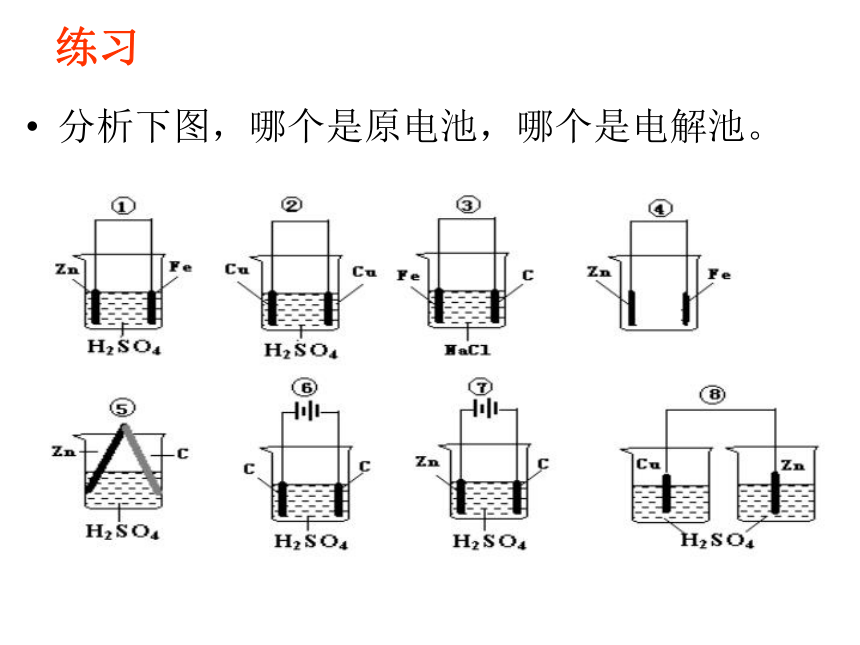
属于电解池的是 ( ) BC D 怎样区分原电池、电解池?原电池、电解池的区分关键看是否有外接电源;练习分析下图,哪个是原电池,哪个是电解池。 多池组合判断:
①无外电源:一池为原电池,其余为电解池;
②有外电源:全部为电解池或电镀池、精炼池。 6.电极产物的判断及电极反应的书写阳极:先看电极后看溶液
(1) 活泼金属电极:金属电极失电子(除金和铂)
(2) 惰性电极:溶液中阴离子失去电子,
失电子能力为:
S2- >I - >Br - >Cl - >OH - >含氧酸根>F-
阴极: 溶液中阳离子得电子,得电子能力为:
Ag+ > Fe3+ > Cu2+ > H+ (酸)> Pb2+ > Sn2+ > Fe2+ > Zn2+ > H+ (水) > Al3+ > Mg2+ >……
6.电极产物的判断及电极反应的书写阳极:先看电极后看溶液
(1) 活泼金属电极:金属电极失电子(除金和铂)
(2) 惰性电极:溶液中阴离子失去电子,
失电子能力为:
S2- >I - >Br - >Cl - >OH - >含氧酸根>F-
阴极: 溶液中阳离子得电子,得电子能力为:
Ag+ > Fe3+ > Cu2+ > H+ (酸)> Pb2+ > Sn2+ > Fe2+ > Zn2+ > H+ (水) > Al3+ > Mg2+ >……
阴极: ___电子,发生____反应,离子 _____越强,反应越容易。
常见阳离子放电顺序:
Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>Al3+>Mg2+>Na+
阳极:___电子,发生____反应,离子 _____越强,反应越容易。
①当阳极为惰性电极(石墨、铂、金)时,常见阴离子放电顺序:
S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F得还原氧化性失氧化还原性离子放电规律记
笔
记分析电解反应的一般思路溶液中存在的离子两极上的电极反应离子的移动方向及放电顺序判断电解池的阴、阳极电解Na2SO4溶液的分析阴极阳极氧气氢
气阳极: 4OH-- 4e- = 2H2O+O2 阴极: 4H ++ 4e- = 2H2 变大不
变 加
H2O
2H2O === 2H2 ↑+O2 ↑通电如电解H2SO4、HNO3、NaOH、Na2SO4等溶液时其电极反应式为: 电解后溶液中溶质的质量分数增大,若要恢复原来的浓度,只需加入一定量的水即可。用惰性电极电解电解质溶液规律(1)电解水型:电解CuCl2溶液的分析阴极阳极氯
气铜 CuCl2 Cu+Cl2 ↑阳极:2Cl--2 e- =Cl2阴极:Cu2++ 2e-=2Cu减小增
大 加
CuCl2
如电解盐酸、CuCl2溶液等 电解后溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量的溶质(通入一定量的HCl气体)电解盐酸(2)电解本身:电解CuSO4溶液的分析阴极阳极氧
气铜 2CuSO4+ 2H2O 2Cu +O2 ↑+ 2H2SO4阴极:Cu2++ 2e-=Cu减小 加
CuO
阳极: 4OH-- 4e- = 2H2O+O2 减
小如电解CuSO4溶液、AgNO3溶液等。 电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量金属氧化物。电解CuSO4溶液(3)放氧生酸型:电解NaCl溶液的分析阴极阳极氢
气氯气阳极: 2Cl-- 2e- = Cl 2阴极: 2H ++ 2e- = H2 2NaCl+2H2O 2NaOH+H2 ↑ + Cl2 ↑减小增
大 加
HCl
如电解NaCl、KCl、MgCl2溶液等。 电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需通入一定量的HCl气体。(4)放氢生碱型:(2)活泼金属的冶炼
钠的制取
镁的制取
铝的制取总反应式 : 2NaCl 2Na+Cl2↑总反应式 : MgCl2 Mg+Cl2↑总反应式 : 2Al2O3 2Al+3O2↑(1)氯碱工业——电解饱和食盐水
7.电解原理的应用(3)电镀铜 (1) 电镀是利用电解原理在某些镀件上镀上一层其他金属或合金的过程,是电解的一个重要应用。 (2) 电镀池的形成条件
阴极:待镀金属制品 阳极:镀层金属 电镀液:含有镀层金属阳离子的可溶性盐溶液
实验现象阳极:
阴极:铜变小有红色固体产生反应方程式Cu-2e-= Cu2+Cu2++2e-=Cu电镀液的组成及酸碱性不会变化(4)铜的电解精炼⑴、粗铜所含的杂质Zn、Fe、Ni、Ag、Au等⑵、粗铜的精炼 以粗铜为阳极,以纯铜为阴极, 以CuSO4溶液为电解液进行电解阳极: Zn -2e-=Zn2+ Fe-2e-=Fe2+
Ni -2e-=Ni2+ Cu-2e-=Cu2+ 阴极: Cu2+ +2e-=Cu长时间电解后必须补充电解液要点一:原电池、电解池、电镀池的比较
电能转化为化学能 在生产和生活中我们不但要利用化学反应,使化学能转化为电能,而且要利用化学反应使电能转化为化学能。电能转化为化学能一般通过电解的方法来完成。我们已学过的化学课程里涉及利用电解反应来制取新物质的例子吗?电解水水H2、O22H2O==2H2 ? +O2 ?电解食盐水H2O、NaClNaOH 、
H2 、 Cl22NaCl +2H2O= 2NaOH
+H2 ? + Cl2 ?电解融熔
氯化钠NaClNa、 Cl22NaCl = 2NaCl+ Cl2 ?电解融熔
氧化铝Al2O3Al 、 O22Al2O3==2Al +3 O2 ?
在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象。(1)接电源负极的石墨棒上有________ ,
电极反应为________。
(2)接电源正极的石墨棒上有________ ,
电极反应为________。
(3)电解反应的化学方程式________。
(4)在上述电解反应中,被氧化的物质是____,
被还原的物质是____。
(5)比较电解饱和氯化钠溶液与电解饱和氯化铜溶液,
有什么不同?为什么?有铜析出Cu2+ + 2e- = Cu有Cl2放出2Cl- - 2e- = Cl2CuCl2 == Cu + Cl2 ? CuCl2CuCl2因参与电解的微粒不同。三.电解原理及电解池 3.电极名称和电极反应 与电源负极相连的电极叫阴极,阴极上发生还原反应。
与电源正极相连的电极叫阳极,阳极上发生氧化反应。 构成电解池有什么条件?构成条件: (1)与外加电源相连的两个电极 (2)有电解质溶液 (3)形成闭合回路
1.电解:使电流通过电解质溶液而在阴、阳两极引起
氧化还原反应的过程.2.电解池:借助于电流引起氧化还原反应的装置,
即把 电能转化为化学能的装置叫电解池或电解槽阴极:与电源负极相连,
电子流入,发生还原反应阳极:与电源正极相连,
电子流出,发生氧化反应4. 电极的判断5. 电子、离子的流向电子从阳极通过电源流向阴极
阳离子在电解质溶液中移向阴极
阴离子在电解质溶液中移向阳极比较原电池、电解池的异同点。原电池、电解池的比较稀硫酸 稀硫酸 稀硫酸 硫酸
A B C D
例题1:
下列装置中属于原电池的是 ( )
属于电解池的是 ( ) BC D 怎样区分原电池、电解池?原电池、电解池的区分关键看是否有外接电源;练习分析下图,哪个是原电池,哪个是电解池。 多池组合判断:
①无外电源:一池为原电池,其余为电解池;
②有外电源:全部为电解池或电镀池、精炼池。 6.电极产物的判断及电极反应的书写阳极:先看电极后看溶液
(1) 活泼金属电极:金属电极失电子(除金和铂)
(2) 惰性电极:溶液中阴离子失去电子,
失电子能力为:
S2- >I - >Br - >Cl - >OH - >含氧酸根>F-
阴极: 溶液中阳离子得电子,得电子能力为:
Ag+ > Fe3+ > Cu2+ > H+ (酸)> Pb2+ > Sn2+ > Fe2+ > Zn2+ > H+ (水) > Al3+ > Mg2+ >……
6.电极产物的判断及电极反应的书写阳极:先看电极后看溶液
(1) 活泼金属电极:金属电极失电子(除金和铂)
(2) 惰性电极:溶液中阴离子失去电子,
失电子能力为:
S2- >I - >Br - >Cl - >OH - >含氧酸根>F-
阴极: 溶液中阳离子得电子,得电子能力为:
Ag+ > Fe3+ > Cu2+ > H+ (酸)> Pb2+ > Sn2+ > Fe2+ > Zn2+ > H+ (水) > Al3+ > Mg2+ >……
阴极: ___电子,发生____反应,离子 _____越强,反应越容易。
常见阳离子放电顺序:
Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>Al3+>Mg2+>Na+
阳极:___电子,发生____反应,离子 _____越强,反应越容易。
①当阳极为惰性电极(石墨、铂、金)时,常见阴离子放电顺序:
S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F得还原氧化性失氧化还原性离子放电规律记
笔
记分析电解反应的一般思路溶液中存在的离子两极上的电极反应离子的移动方向及放电顺序判断电解池的阴、阳极电解Na2SO4溶液的分析阴极阳极氧气氢
气阳极: 4OH-- 4e- = 2H2O+O2 阴极: 4H ++ 4e- = 2H2 变大不
变 加
H2O
2H2O === 2H2 ↑+O2 ↑通电如电解H2SO4、HNO3、NaOH、Na2SO4等溶液时其电极反应式为: 电解后溶液中溶质的质量分数增大,若要恢复原来的浓度,只需加入一定量的水即可。用惰性电极电解电解质溶液规律(1)电解水型:电解CuCl2溶液的分析阴极阳极氯
气铜 CuCl2 Cu+Cl2 ↑阳极:2Cl--2 e- =Cl2阴极:Cu2++ 2e-=2Cu减小增
大 加
CuCl2
如电解盐酸、CuCl2溶液等 电解后溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量的溶质(通入一定量的HCl气体)电解盐酸(2)电解本身:电解CuSO4溶液的分析阴极阳极氧
气铜 2CuSO4+ 2H2O 2Cu +O2 ↑+ 2H2SO4阴极:Cu2++ 2e-=Cu减小 加
CuO
阳极: 4OH-- 4e- = 2H2O+O2 减
小如电解CuSO4溶液、AgNO3溶液等。 电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量金属氧化物。电解CuSO4溶液(3)放氧生酸型:电解NaCl溶液的分析阴极阳极氢
气氯气阳极: 2Cl-- 2e- = Cl 2阴极: 2H ++ 2e- = H2 2NaCl+2H2O 2NaOH+H2 ↑ + Cl2 ↑减小增
大 加
HCl
如电解NaCl、KCl、MgCl2溶液等。 电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需通入一定量的HCl气体。(4)放氢生碱型:(2)活泼金属的冶炼
钠的制取
镁的制取
铝的制取总反应式 : 2NaCl 2Na+Cl2↑总反应式 : MgCl2 Mg+Cl2↑总反应式 : 2Al2O3 2Al+3O2↑(1)氯碱工业——电解饱和食盐水
7.电解原理的应用(3)电镀铜 (1) 电镀是利用电解原理在某些镀件上镀上一层其他金属或合金的过程,是电解的一个重要应用。 (2) 电镀池的形成条件
阴极:待镀金属制品 阳极:镀层金属 电镀液:含有镀层金属阳离子的可溶性盐溶液
实验现象阳极:
阴极:铜变小有红色固体产生反应方程式Cu-2e-= Cu2+Cu2++2e-=Cu电镀液的组成及酸碱性不会变化(4)铜的电解精炼⑴、粗铜所含的杂质Zn、Fe、Ni、Ag、Au等⑵、粗铜的精炼 以粗铜为阳极,以纯铜为阴极, 以CuSO4溶液为电解液进行电解阳极: Zn -2e-=Zn2+ Fe-2e-=Fe2+
Ni -2e-=Ni2+ Cu-2e-=Cu2+ 阴极: Cu2+ +2e-=Cu长时间电解后必须补充电解液要点一:原电池、电解池、电镀池的比较
