苏教版高中化学必修二 2.2 化学反应中的热量(15张ppt)
文档属性
| 名称 | 苏教版高中化学必修二 2.2 化学反应中的热量(15张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 392.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-05 08:20:32 | ||
图片预览






文档简介
课件15张PPT。你都知道哪些形式的能量?热能、光能、电能、太阳能、动能……化学能化学物质所具有的能量称为化学能. 不同的物质化学能不同。化学能是一种很隐蔽的能量,只有在发生变化的时候才表现出来,变成热能或者其他形式的能量。说出下列过程中的能量转化方式化学反应化学能1化学能2热能= +化学反应同时还是一个能量的变化过程物质变化过程中,满足总质量守恒能量变化过程中,满足总能量守恒是一个物质的变化过程化学反应中的热量变化2.2.1活动与探究试管外壁
发热镁与盐酸反应
有热量放出温度降低氢氧化钡晶体与氯化铵固体反应需要吸收热量一、化学反应中的热量变化
1.所有反应都有能量变化,通常表现为热量变化3.常见的放(吸)热反应1.金属与酸或水的反应
2. 燃烧反应
3.酸碱中和反应
4.大多数化合反应 (如CaO溶于H2O的反应)1.氢氧化钡晶体与氯化铵固体的反应
2. C 与CO2的反应
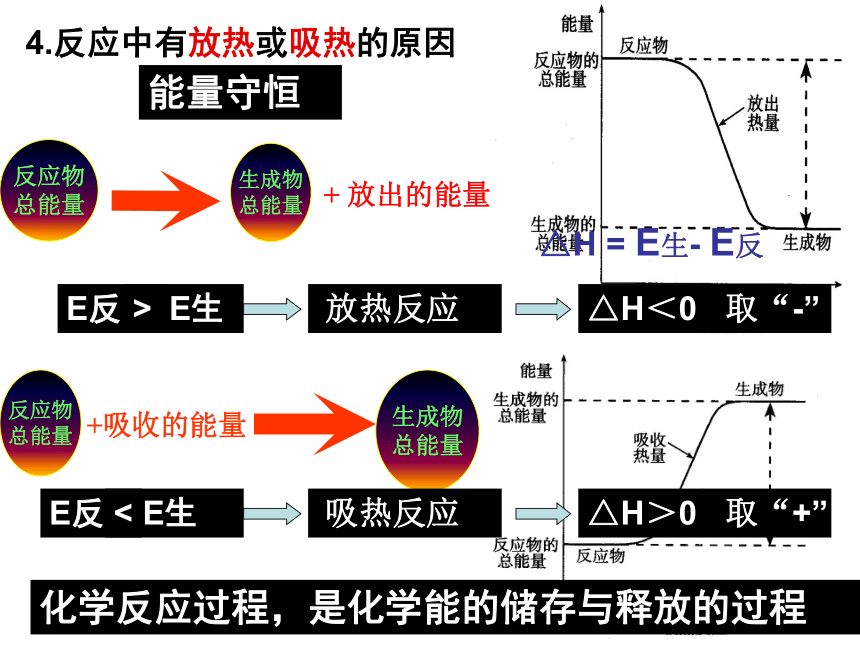
3.需要持续加热或高温下的分解反应2.放热反应和吸热反应 (P35)需要加热才能进行的反应一定是吸热反应若某反应是放热的,则反应不需加热反应放热还是吸热与反应条件无关,由反应前后化学物质的总能量变化决定。4.反应中有放热或吸热的原因能量守恒化学反应过程,是化学能的储存与释放的过程E反 E生E反 E生><△H = E生- E反5、热化学方程式:
表明反应所放出或吸收的热量的化学方程式热化学方程式的书写步骤:(1)写出化学反应方程式 (反应条件可不写)(3)表示出△H ( △H = E生- E反)总结:热化学方程式既表明了化学反应中的物质变化,
也表明了化学反应中的能量变化。注:相反的过程:△H正= -△H逆①注明 “+”或“-”;放热反应△H<0 取“-”
吸热反应△H >0 取“+”②△H的数值与反应物的量(物质的量.质量)成正比.③无论热化学方程式中化学计量数为多少,△H的单位总是KJ/mol.5)热化学方程式中各物质前的化学计量数表示物质的量不表示分子数,因而必要时可用分数。一般出现分数时是以某一反应物或生成物为“1mol”时其它物质才出现的H2(g)+Cl2(g)=2HCl(g);△H=-184.6KJ/mol ? H2(g)+ ? Cl2(g)= HCl(g);△H=-92.3KJ/mol 反应放出或吸收的热量的多少与外界的温度和压强有关,需要注明,不注明的指101kPa和25℃时的数据。4)要注明温度和压强:? H2(g)+? Cl2(g)=? HCl(g);△H=-46.15KJ/mol C1、1gCH4完全燃烧生成CO2和液态水时放出55.625kJ的热量,写出该反应的热化学方程式 课堂反馈3.已知方程式2H2(g)+O2(g)=2H2O(l);
△H1=-571.6KJ/mol,
则关于方程式2H2O(l) = 2H2(g)+O2(g); △H2=?的说法中正确的是( )
A.方程式中化学计量数表示分子数
B.该反应的△H2大于零
C.该反应的△H2=-571.6KJ/mol
D.该反应表示36g水完全分解需吸收571.6KJ的能量B5、12g石墨与O2反应生成CO2放出393.51KJ热量;12g金刚石与O2反应生成CO2放出395.41KJ热量
写出石墨转变为金刚石的热化学方程式4,根据以下方程式,写出1摩尔液态水转化成1摩尔水蒸气的热化学方程式H2(g)+ 1/2 O2(g)=H2O(l);△H=-285.8KJ/molH2(g)+ 1/2 O2(g)=H2O(g);△H=-241.8KJ/mol △H=+44KJ/molH2O(l)═H2O(g)试比较,石墨与金刚石哪个稳定?6.已知:(1)
2H2(g)+O2(g)=2H2O(g); △H1= - Q1kJ/mol
2H2(g)+O2(g)=2H2O(l); △H2= -Q2kJ/mol
则Q1 Q2、△H1 △H2<>已知(2)
S(g)+O2(g)=SO2(g) △H1= - Q1kJ/mol
S(s)+O2(g)=SO2(g) △H2= -Q2kJ/mol
则Q1 Q2、△H1 △H2><能量增加熔化蒸发结论:物质所具有的能量与它们的聚集状态有关。
发热镁与盐酸反应
有热量放出温度降低氢氧化钡晶体与氯化铵固体反应需要吸收热量一、化学反应中的热量变化
1.所有反应都有能量变化,通常表现为热量变化3.常见的放(吸)热反应1.金属与酸或水的反应
2. 燃烧反应
3.酸碱中和反应
4.大多数化合反应 (如CaO溶于H2O的反应)1.氢氧化钡晶体与氯化铵固体的反应
2. C 与CO2的反应
3.需要持续加热或高温下的分解反应2.放热反应和吸热反应 (P35)需要加热才能进行的反应一定是吸热反应若某反应是放热的,则反应不需加热反应放热还是吸热与反应条件无关,由反应前后化学物质的总能量变化决定。4.反应中有放热或吸热的原因能量守恒化学反应过程,是化学能的储存与释放的过程E反 E生E反 E生><△H = E生- E反5、热化学方程式:
表明反应所放出或吸收的热量的化学方程式热化学方程式的书写步骤:(1)写出化学反应方程式 (反应条件可不写)(3)表示出△H ( △H = E生- E反)总结:热化学方程式既表明了化学反应中的物质变化,
也表明了化学反应中的能量变化。注:相反的过程:△H正= -△H逆①注明 “+”或“-”;放热反应△H<0 取“-”
吸热反应△H >0 取“+”②△H的数值与反应物的量(物质的量.质量)成正比.③无论热化学方程式中化学计量数为多少,△H的单位总是KJ/mol.5)热化学方程式中各物质前的化学计量数表示物质的量不表示分子数,因而必要时可用分数。一般出现分数时是以某一反应物或生成物为“1mol”时其它物质才出现的H2(g)+Cl2(g)=2HCl(g);△H=-184.6KJ/mol ? H2(g)+ ? Cl2(g)= HCl(g);△H=-92.3KJ/mol 反应放出或吸收的热量的多少与外界的温度和压强有关,需要注明,不注明的指101kPa和25℃时的数据。4)要注明温度和压强:? H2(g)+? Cl2(g)=? HCl(g);△H=-46.15KJ/mol C1、1gCH4完全燃烧生成CO2和液态水时放出55.625kJ的热量,写出该反应的热化学方程式 课堂反馈3.已知方程式2H2(g)+O2(g)=2H2O(l);
△H1=-571.6KJ/mol,
则关于方程式2H2O(l) = 2H2(g)+O2(g); △H2=?的说法中正确的是( )
A.方程式中化学计量数表示分子数
B.该反应的△H2大于零
C.该反应的△H2=-571.6KJ/mol
D.该反应表示36g水完全分解需吸收571.6KJ的能量B5、12g石墨与O2反应生成CO2放出393.51KJ热量;12g金刚石与O2反应生成CO2放出395.41KJ热量
写出石墨转变为金刚石的热化学方程式4,根据以下方程式,写出1摩尔液态水转化成1摩尔水蒸气的热化学方程式H2(g)+ 1/2 O2(g)=H2O(l);△H=-285.8KJ/molH2(g)+ 1/2 O2(g)=H2O(g);△H=-241.8KJ/mol △H=+44KJ/molH2O(l)═H2O(g)试比较,石墨与金刚石哪个稳定?6.已知:(1)
2H2(g)+O2(g)=2H2O(g); △H1= - Q1kJ/mol
2H2(g)+O2(g)=2H2O(l); △H2= -Q2kJ/mol
则Q1 Q2、△H1 △H2<>已知(2)
S(g)+O2(g)=SO2(g) △H1= - Q1kJ/mol
S(s)+O2(g)=SO2(g) △H2= -Q2kJ/mol
则Q1 Q2、△H1 △H2><能量增加熔化蒸发结论:物质所具有的能量与它们的聚集状态有关。
