苏教版高中化学选修四 2.2.1化学反应速率及影响因素
文档属性
| 名称 | 苏教版高中化学选修四 2.2.1化学反应速率及影响因素 |  | |
| 格式 | zip | ||
| 文件大小 | 966.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-05 15:12:24 | ||
图片预览






文档简介
课件18张PPT。 化学反应速率及影响因素不同化学反应
的速率反应物本身性质
(内因)同一化学反应
的速率外界条件
(外因)内因——物质本身的性质(决定性因素)(1)催化剂:能大大改变速率
(2)浓度:反应物浓度越大,速率越大
(3)温度:体系温度越高,速率越大
(4)压强:有气体参与的反应,压强是否引起浓度
改变
(5)固体表面积:块装固体反应速率小于粉末状
固体反应速率。
(6)溶剂的性质、光、超声波、磁场等 增加固体物质因其浓度是个定值,
故不影响反应速率(不考虑表面积的影响)。 一定量的盐酸跟过量的铁粉反应时,为了减慢反应速率,而不影响生成H2的总量,可向其中加入适量的 ( )
A、Na2CO3晶体 B、NaOH晶体
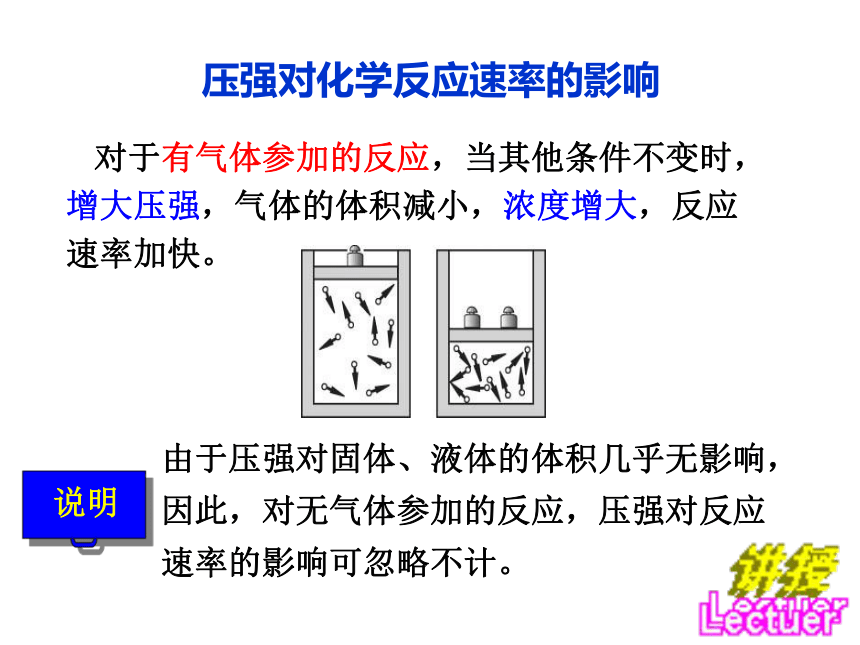
C、水 D、CuSO4晶体巩固练习C压强对化学反应速率的影响 对于有气体参加的反应,当其他条件不变时,
增大压强,气体的体积减小,浓度增大,反应
速率加快。 由于压强对固体、液体的体积几乎无影响,
因此,对无气体参加的反应,压强对反应
速率的影响可忽略不计。注意 恒容时加入稀有气体使压强增大,反应物和生成
物的浓度都没有变化,所以化学反应速率不变。
恒压时加入稀有气体使体积增大,反应物和生成
物的浓度都减小,所以化学反应速率减小。 压强的“真变”与“假变” 压强对速率的影响是通过改变气体的浓度
来改变的;若压强变化之后,气体的浓度未变,其化学反应速率不变。 在C(固)+CO2(气)=2CO(气) 的反应中。
现采取下列措施:
(1)缩小容器体积增大压强 ;
(2)增加碳的量
(3)恒容下通入CO2; (4)恒容下充入N2;
(5)恒压下充入N2
哪些措施能够使反应速率增大?为什么? 答案:(1)(3)巩固练习 如下图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下
发生2SO2+O2=2SO3的反应。问:③ 如起始在a、c两容器中通入同量的N2, 则此时三容器起始压强为Pa ___Pb Pc;① 起始a、c两容器的反应速率大小关系为Va ___Vc;② 反应一段时间后a、c中速率大小关系为Va ___Vc ;=<> = = >起始反应速率关系为Va ___Vb ___Vc巩固练习〖探究1〗设计实验比较在2mL 5%的H2O2中加入
FeCl3和CuSO4溶液各1mL,比较二者分解速率?FeCl3对该反应的催化效果更好 可逆反应中,外界条件对反应速率的影响V逆’一、浓度变化对化学平衡的影响影响化学平衡的因素平衡时,若滴加数滴HNO3溶液后, V正’、 V逆’瞬间如何变化?在下图中画出加入硝酸瞬间V正’、 V逆’V正’V逆’可逆反应中外界条件同时对V正、V逆影响 增大反应物浓度,V正瞬间增大,V逆瞬间不变;V逆’V正’减小反应物浓度,V正?,V逆?V正瞬间减小,V逆瞬间不变。可逆反应中外界条件同时对V正、V逆影响 缩小容器加压对有气体参加或生成的可逆反应,
V正、V逆瞬间如何变化?
扩大容器降压对有气体参加或生成的可逆反应,
V正、V逆瞬间如何变化?可逆反应中外界条件同时对V正、V逆影响 升温,V正、V逆一般均加快降温,V正、V逆一般均减小可逆反应中外界条件同时对V正、V逆影响 加催化剂可同倍地改变 V正、V逆。 高考链接(对于反应2SO2(g)+O2(g) 2SO3(g),
能增大正反应速率的措施是 ( )
A.通入大量O2 B.增大容积
C.移去部分SO3 D.降低体系温度A高考链接等质量的铁与过量的盐酸在不同的实验
条件下进行反应,测定在不同时间t产生气体体积V的
数据,根据数据绘制得到图1,则曲线a、b、c、d所
对应的实验组别可能是 ( )A.4-3-2-1 B.1-2-3-4
C.3-4-2-1 D.1-2-4-3AC
的速率反应物本身性质
(内因)同一化学反应
的速率外界条件
(外因)内因——物质本身的性质(决定性因素)(1)催化剂:能大大改变速率
(2)浓度:反应物浓度越大,速率越大
(3)温度:体系温度越高,速率越大
(4)压强:有气体参与的反应,压强是否引起浓度
改变
(5)固体表面积:块装固体反应速率小于粉末状
固体反应速率。
(6)溶剂的性质、光、超声波、磁场等 增加固体物质因其浓度是个定值,
故不影响反应速率(不考虑表面积的影响)。 一定量的盐酸跟过量的铁粉反应时,为了减慢反应速率,而不影响生成H2的总量,可向其中加入适量的 ( )
A、Na2CO3晶体 B、NaOH晶体
C、水 D、CuSO4晶体巩固练习C压强对化学反应速率的影响 对于有气体参加的反应,当其他条件不变时,
增大压强,气体的体积减小,浓度增大,反应
速率加快。 由于压强对固体、液体的体积几乎无影响,
因此,对无气体参加的反应,压强对反应
速率的影响可忽略不计。注意 恒容时加入稀有气体使压强增大,反应物和生成
物的浓度都没有变化,所以化学反应速率不变。
恒压时加入稀有气体使体积增大,反应物和生成
物的浓度都减小,所以化学反应速率减小。 压强的“真变”与“假变” 压强对速率的影响是通过改变气体的浓度
来改变的;若压强变化之后,气体的浓度未变,其化学反应速率不变。 在C(固)+CO2(气)=2CO(气) 的反应中。
现采取下列措施:
(1)缩小容器体积增大压强 ;
(2)增加碳的量
(3)恒容下通入CO2; (4)恒容下充入N2;
(5)恒压下充入N2
哪些措施能够使反应速率增大?为什么? 答案:(1)(3)巩固练习 如下图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下
发生2SO2+O2=2SO3的反应。问:③ 如起始在a、c两容器中通入同量的N2, 则此时三容器起始压强为Pa ___Pb Pc;① 起始a、c两容器的反应速率大小关系为Va ___Vc;② 反应一段时间后a、c中速率大小关系为Va ___Vc ;=<> = = >起始反应速率关系为Va ___Vb ___Vc巩固练习〖探究1〗设计实验比较在2mL 5%的H2O2中加入
FeCl3和CuSO4溶液各1mL,比较二者分解速率?FeCl3对该反应的催化效果更好 可逆反应中,外界条件对反应速率的影响V逆’一、浓度变化对化学平衡的影响影响化学平衡的因素平衡时,若滴加数滴HNO3溶液后, V正’、 V逆’瞬间如何变化?在下图中画出加入硝酸瞬间V正’、 V逆’V正’V逆’可逆反应中外界条件同时对V正、V逆影响 增大反应物浓度,V正瞬间增大,V逆瞬间不变;V逆’V正’减小反应物浓度,V正?,V逆?V正瞬间减小,V逆瞬间不变。可逆反应中外界条件同时对V正、V逆影响 缩小容器加压对有气体参加或生成的可逆反应,
V正、V逆瞬间如何变化?
扩大容器降压对有气体参加或生成的可逆反应,
V正、V逆瞬间如何变化?可逆反应中外界条件同时对V正、V逆影响 升温,V正、V逆一般均加快降温,V正、V逆一般均减小可逆反应中外界条件同时对V正、V逆影响 加催化剂可同倍地改变 V正、V逆。 高考链接(对于反应2SO2(g)+O2(g) 2SO3(g),
能增大正反应速率的措施是 ( )
A.通入大量O2 B.增大容积
C.移去部分SO3 D.降低体系温度A高考链接等质量的铁与过量的盐酸在不同的实验
条件下进行反应,测定在不同时间t产生气体体积V的
数据,根据数据绘制得到图1,则曲线a、b、c、d所
对应的实验组别可能是 ( )A.4-3-2-1 B.1-2-3-4
C.3-4-2-1 D.1-2-4-3AC
