苏教版高中化学选修四 专题2第2单元 化学反应的方向
文档属性
| 名称 | 苏教版高中化学选修四 专题2第2单元 化学反应的方向 |

|
|
| 格式 | zip | ||
| 文件大小 | 859.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-05 15:13:29 | ||
图片预览






文档简介
课件14张PPT。化学反应的方向和限度
第一课时 化学反应的方向自发过程非自发过程
(需靠外力)整齐混乱自发过程非自发过程
(需靠外力)一、自发反应例:水由高处流向低处
热由高温物体传向低温物体
自发过程:在一定温度和压强下,无需外界帮助,一经引发即能自动进行的过程自发反应:在一定温度和压强下,无需外界帮助,一经引发即能自动进行的反应例:锌跟稀硫酸的反应
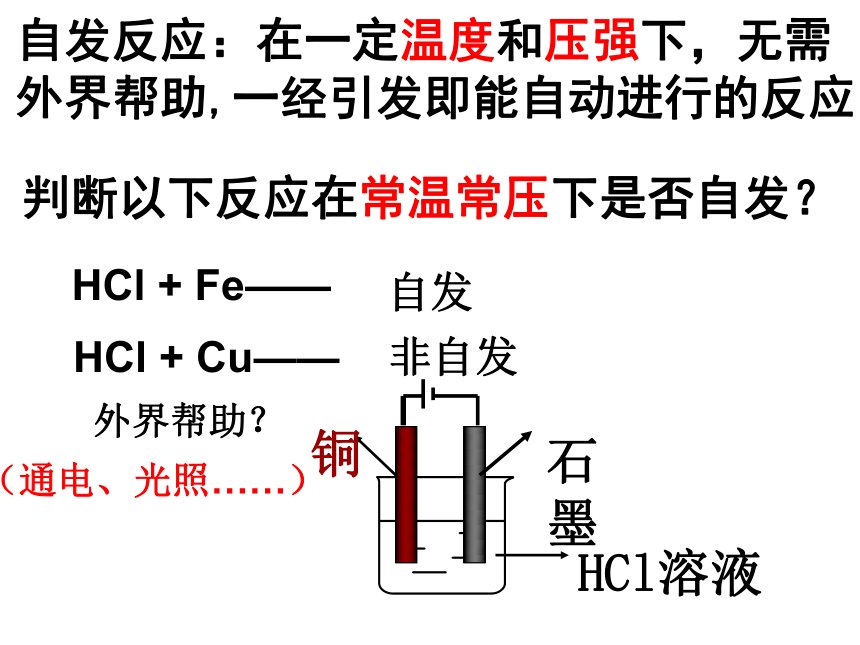
自发反应:在一定温度和压强下,无需外界帮助,一经引发即能自动进行的反应判断以下反应在常温常压下是否自发?HCl + Fe——HCl + Cu——自发非自发外界帮助?(通电、光照……)化学反应中的自发过程(1)C3H8 (g) + 5O2 (g) = 3CO2 (g) +4 H2 O (l)
△H=-2217.5 kJ/mol(2)2Na(s)+Cl2(g)=2NaCl(s) △H=-822 kJ/mol(3)4Fe(s)+3O2(g)=2Fe2O3(s)
△H=-1648.4kJ/mol共同点?(4)H2 (g)+F2(g)=2HF(g)
△H=-546.6kJ/mol放热反应 △H<02NH4Cl(s) +Ba(OH)2?8H2O (s)=
2NH3(g) + BaCl2 (s) + 10H2O (l)
△H﹥0自发进行的吸热反应结论: 反应焓变是反应能否自发进行的一个因素, 但不是唯一因素。二.反应熵变与反应方向熵是体系混乱度的量度,即熵用来描述体系的混乱度,符号用S表示。体系混乱度越大,熵值越大;体系混乱度越小,熵值越小。
① H2O (s) → H2O (l) → H2O (g)
② CaCO3(s) =CaO (s) +CO2 (g)
③ NaOH(s) = Na+ (aq) +OH- (aq)
④ N2 (g) + 3H2 (g) = 2NH3 (g)
⑤ 2HgO (s) = 2 Hg (l) + O2 (g)
⑥ Ag+ (aq) + Cl- (aq) = AgCl (s) △S>0△S>0△S<0△S<0△S>0△S>0判断下列过程是熵增还是熵减?熵变(△S)——反应前后体系熵的变化若:△S>0,变化前后体系的混乱度增大若:△S<0,变化前后体系的混乱度减小化学反应的△S越大,越有利于反应的自发进行。
体系混乱度增大即ΔS >0,有利于反应正向自发进行。
熵增原理 熵变是反应能否自发进行的一个因素,
但不是唯一因素。小结影响自发反应的因素:放热反应(即△H<0)有利于反应自发进行,但不是唯一因素熵增加的反应(即△S > 0)有利于反应自发进行,但也不是唯一的因素。△H、 △S 例:CaCO3(s) == CaO (s) +CO2 (g)
已知: △H =178.2KJ?mol -1 ,
△S =169.6J?mol-1?K-1,反应是否自发?T 研究表明:在温度、压强一定的条件下,化学反应自发进行方向的判据是
△G = △H - T△S
( G 叫作吉布斯自由能)△G = △H - T△S < 0 反应能自发进行
△G = △H - T△S >0 反应不能自发进行 三、自发过程的综合判据CaCO3(s) == CaO (s) +CO2 (g)
这个反应能自发进行的温度范围?
已知: △H =178.2KJ?mol -1 ,
△S =169.6J?mol-1?K-1思考178.2KJ?mol -1—T×0.1696KJ?mol-1?K-1﹤0所以,T﹥K=1050.7K=777.7℃①△H<0, △S>0,反应都能正向自发进行三、当△H>0, △S>0时,____温(填高或低),反应自发四、当△H<0, △S<0时,____温(填高或低),反应自发②△H>0, △S<0,则所有温度下,△G< 0思考一、从△H, △S的正负考虑,怎样的反应一定能自发?二、从△H, △S的正负考虑,怎样的反应一定不能自发?则所有温度下,△G ﹥ 0反应都不能正向自发进行高低
第一课时 化学反应的方向自发过程非自发过程
(需靠外力)整齐混乱自发过程非自发过程
(需靠外力)一、自发反应例:水由高处流向低处
热由高温物体传向低温物体
自发过程:在一定温度和压强下,无需外界帮助,一经引发即能自动进行的过程自发反应:在一定温度和压强下,无需外界帮助,一经引发即能自动进行的反应例:锌跟稀硫酸的反应
自发反应:在一定温度和压强下,无需外界帮助,一经引发即能自动进行的反应判断以下反应在常温常压下是否自发?HCl + Fe——HCl + Cu——自发非自发外界帮助?(通电、光照……)化学反应中的自发过程(1)C3H8 (g) + 5O2 (g) = 3CO2 (g) +4 H2 O (l)
△H=-2217.5 kJ/mol(2)2Na(s)+Cl2(g)=2NaCl(s) △H=-822 kJ/mol(3)4Fe(s)+3O2(g)=2Fe2O3(s)
△H=-1648.4kJ/mol共同点?(4)H2 (g)+F2(g)=2HF(g)
△H=-546.6kJ/mol放热反应 △H<02NH4Cl(s) +Ba(OH)2?8H2O (s)=
2NH3(g) + BaCl2 (s) + 10H2O (l)
△H﹥0自发进行的吸热反应结论: 反应焓变是反应能否自发进行的一个因素, 但不是唯一因素。二.反应熵变与反应方向熵是体系混乱度的量度,即熵用来描述体系的混乱度,符号用S表示。体系混乱度越大,熵值越大;体系混乱度越小,熵值越小。
① H2O (s) → H2O (l) → H2O (g)
② CaCO3(s) =CaO (s) +CO2 (g)
③ NaOH(s) = Na+ (aq) +OH- (aq)
④ N2 (g) + 3H2 (g) = 2NH3 (g)
⑤ 2HgO (s) = 2 Hg (l) + O2 (g)
⑥ Ag+ (aq) + Cl- (aq) = AgCl (s) △S>0△S>0△S<0△S<0△S>0△S>0判断下列过程是熵增还是熵减?熵变(△S)——反应前后体系熵的变化若:△S>0,变化前后体系的混乱度增大若:△S<0,变化前后体系的混乱度减小化学反应的△S越大,越有利于反应的自发进行。
体系混乱度增大即ΔS >0,有利于反应正向自发进行。
熵增原理 熵变是反应能否自发进行的一个因素,
但不是唯一因素。小结影响自发反应的因素:放热反应(即△H<0)有利于反应自发进行,但不是唯一因素熵增加的反应(即△S > 0)有利于反应自发进行,但也不是唯一的因素。△H、 △S 例:CaCO3(s) == CaO (s) +CO2 (g)
已知: △H =178.2KJ?mol -1 ,
△S =169.6J?mol-1?K-1,反应是否自发?T 研究表明:在温度、压强一定的条件下,化学反应自发进行方向的判据是
△G = △H - T△S
( G 叫作吉布斯自由能)△G = △H - T△S < 0 反应能自发进行
△G = △H - T△S >0 反应不能自发进行 三、自发过程的综合判据CaCO3(s) == CaO (s) +CO2 (g)
这个反应能自发进行的温度范围?
已知: △H =178.2KJ?mol -1 ,
△S =169.6J?mol-1?K-1思考178.2KJ?mol -1—T×0.1696KJ?mol-1?K-1﹤0所以,T﹥K=1050.7K=777.7℃①△H<0, △S>0,反应都能正向自发进行三、当△H>0, △S>0时,____温(填高或低),反应自发四、当△H<0, △S<0时,____温(填高或低),反应自发②△H>0, △S<0,则所有温度下,△G< 0思考一、从△H, △S的正负考虑,怎样的反应一定能自发?二、从△H, △S的正负考虑,怎样的反应一定不能自发?则所有温度下,△G ﹥ 0反应都不能正向自发进行高低
