苏教版高中化学选修四1.2 原电池的工作原理
文档属性
| 名称 | 苏教版高中化学选修四1.2 原电池的工作原理 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-05 15:01:47 | ||
图片预览







文档简介
课件23张PPT。第二单元 化学能与电能的转化化学反应与能量变化原电池的工作原理化学能热能? 在1799年,意大利的物理学
家伏打已经捕捉到了这一现象并
加以研究,发明了世界上第一个
电池──伏打电池,即原电池。
为纪念他的伟大成就,科学
界将他的姓简化成Volt(伏特),
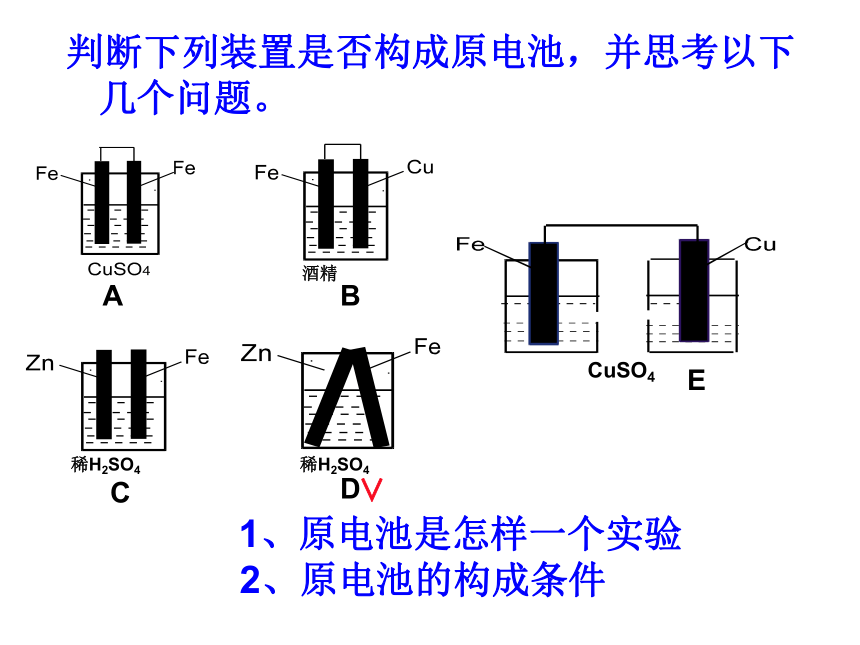
作为电压单位的命名。(伏打电池示意图)判断下列装置是否构成原电池,并思考以下几个问题。 1、原电池是怎样一个实验
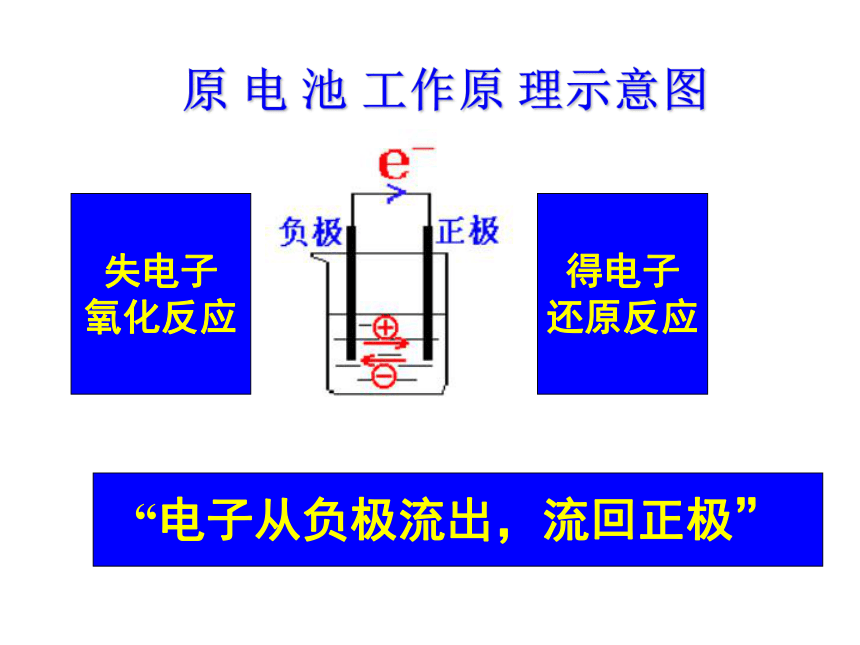
2、原电池的构成条件 ECuSO4∨知识回顾1、原电池:把化学能转变为电能的装置 2、构成原电池的条件(1)、两种不同的电极(2)、电解质溶液(3)、形成闭合回路[设疑]若E中两烧杯中的电解质溶液用能使阴阳离子移动的装置连接起来,能否形成原电池?探究一:预测P12[实验1] 的现象和结论 现象:锌粉溶解,有红色物质析出,温度计显示温度迅速上升.结论:Zn+ Cu2+ = Zn2+ + Cu探究二:预测P12[实验2] 的现象和结论 现象:锌片变细,铜上有红色物质析出,电流计指针发生偏转.结论:Zn-2e-=Zn2+Cu2++2e-=Cu“电子从负极流出,流回正极”失电子
氧化反应得电子
还原反应原 电 池 工作原 理示意图 为获得较长时间的稳定电流,如何将必修2中由“Zn-稀H2SO4-Cu”组成的原电池(如左下图)进行简单改装?盐桥:在U型管中装满用饱和KCl溶液和琼胶作成的冻胶。这种装置能将化学能转变为电能,称为原电池(Primary Cell)1、盐桥的作用:
使Cl-向锌盐方向移动,K+向铜盐方向移动,使Zn盐和Cu盐溶液一直保持电中性,从而使电子不断从Zn极流向Cu极。正极(铜电极):
Cu2+ + 2e- = Cu
负极(锌电极):
Zn = Zn2+ + 2e-电池反应:Zn+ Cu2+ = Cu+ Zn2+(总反应)2、原电池正负极的判断方法及电极反应、
电池反应的书写氧化反应Zn-2 e- =Zn2+ 铜锌原电池电解质溶液失e-,沿导线传递,有电流产生还原反应2H++2e-=H2↑阴离子阳离子总反应:负极正极 2H++2e-=H2↑Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑Zn+H2SO4=ZnSO4+H2↑(离子方程式)(化学方程式)电极反应正极:负极:(氧化反应)(还原反应)小结:练习判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.1(∨)2H++2e-=H2↑负极:总反应:正极:Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑
(∨)负极:正极:总反应:Zn-2e- =Zn2+2H++2e- =H2↑Zn+2H+=Zn2++H2↑(∨)正极:负极:总反应:Fe-2e - =Fe2+Cu2++2e- =CuFe+Cu2+=Fe2++CuFe+CuSO4=Cu+FeSO42354(×)(∨)负极:正极:总反应:Zn-2e-=Zn2+Cu2++2e-=CuZn+Cu2+=Zn2++Cu或 Zn+CuSO4=ZnSO4+Cu6(∨)6. X、Y、Z、W四种金属片进入稀盐酸中,用导线连接,可以组成原电池,实验结果如下图所示:
则四种金属的活泼性由强到弱的顺序为
________________Z>Y>X>W一.原电池1. 定义:把化学能转化为电能的装置2.构成条件: 两种相连接的活泼性不同的金属同时浸入电解质
溶液中(一种可以是非金属导体如碳棒)。3.原电池的化学原理电子从负极(较活泼金属)流向正极(较不活泼金属或碳棒),
负极发生氧化反应,正极发生还原反应。4.半电池:包括电极材料和电解质溶液,两个隔离
的半电池通过盐桥连接起来。小结1、如何在一个地处僻远的
小岛上设置一 座灯塔?
(从能量角度考虑)思考讨论负极:较活泼的金属(如铝等金属)正极:较不活泼的金属或石墨等电解质溶液:海水(NaCl、MgCl2等)2、试将下面这个氧化还原反应设计成原电池Zn + 2AgNO3=Zn(NO3)2+2Ag
思考Fe+2Fe3+=3Fe2+3、如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( D )A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;? 4、已知氧化还原反应
Cu + 2FeCl3 = 2FeCl2 + CuCl2,
利用这一反应设计一个原电池,画出示意图,
标出电极材料,电解质溶液,写出电极反应式。
正极:负极:总反应:Cu-2e - =Cu2+2Fe3++2e- =2Fe2+2Fe3++Cu=2Fe2++Cu2+
家伏打已经捕捉到了这一现象并
加以研究,发明了世界上第一个
电池──伏打电池,即原电池。
为纪念他的伟大成就,科学
界将他的姓简化成Volt(伏特),
作为电压单位的命名。(伏打电池示意图)判断下列装置是否构成原电池,并思考以下几个问题。 1、原电池是怎样一个实验
2、原电池的构成条件 ECuSO4∨知识回顾1、原电池:把化学能转变为电能的装置 2、构成原电池的条件(1)、两种不同的电极(2)、电解质溶液(3)、形成闭合回路[设疑]若E中两烧杯中的电解质溶液用能使阴阳离子移动的装置连接起来,能否形成原电池?探究一:预测P12[实验1] 的现象和结论 现象:锌粉溶解,有红色物质析出,温度计显示温度迅速上升.结论:Zn+ Cu2+ = Zn2+ + Cu探究二:预测P12[实验2] 的现象和结论 现象:锌片变细,铜上有红色物质析出,电流计指针发生偏转.结论:Zn-2e-=Zn2+Cu2++2e-=Cu“电子从负极流出,流回正极”失电子
氧化反应得电子
还原反应原 电 池 工作原 理示意图 为获得较长时间的稳定电流,如何将必修2中由“Zn-稀H2SO4-Cu”组成的原电池(如左下图)进行简单改装?盐桥:在U型管中装满用饱和KCl溶液和琼胶作成的冻胶。这种装置能将化学能转变为电能,称为原电池(Primary Cell)1、盐桥的作用:
使Cl-向锌盐方向移动,K+向铜盐方向移动,使Zn盐和Cu盐溶液一直保持电中性,从而使电子不断从Zn极流向Cu极。正极(铜电极):
Cu2+ + 2e- = Cu
负极(锌电极):
Zn = Zn2+ + 2e-电池反应:Zn+ Cu2+ = Cu+ Zn2+(总反应)2、原电池正负极的判断方法及电极反应、
电池反应的书写氧化反应Zn-2 e- =Zn2+ 铜锌原电池电解质溶液失e-,沿导线传递,有电流产生还原反应2H++2e-=H2↑阴离子阳离子总反应:负极正极 2H++2e-=H2↑Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑Zn+H2SO4=ZnSO4+H2↑(离子方程式)(化学方程式)电极反应正极:负极:(氧化反应)(还原反应)小结:练习判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.1(∨)2H++2e-=H2↑负极:总反应:正极:Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑
(∨)负极:正极:总反应:Zn-2e- =Zn2+2H++2e- =H2↑Zn+2H+=Zn2++H2↑(∨)正极:负极:总反应:Fe-2e - =Fe2+Cu2++2e- =CuFe+Cu2+=Fe2++CuFe+CuSO4=Cu+FeSO42354(×)(∨)负极:正极:总反应:Zn-2e-=Zn2+Cu2++2e-=CuZn+Cu2+=Zn2++Cu或 Zn+CuSO4=ZnSO4+Cu6(∨)6. X、Y、Z、W四种金属片进入稀盐酸中,用导线连接,可以组成原电池,实验结果如下图所示:
则四种金属的活泼性由强到弱的顺序为
________________Z>Y>X>W一.原电池1. 定义:把化学能转化为电能的装置2.构成条件: 两种相连接的活泼性不同的金属同时浸入电解质
溶液中(一种可以是非金属导体如碳棒)。3.原电池的化学原理电子从负极(较活泼金属)流向正极(较不活泼金属或碳棒),
负极发生氧化反应,正极发生还原反应。4.半电池:包括电极材料和电解质溶液,两个隔离
的半电池通过盐桥连接起来。小结1、如何在一个地处僻远的
小岛上设置一 座灯塔?
(从能量角度考虑)思考讨论负极:较活泼的金属(如铝等金属)正极:较不活泼的金属或石墨等电解质溶液:海水(NaCl、MgCl2等)2、试将下面这个氧化还原反应设计成原电池Zn + 2AgNO3=Zn(NO3)2+2Ag
思考Fe+2Fe3+=3Fe2+3、如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( D )A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;? 4、已知氧化还原反应
Cu + 2FeCl3 = 2FeCl2 + CuCl2,
利用这一反应设计一个原电池,画出示意图,
标出电极材料,电解质溶液,写出电极反应式。
正极:负极:总反应:Cu-2e - =Cu2+2Fe3++2e- =2Fe2+2Fe3++Cu=2Fe2++Cu2+
