2019年浙教版科学中考冲刺重高专训10 酸碱盐探究题
文档属性
| 名称 | 2019年浙教版科学中考冲刺重高专训10 酸碱盐探究题 |  | |
| 格式 | zip | ||
| 文件大小 | 328.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-03-05 08:27:17 | ||
图片预览



文档简介
冲刺重高专训10 酸碱盐探究题
本专题包含探究复分解反应发生的条件、氢氧化钠的变质情况、酸碱盐成分。探究类题型是中学科学考查的重点,酸碱盐是初中科学化学部分的重点和难点。
专题一 探究复分解反应发生的条件
1.为了探究复分解反应发生的实质,提高实验探究能力,A、B、C三组同学根据三个特殊的复分解反应设计了实验方案并开展了探究活动,请你参与他们的活动。
【实验探究】 A组: 探究中和反应。
在烧杯中加入氢氧化钾溶液后,滴几滴酚酞试液,然后逐滴加入稀盐酸,最后溶液为无色。小金认为溶液显中性,小东认为不对。小东按以下实验方案进行实验:
实验步骤
实验现象
结论
取少量反应后的溶液于试管中,加入碳酸钠溶液
有气泡产生
稀盐酸过量
B组:探究两种显碱性的溶液是可以反应的。
在烧杯中加入澄清石灰水,加入一定量的碳酸钠溶液后过滤。滤液中溶质是什么?
小方认为溶质是NaOH。
小欢认为溶质是NaOH、Ca(OH)2。
小华认为溶质还有可能是NaOH、Na2CO3。
小华思考后用以下方案验证了他的猜想。
实验步骤
实验现象
结论
取少量反应后的溶液于试管中,加入稀盐酸
有气泡产生
猜想正确
C组:探究两种盐溶液是可以反应的。
小妮在烧杯中加入硫酸钠溶液,加入一定量的硝酸钡溶液后有白色沉淀生成。小妮得出结论:两种盐溶液是可以反应的。该反应的化学方程式为Ba(NO3)2+Na2CO3===BaCO3↓+2NaNO3。
【延伸与拓展】 最后,A、B、C三个小组的同学把三个实验的废液倒在一起,结果发现:先有大量气泡产生,后有白色沉淀产生。过滤后得到无色澄清溶液。最终所得的滤液中一定含有的离子有Na+、Cl-、NO3-。
【反思与总结】 复分解反应的实质是两种离子接触后,生成了沉淀、气体或水。
【解析】 【A组】 最后溶液为无色,可能显酸性或中性,盐酸和碳酸盐能反应生成气体,可加入碳酸钠溶液检验。【B组】 澄清石灰水,加入一定量的碳酸钠溶液后过滤,Ca(OH)2与Na2CO3反应生成NaOH和CaCO3,若澄清石灰水与碳酸钠恰好完全反应,则过滤后的溶质为NaOH;若澄清石灰水过量,则溶质为NaOH、Ca(OH)2;若碳酸钠过量,则溶质为NaOH、Na2CO3。小华的猜想是有NaOH、Na2CO3,只要证明有Na2CO3存在就能证明其猜想正确。证明Na2CO3存在,可加入稀盐酸,如有气泡冒出,则证明猜想正确。【C组】 硫酸钠和硝酸钡反应生成碳酸钡沉淀和硝酸钠。【延伸与拓展】 大量气泡的产生是碳酸钠与盐酸反应的结果,所以肯定有氯化钠,白色沉淀的产生是硝酸钡和碳酸钠反应生成了碳酸钡沉淀和硝酸钠,故一定有硝酸钠。
2.(2017·浙江湖州)科学课上,老师告诉学生“能发生复分解反应的两种盐通常是可溶的”。有“通常”就有“例外”,能否找到某些可溶性盐和难溶性盐发生复分解反应的证据呢?科学兴趣小组的同学们进行了探究。
【查阅资料】 ①水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减少的方向进行。②了解到某些难溶性盐的溶解能力和颜色。
【实验取证】 取一支试管,加入少量AgNO3溶液,再加入过量NaCl溶液,有白色沉淀生成。再往该试管中加入少量KI溶液,白色沉淀转化为黄色沉淀。
【分析讨论】 (1)为什么要加入过量的NaCl溶液?请说明理由。使银离子全部沉淀。
(2)写出加入少量KI溶液后发生的反应的化学方程式:KI+AgCl===AgI↓+KCl。
(3)该反应能发生的原因是AgI在水中的溶解能力小于(填“大于”“等于”或“小于”)AgCl。
【得出结论】 某些可溶性盐和难溶性盐之间能发生复分解反应。
【解析】 (1)加入过量的氯化钠能保证将银离子全部沉淀。(2)碘化钾能与白色氯化银反应生成碘化银沉淀和氯化钾。(3)因为氯化银能转化生成碘化银,说明碘化银的溶解能力小于氯化银。
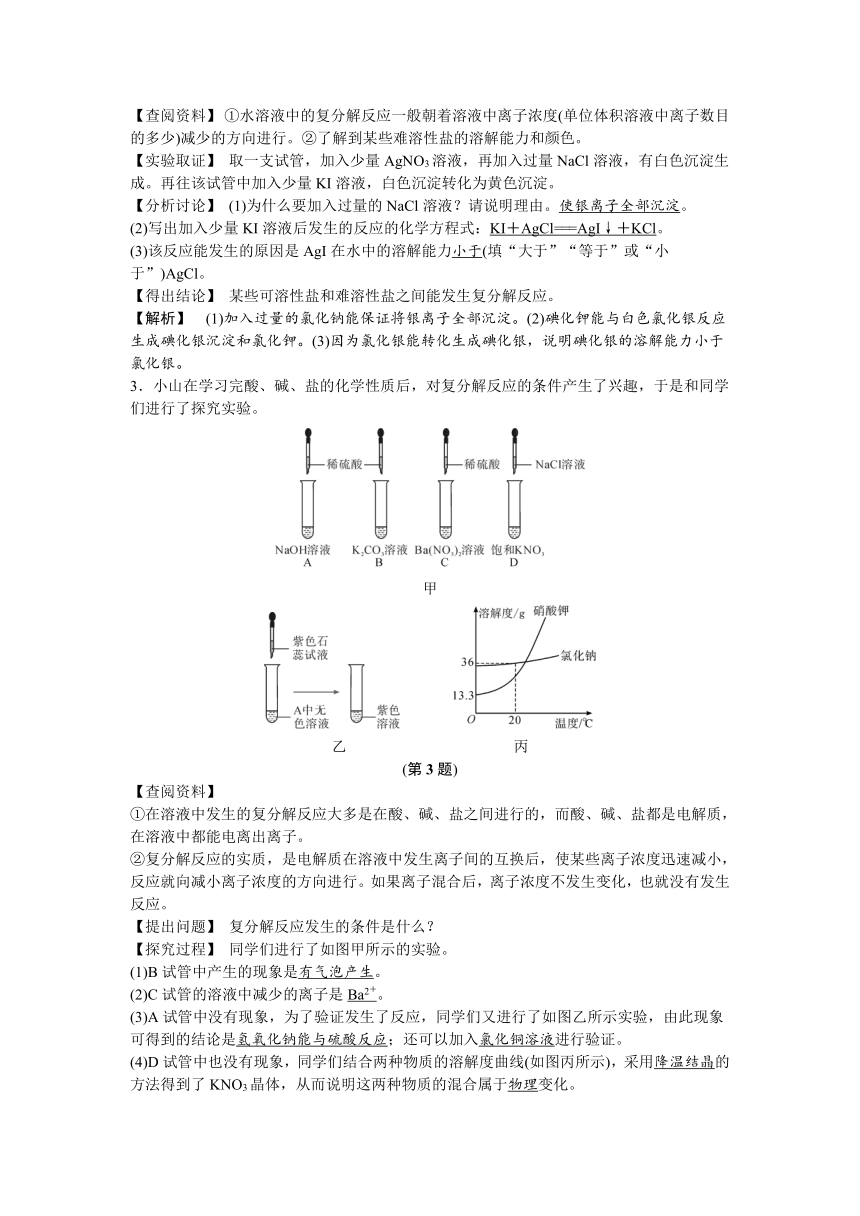
3.小山在学习完酸、碱、盐的化学性质后,对复分解反应的条件产生了兴趣,于是和同学们进行了探究实验。
甲
乙 丙
(第3题)
【查阅资料】
①在溶液中发生的复分解反应大多是在酸、碱、盐之间进行的,而酸、碱、盐都是电解质,在溶液中都能电离出离子。
②复分解反应的实质,是电解质在溶液中发生离子间的互换后,使某些离子浓度迅速减小,反应就向减小离子浓度的方向进行。如果离子混合后,离子浓度不发生变化,也就没有发生反应。
【提出问题】 复分解反应发生的条件是什么?
【探究过程】 同学们进行了如图甲所示的实验。
(1)B试管中产生的现象是有气泡产生。
(2)C试管的溶液中减少的离子是Ba2+。
(3)A试管中没有现象,为了验证发生了反应,同学们又进行了如图乙所示实验,由此现象可得到的结论是氢氧化钠能与硫酸反应;还可以加入氯化铜溶液进行验证。
(4)D试管中也没有现象,同学们结合两种物质的溶解度曲线(如图丙所示),采用降温结晶的方法得到了KNO3晶体,从而说明这两种物质的混合属于物理变化。
【得出结论】
(5)结合资料,同学们得出了结论:复分解反应发生的条件是有沉淀、气体或水生成。
【总结提升】
(6)从上面的探究过程,同学们也可得出“证明化学反应能发生的思路是证明有新物质生成或证明反应物消失”的结论。
【解析】 (1)B试管中碳酸钾与盐酸反应生成二氧化碳,故会有气泡产生。(2)C试管的溶液是硝酸钡溶液,加入稀硫酸则硫酸与硝酸钡反应生成硫酸钡沉淀,故其中减少的离子是Ba2+。(3)A 试管中没有现象,可以在反应后的溶液中加入紫色石蕊试液,仍然是紫色的,故说明溶液中没有氢氧化钠,要证明没有氢氧化钠,还可以加入氯化铜溶液,观察是否产生蓝色沉淀。(4)硝酸钾的溶解度随温度的升高增大明显,故可以采用降温结晶的方法得到KNO3晶体,从而说明两物质混合属于物理变化。(5)复分解反应发生的条件是有沉淀、气体或水生成。(6)要证明化学反应能发生的思路是证明有新物质生成或是证明反应物消失。
专题二 探究药品的变质情况
4.某同学检验一瓶NaOH溶液是否变质,设计了下列三种检验方法:①加少量饱和石灰水,若有沉淀生成,则氢氧化钠溶液已变质;②加少量稀盐酸,若有气泡产生,则氢氧化钠溶液已变质;③加少量Ba(OH)2溶液,若有沉淀生成,则氢氧化钠溶液已变质。其中方法和结论都正确的是(D)
A.只有①和② B.只有②和③
C.只有①和③ D.①②③
【解析】 ①碳酸钠可以和石灰水产生沉淀,但是氢氧化钠不能,故①正确;②碳酸钠可以和盐酸反应生成气体,而氢氧化钠不能,故②正确;③碳酸钠可以和氢氧化钡反应生成沉淀,而氢氧化钠不能,故③正确。
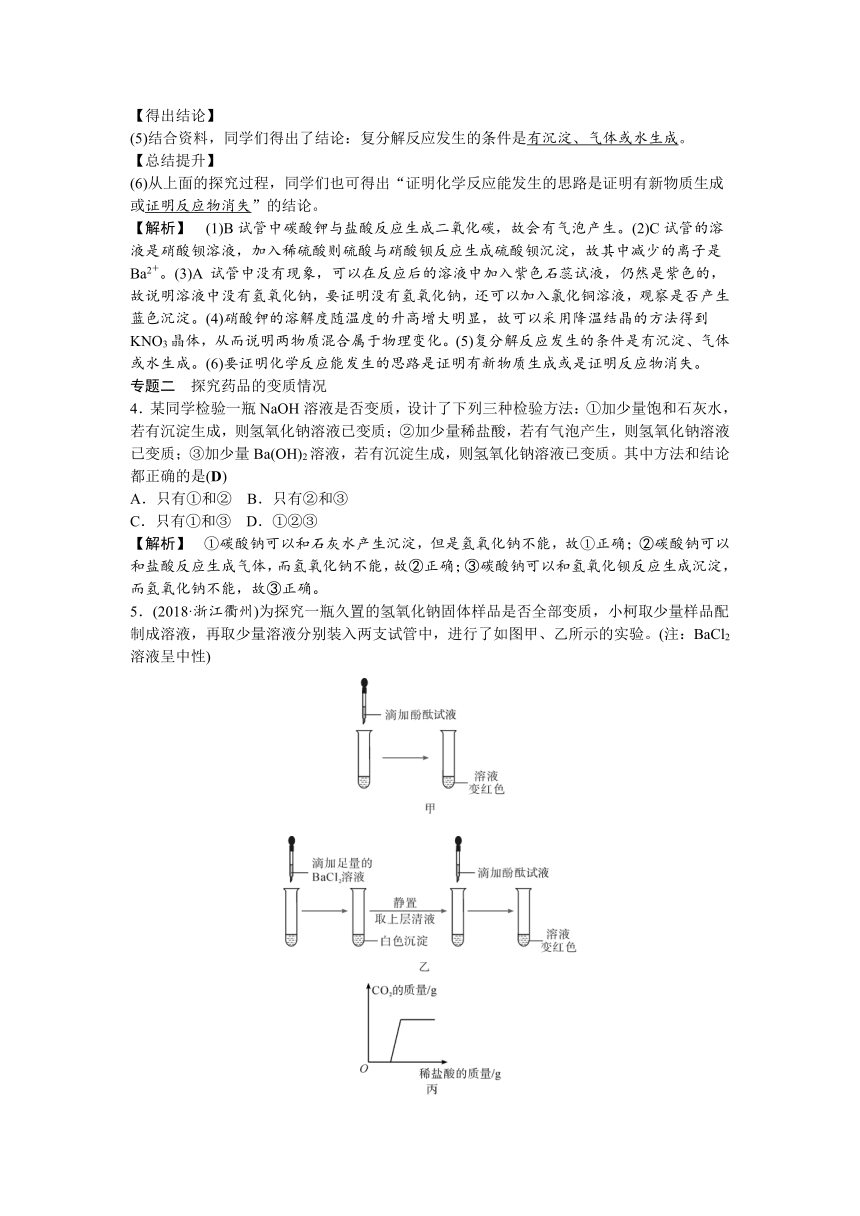
5.(2018·浙江衢州)为探究一瓶久置的氢氧化钠固体样品是否全部变质,小柯取少量样品配制成溶液,再取少量溶液分别装入两支试管中,进行了如图甲、乙所示的实验。(注:BaCl2溶液呈中性)
(第5题)
(1)小柯认为“图甲实验说明了氢氧化钠固体部分变质”。你认为小柯的观点是否正确?并说明理由。不正确,无论氢氧化钠是否完全变质,都会使酚酞试液变红。
(2)分析图乙实验的现象,可以确定样品的变质情况为部分变质。
(3)进一步探究:另取少量样品溶液,加入一定质量分数的稀盐酸,直至过量。请在图丙中画出生成CO2的质量随加入稀盐酸质量变化的大致图像。
【解析】 (1)氢氧化钠变质生成的碳酸钠溶液也呈碱性,也会使酚酚变红。(2)滴加BaCl2溶液中产生白色沉淀,有碳酸钡生成,说明氢氧化钠变质生成了碳酸钠,因滴加的量为足量,说明碳酸钠完全反应;取上层清液滴加酚酞试液,溶液变红,说明溶液呈碱性,所以溶液中还有氢氧化钠,由此说明溶液中有碳酸钠和氢氧化钠,即氢氧化钠部分变质。(3)因溶液中有碳酸钠和氢氧化钠,所以在刚开始滴加盐酸时,盐酸先与氢氧化钠反应,此时没有气泡产生,在氢氧化钠反应完全后,盐酸再与碳酸钠反应,有气泡产生,至反应结束。
6.(2017·贵州铜仁)某校科学兴趣小组的小王和小张两位同学对敞口放置在实验室的NaOH溶液产生了兴趣,他们根据已有知识经验分别进行实验探究:
【提出问题】 这瓶NaOH溶液肯定变质了,其变质程度怎样呢?
【猜想与假设】 小王:NaOH溶液部分变质。
小张:NaOH溶液全部变质。
小王、小张认为NaOH溶液一定变质的理由(用化学方程式表示):2NaOH+CO2===Na2CO3+H2O。
【进行实验】
(1)小王设计好方案后,进行了如下实验来验证自己的猜想,请你协助小王完成实验现象的填写:
实验步骤
现象
结论
①取一定量NaOH溶液样品于试管中,滴加足量BaCl2溶液
有白色沉淀产生
NaOH溶液部分变质
②取经过①反应后的滤液,向其中滴加紫色石蕊试液
溶液变成蓝色
(2)小张取用小王第①步反应后的滤液,滴加CuCl2溶液,有蓝色沉淀产生,证明自己的猜想错误。
【反思与评价】
(1)如果NaOH溶液中混有少量的Na2CO3杂质,常加入适量Ca(OH)2(填物质的化学式),再过滤除去该杂质。
(2)小王、小张通过以上探究分析推出:实验室里保存Ba(OH)2溶液的方法应该是密封保存。
【解析】 【猜想与假设】NaOH溶液一定变质的理由是氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水。
【进行实验】(1)①取一定量NaOH溶液样品于试管中,滴加足量BaCl2溶液有白色沉淀产生,说明溶液中含有碳酸钠。②取经过①反应后的滤液,向其中滴加紫色石蕊试液,溶液变蓝色,说明溶液中含有氢氧化钠。(2)小张取用小王第①步反应后的滤液,滴加CuCl2溶液,有蓝色沉淀产生,说明溶液中含有氢氧化钠,进一步证明自己的猜想错误。【反思与评价】(1)如果NaOH溶液中混有少量的Na2CO3杂质,常加入适量的氢氧化钙溶液,再过滤除去该杂质。(2)通过以上探究分析推出:氢氧化钡能和空气中的二氧化碳反应生成碳酸钡沉淀和水,因此实验室中保存Ba(OH)2溶液的方法应该是密封保存。
7.(2018·随州模拟)小明家有包开启了的发酵粉(小苏打,化学式为NaHCO3),久置在灶台上方,可能因受热而变质。小明对此开展了探究,请分析其过程并完成相关内容。
【查阅资料】 ①2NaHCO3Na2CO3+CO2↑+H2O;
②NaHCO3+NaOH===Na2CO3+H2O;
③2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O;
④Ca(HCO3)2+Na2CO3===CaCO3↓+2NaHCO3;
⑤Na2CO3受热不分解,NaHCO3、Ca(HCO3)2都能溶于水。
【假设猜想】 假设一:小苏打没有变质,化学成分为 NaHCO3。
假设二:小苏打完全变质,化学成分为Na2CO3。
假设三:小苏打部分变质,化学成分为NaHCO3和Na2CO3。
【实验方案】 可选药品:①Ca(OH)2溶液;②CaCl2溶液;③NaOH溶液;④稀盐酸。
实验操作
实验现象
实验结论
操作一:取小苏打样品少量溶于足量水后,加入过量的②(填药品编号,下同),观察,如有沉淀,则继续进行下一步操作。
操作二:待操作一中反应充分后过滤,并在滤液中加入过量的④观察。
操作一中无沉淀出现
假设一成立
操作一中有沉淀出现
假设二成立
操作二中产生气泡
假设三成立
【问题讨论】 有同学认为,取一定量样品直接加热,再将产生的气体通入澄清石灰水,根据实验现象,对上述三种假设的每一种是否成立都能进行判断。请评价这种方案是否合理及理由:否;不能判断是部分变质还是没有变质。
【解析】 【实验方案】 因为碳酸氢钠与氯化钙溶液不能发生化学反应,碳酸钠能与氯化钙溶液反应生成碳酸钙白色沉淀和氯化钠,碳酸氢钠能与氢氧化钙溶液反应生成碳酸钙白色沉淀、碳酸钠和水,故应用氯化钙溶液先检验碳酸钠的存在,再用氢氧化钙溶液来检验碳酸氢钠的存在。应先加过量氯化钙溶液,如果没有沉淀出现,那么假设一成立,如果有沉淀出现,那么说明溶液中存在碳酸钠,由于氯化钙过量,碳酸钠完全反应,继续加入稀盐酸,如果有气泡产生,那么说明溶液中还存在碳酸氢钠,假设三成立,如果没有气泡产生,那么假设二成立。【问题讨论】 无论碳酸氢钠没有变质还是部分变质,其中的碳酸氢钠加热都会产生二氧化碳气体,故这种方案不合理。
8.(2017·黑龙江绥化)一次用餐中,小丽对“固体酒精”产生好奇,于是她买回一袋,和同学一起对其进行研究。
【查阅资料】 固体酒精中含有酒精、氢氧化钠等物质。
【提出问题】 固体酒精中的氢氧化钠是否变质及变质的程度如何?
【提出猜想】 小丽猜想:没有变质,只含有氢氧化钠。
小明猜想:全部变质,只含有碳酸钠。
你的猜想:部分变质,含有氢氧化钠和碳酸钠。
氢氧化钠在空气中变质的化学方程式为CO2+2NaOH===Na2CO3+H2O。
【实验探究】 小丽取少量固体酒精在水中充分溶解后过滤,取上述滤液于试管中,滴入几滴稀盐酸,无明显现象;小丽说氢氧化钠没有变质,小明认为她的结论不正确,其理由是氢氧化钠和碳酸钠同时存在时,加入少量盐酸,盐酸先和氢氧化钠反应,无明显现象。
请你补全实验设计,填写表格中的①②③,证明固体酒精中氢氧化钠是否变质及变质的程度如何。
实验操作
实验现象
实验结论
①用试管取少量滤液加入过量的稀盐酸,充分反应
有气泡产生
小丽的猜想不正确
②用试管取少量滤液加入过量的氯化钙溶液,充分反应后,再加入几滴酚酞试液
③有白色沉淀产生,溶液变红色
你的猜想正确
【拓展应用】 除去部分变质的氢氧化钠溶液中的杂质,方法是Ca(OH)2+Na2CO3===CaCO3↓+2NaOH(或Ba(OH)2+Na2CO3===BaCO3↓+2NaOH,合理均可)(用化学方程式表示)。
【解析】 【提出猜想】氢氧化钠易与空气中的二氧化碳反应生成碳酸钠和水。【实验探究】氢氧化钠和碳酸钠同时存在时,加入少量盐酸,盐酸先和氢氧化钠反应,无明显现象,继续加入盐酸至氢氧化钠完全反应后,盐酸与碳酸钠反应才会有气泡产生,所以该结论不正确。用试管取少量滤液加入过量的稀盐酸,充分反应,有气泡产生,小丽的猜想不成立。用试管取少量滤液加入过量的氯化钙溶液,充分反应后再加入几滴酚酞试液,有白色沉淀产生,溶液变红色,则你的猜想成立。【拓展应用】如果氢氧化钠变质了,那么溶液中存在碳酸钠,可以向溶液中加入适量的氢氧化钡溶液或氢氧化钙溶液将碳酸钠除去,并且不带入新杂质。
专题三 酸碱盐成分的探究
9.(2018·湖南益阳)某科学兴趣小组的同学在整理化学药品柜时,发现有一瓶标签受损的无色溶液(受损标签如图所示)。咨询实验老师得知,这瓶无色溶液是一种常用的盐溶液。小组同学对这瓶溶液进行了如下探究:
(第9题)
【提出问题】 这瓶无色溶液是什么物质的溶液?
【猜想与假设】 小组同学提出了如下假设:
①碳酸钠溶液;②硫酸钠溶液;③氯化钠溶液。
【讨论交流】 在老师的指导下,小组同学经过讨论,认为有一条假设不合理。请你指出不合理的假设,并说明不合理的理由:③,氯化钠中不含氧元素。
【查阅资料】 硫酸钡既不溶解于水又不溶解于酸;碳酸钠溶液呈碱性;Ba(OH)2 的化学性质与Ca(OH)2相似。
【进行实验】 小组同学设计并进行了如下实验,请你完善小组同学的“相互评价”。
组次
实验操作
出现的现象与结论
同学相互评价
第1组
产生白色沉淀,第 1 组同学认为猜想②成立
第2组同学认为此方案结论不正确。你认为其理由是硫酸钡和碳酸钡都不溶于水
第2组
试管中无明显现象,第2 组同学认为猜想②成立
第3组同学认为此方案结论不正确。你认为其理由可能是氢氧化钠和盐酸反应也没有明显现象
第3组
溶液无明显变化,第3组同学认为猜想②成立
第1组同学认为此方案结论正确。你认为实验中用点滴板比试管具有更多的优点是节约样品(写一条即可)
【实验反思】 针对上述情况,小组同学总结了取用药品时的各种注意事项。你认为倾倒液体药品时,要注意标签向着手心。
【解析】 【讨论交流】残缺的标签中含有氧元素,所以不可能是氯化钠。【进行实验】碳酸钡、硫酸钡都难溶于水,氢氧化钠和盐酸反应没有明显现象,碳酸钠溶液显碱性。【实验反思】倾倒液体药品时,要注意标签向着手心,防止腐蚀标签。
10.(2017·湖南衡阳)实验室有一瓶标签腐蚀的溶液A(如图所示),某组同学将碳酸钠溶液与样品反应,有白色沉淀产生,过滤后得到澄清滤液,同学们进行了一系列的探究。
(第10题)
探究一:A溶液中溶质是什么?
【提出猜想】 ①CaCl2,②Ca(OH)2。
【查阅资料】 CaCl2溶液呈中性。
【设计实验】 同学们设计了如下方案并进行实验。
实验操作
实验现象
实验结论
取少量A溶液于试管中,向其中滴加无色酚酞试液
溶液不变色
猜想①正确
碳酸钠与其反应的化学方程式为Na2CO3+CaCl2===CaCO3↓+2NaCl。
探究二:过滤后的滤液中会有哪些溶质?
【提出猜想】 小明的猜想:NaCl、CaCl2;小红的猜想:NaCl;你的猜想:NaCl和Na2CO3。
【设计实验】 请设计实验对“你的猜想”进行验证:
实验步骤
实验现象
实验结论
取少量过滤后的溶液于试管中,向其中滴入盐酸
有气泡产生
猜想正确
【解析】 探究一:【提出猜想】由标签可知,溶质为钙的化合物,能与碳酸钠反应说明可能是氢氧化钙或氯化钙。【设计实验】由于氢氧化钙溶液显碱性,氯化钙溶液呈中性,所以加入酚酞试液溶液不变色证明猜想①成立。探究二:【提出猜想】由于碳酸钠与氯化钙反应生成了碳酸钙沉淀和氯化钠,由于反应物的取用量不同,过滤后澄清滤液中的溶质可能是NaCl和Na2CO3或NaCl或NaCl和CaCl2。【设计实验】碳酸钠与盐酸反应生成二氧化碳气体,可以证明碳酸钠的存在。
11.(2017·山东菏泽)实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图甲所示),科学小组的同学经过询问老师后只知道是NaCl、NaOH、Na2CO3、NaHCO3溶液中的一种,为确认原瓶中是何种溶质并判断其是否变质,科学小组的同学进行了如下的探究活动:
(第11题甲)
【进行猜想】 猜想Ⅰ:原溶液的溶质是NaCl。
猜想Ⅱ:原溶液的溶质是NaOH。
猜想Ⅲ:原溶液的溶质是Na2CO3。
猜想Ⅳ:原溶液的溶质是NaHCO3。
【查阅资料】 常温下,有关物质的相关信息如下表:
物质
NaCl
NaOH
Na2CO3
NaHCO3
常温下的溶解度/g
36
109
21.5
9.6
常温下稀溶液的pH
7
13
11
9
从物质的相关信息可知,原溶液的溶质一定不是NaHCO3,因为碳酸氢钠饱和溶液的溶质质量分数在该温度下不能达到10%。
【进行实验】
(1)取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是NaCl。
(2)同学们另取样品又进行了如图乙所示实验,实验过程如下:
(第11题乙)
①写出生成白色沉淀A的反应的化学方程式:Na2CO3+CaCl2===CaCO3↓+2NaCl。
②通过实验可以判断样品无色溶液中含有的溶质有NaOH、Na2CO3。
【获得结论】 实验完成后,最终得到的结论:原瓶中的溶质是NaOH,且已变质。
【解析】 【查阅资料】根据计算可以知道在20 ℃时饱和碳酸氢钠的质量分数为×100%≈8.8%<10%,所以能够排除碳酸氢钠。【进行实验】(1)测定溶液的pH大于7,而氯化钠溶液呈中性,所以不可能是氯化钠。(2)①过量氯化钙溶液可以检验并除尽碳酸钠,碳酸钠可以和氯化钙反应生成碳酸钙沉淀和氯化钠。②滴加无色酚酞试液,滤液变红,说明溶液呈碱性,还有氢氧化钠,可以判断原无色溶液中含有的溶质有NaOH、Na2CO3。【获得结论】该瓶原来装的无色溶液的溶质是NaOH,并且部分变质。
12.(2018·山东威海)某纯碱厂生产的某批次碳酸钠产品中可能含有氯化钠杂质。
【定性检验】 (1)要确定该产品中是否含有杂质氯化钠,你的方法是取少量样品于试管中,加入足量稀硝酸,再加入硝酸银溶液,若观察到产生白色沉淀,则证明样品中含有氯化钠。
【定量测定】 (2)若利用沉淀法测定该产品中碳酸钠的质量分数,你确定的反应原理是Na2CO3+BaCl2===BaCO3↓+2NaCl(或NaCO3+CaCl2===CaCO3↓+2NaCl)(用化学方程式表示)。
(3)根据你确定的反应原理,你需要通过实验测量沉淀BaCO3(或CaCO3)(填化学式)的质量。
(4)假设你取样的质量为m1、测得的沉淀的质量为m2,请你设计实验方案获取数据m1、m2,把方案填在下表中。
适用的仪器名称
实验步骤
烧杯、玻璃棒、胶头滴管、铁架台(带铁圈)、漏斗、托盘天平、洗瓶、干燥仪器
①称量样品的质量;②溶解;③加试剂(需指明试剂过量或足量);④过滤;⑤洗涤、干燥;⑥称量沉淀的质量
【数据处理】 (5)请用含m1、m2的式子表示所测样品中碳酸钠的质量分数:×100%(或×100%)。
【分析讨论】 (6)要测定混合物中某成分的含量,可通过化学方法将不易测定的物质转化为易测量的物质。除沉淀法外,还可依据反应Na2CO3+2HCl===2NaCl+H2O+CO2↑(用化学方程式表示)来测定该纯碱样品中碳酸钠的质量分数。导学号:16786010
【解析】 (1)要检验碳酸钠中是否含有氯化钠就需要先排除碳酸钠的影响,可取样品于试管中,加入足量的稀硝酸,使碳酸钠反应完全,再加入硝酸银溶液,观察是否产生白色沉淀。(2)若利用沉淀法测定该产品中碳酸钠的质量分数,可以向待测溶液中加入过量的氯化钡溶液(或氯化钙溶液),碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠(或碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠)。(3)根据生成碳酸钡沉淀或碳酸钙沉淀的质量来计算出碳酸钠的质量。(4)需要称取一定质量的样品并将其溶解,然后加入足量的氯化钡溶液或氯化钙溶液,实验结束后将沉淀过滤出来,洗涤干燥称量。(5)若是利用过量的氯化钡溶液来测定的话,设碳酸钠的质量为x,则:
Na2CO3+BaCl2===BaCO3↓+2NaCl
106 197
x m2
= x=
则所测样品中碳酸钠的质量分数为×100%=×100%。
若是利用过量的氯化钙溶液来测定的话,设碳酸钠的质量为y,则:
Na2CO3+CaCl2===CaCO3↓+2NaCl
106 100
y m2
= y=
则所测样品中碳酸钠的质量分数为×100%=×100%。
(6)利用氯化钠与盐酸不反应,碳酸钠能与稀盐酸反应生成氯化钠、水和二氧化碳,将反应生成的气体干燥后用足量的氢氧化钠溶液来吸收,根据氢氧化钠溶液增重的质量(即生成二氧化碳的质量),通过化学方程式计算出碳酸钠的质量,并进一步计算出该纯碱样品中碳酸钠的质量分数。
13.(2017·浙江金华)小苏打(NaHCO3)和食盐(NaCl)是厨房中常用的物质。现有一包白色固体,可能由NaHCO3和NaCl中的一种或两种组成。某科学小组的同学展开了一系列拓展性探究。
(1)定性分析:
【实验目的】 确定白色固体的组成。
【实验方案】
(第13题甲)
【实验结论】 该白色固体由NaHCO3和NaCl两种物质组成。
①基于上述实验结论,步骤①中加入的过量稀酸应该是稀硝酸。
②写出步骤②中生成白色沉淀的化学反应方程式:CO2+Ca(OH)2===CaCO3↓+H2O。
(2)定量分析:
【实验目的】 测定该白色固体中NaHCO3的质量分数。
为了测定该样品中NaHCO3的质量分数,小吕、小周分别取a克该样品,设计了如下方案:
小吕方案:利用NaHCO3与稀硫酸反应产生CO2,通过测定生成CO2的质量,计算样品中NaHCO3的质量分数。
①小吕用如图乙所示的装置完成本实验,装置的连接顺序是ADBEC(或ADBCE)(填字母,装置不重复使用)。
(第13题乙)
②装置D中的反应完全后,需再次通入空气,其目的是把生成的二氧化碳全部排入装置E(或C)中,使之充分被吸收。
小周方案:小周用沉淀法测定样品中NaHCO3的质量分数,操作流程如图丙所示。
(已知:NaHCO3+NaOH===Na2CO3+H2O)
(第13题丙)
③为使定量分析更准确,在操作Ⅰ之前,需判断所加BaCl2溶液是否过量,请你设计一个合理方案:待浊液澄清后,继续滴加BaCl2溶液,若无沉淀产生则说明BaCl2已过量。导学号:16786011
【解析】 (1)①由图甲可知,加入的酸不影响后续Cl-的检验,可知是稀硝酸。②CO2使澄清石灰水变浑浊的化学反应方程式为CO2+Ca(OH)2===CaCO3↓+H2O。(2)①A瓶可以除去空气中的CO2,要置于反应装置D前,B瓶浓硫酸用于除去气体中的水蒸气,因此置于反应装置D后,C、E用于吸收CO2和尾气处理,因此装置的连接顺序可以是ADBEC或ADBCE。②需再次通入空气,其目的是把生成的二氧化碳全部排入装置E或C中,使之充分被吸收。③判断所加BaCl2溶液是否过量,可以待浊液澄清后,继续滴加BaCl2溶液,若无沉淀产生则说明BaCl2已过量。
本专题包含探究复分解反应发生的条件、氢氧化钠的变质情况、酸碱盐成分。探究类题型是中学科学考查的重点,酸碱盐是初中科学化学部分的重点和难点。
专题一 探究复分解反应发生的条件
1.为了探究复分解反应发生的实质,提高实验探究能力,A、B、C三组同学根据三个特殊的复分解反应设计了实验方案并开展了探究活动,请你参与他们的活动。
【实验探究】 A组: 探究中和反应。
在烧杯中加入氢氧化钾溶液后,滴几滴酚酞试液,然后逐滴加入稀盐酸,最后溶液为无色。小金认为溶液显中性,小东认为不对。小东按以下实验方案进行实验:
实验步骤
实验现象
结论
取少量反应后的溶液于试管中,加入碳酸钠溶液
有气泡产生
稀盐酸过量
B组:探究两种显碱性的溶液是可以反应的。
在烧杯中加入澄清石灰水,加入一定量的碳酸钠溶液后过滤。滤液中溶质是什么?
小方认为溶质是NaOH。
小欢认为溶质是NaOH、Ca(OH)2。
小华认为溶质还有可能是NaOH、Na2CO3。
小华思考后用以下方案验证了他的猜想。
实验步骤
实验现象
结论
取少量反应后的溶液于试管中,加入稀盐酸
有气泡产生
猜想正确
C组:探究两种盐溶液是可以反应的。
小妮在烧杯中加入硫酸钠溶液,加入一定量的硝酸钡溶液后有白色沉淀生成。小妮得出结论:两种盐溶液是可以反应的。该反应的化学方程式为Ba(NO3)2+Na2CO3===BaCO3↓+2NaNO3。
【延伸与拓展】 最后,A、B、C三个小组的同学把三个实验的废液倒在一起,结果发现:先有大量气泡产生,后有白色沉淀产生。过滤后得到无色澄清溶液。最终所得的滤液中一定含有的离子有Na+、Cl-、NO3-。
【反思与总结】 复分解反应的实质是两种离子接触后,生成了沉淀、气体或水。
【解析】 【A组】 最后溶液为无色,可能显酸性或中性,盐酸和碳酸盐能反应生成气体,可加入碳酸钠溶液检验。【B组】 澄清石灰水,加入一定量的碳酸钠溶液后过滤,Ca(OH)2与Na2CO3反应生成NaOH和CaCO3,若澄清石灰水与碳酸钠恰好完全反应,则过滤后的溶质为NaOH;若澄清石灰水过量,则溶质为NaOH、Ca(OH)2;若碳酸钠过量,则溶质为NaOH、Na2CO3。小华的猜想是有NaOH、Na2CO3,只要证明有Na2CO3存在就能证明其猜想正确。证明Na2CO3存在,可加入稀盐酸,如有气泡冒出,则证明猜想正确。【C组】 硫酸钠和硝酸钡反应生成碳酸钡沉淀和硝酸钠。【延伸与拓展】 大量气泡的产生是碳酸钠与盐酸反应的结果,所以肯定有氯化钠,白色沉淀的产生是硝酸钡和碳酸钠反应生成了碳酸钡沉淀和硝酸钠,故一定有硝酸钠。
2.(2017·浙江湖州)科学课上,老师告诉学生“能发生复分解反应的两种盐通常是可溶的”。有“通常”就有“例外”,能否找到某些可溶性盐和难溶性盐发生复分解反应的证据呢?科学兴趣小组的同学们进行了探究。
【查阅资料】 ①水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减少的方向进行。②了解到某些难溶性盐的溶解能力和颜色。
【实验取证】 取一支试管,加入少量AgNO3溶液,再加入过量NaCl溶液,有白色沉淀生成。再往该试管中加入少量KI溶液,白色沉淀转化为黄色沉淀。
【分析讨论】 (1)为什么要加入过量的NaCl溶液?请说明理由。使银离子全部沉淀。
(2)写出加入少量KI溶液后发生的反应的化学方程式:KI+AgCl===AgI↓+KCl。
(3)该反应能发生的原因是AgI在水中的溶解能力小于(填“大于”“等于”或“小于”)AgCl。
【得出结论】 某些可溶性盐和难溶性盐之间能发生复分解反应。
【解析】 (1)加入过量的氯化钠能保证将银离子全部沉淀。(2)碘化钾能与白色氯化银反应生成碘化银沉淀和氯化钾。(3)因为氯化银能转化生成碘化银,说明碘化银的溶解能力小于氯化银。
3.小山在学习完酸、碱、盐的化学性质后,对复分解反应的条件产生了兴趣,于是和同学们进行了探究实验。
甲
乙 丙
(第3题)
【查阅资料】
①在溶液中发生的复分解反应大多是在酸、碱、盐之间进行的,而酸、碱、盐都是电解质,在溶液中都能电离出离子。
②复分解反应的实质,是电解质在溶液中发生离子间的互换后,使某些离子浓度迅速减小,反应就向减小离子浓度的方向进行。如果离子混合后,离子浓度不发生变化,也就没有发生反应。
【提出问题】 复分解反应发生的条件是什么?
【探究过程】 同学们进行了如图甲所示的实验。
(1)B试管中产生的现象是有气泡产生。
(2)C试管的溶液中减少的离子是Ba2+。
(3)A试管中没有现象,为了验证发生了反应,同学们又进行了如图乙所示实验,由此现象可得到的结论是氢氧化钠能与硫酸反应;还可以加入氯化铜溶液进行验证。
(4)D试管中也没有现象,同学们结合两种物质的溶解度曲线(如图丙所示),采用降温结晶的方法得到了KNO3晶体,从而说明这两种物质的混合属于物理变化。
【得出结论】
(5)结合资料,同学们得出了结论:复分解反应发生的条件是有沉淀、气体或水生成。
【总结提升】
(6)从上面的探究过程,同学们也可得出“证明化学反应能发生的思路是证明有新物质生成或证明反应物消失”的结论。
【解析】 (1)B试管中碳酸钾与盐酸反应生成二氧化碳,故会有气泡产生。(2)C试管的溶液是硝酸钡溶液,加入稀硫酸则硫酸与硝酸钡反应生成硫酸钡沉淀,故其中减少的离子是Ba2+。(3)A 试管中没有现象,可以在反应后的溶液中加入紫色石蕊试液,仍然是紫色的,故说明溶液中没有氢氧化钠,要证明没有氢氧化钠,还可以加入氯化铜溶液,观察是否产生蓝色沉淀。(4)硝酸钾的溶解度随温度的升高增大明显,故可以采用降温结晶的方法得到KNO3晶体,从而说明两物质混合属于物理变化。(5)复分解反应发生的条件是有沉淀、气体或水生成。(6)要证明化学反应能发生的思路是证明有新物质生成或是证明反应物消失。
专题二 探究药品的变质情况
4.某同学检验一瓶NaOH溶液是否变质,设计了下列三种检验方法:①加少量饱和石灰水,若有沉淀生成,则氢氧化钠溶液已变质;②加少量稀盐酸,若有气泡产生,则氢氧化钠溶液已变质;③加少量Ba(OH)2溶液,若有沉淀生成,则氢氧化钠溶液已变质。其中方法和结论都正确的是(D)
A.只有①和② B.只有②和③
C.只有①和③ D.①②③
【解析】 ①碳酸钠可以和石灰水产生沉淀,但是氢氧化钠不能,故①正确;②碳酸钠可以和盐酸反应生成气体,而氢氧化钠不能,故②正确;③碳酸钠可以和氢氧化钡反应生成沉淀,而氢氧化钠不能,故③正确。
5.(2018·浙江衢州)为探究一瓶久置的氢氧化钠固体样品是否全部变质,小柯取少量样品配制成溶液,再取少量溶液分别装入两支试管中,进行了如图甲、乙所示的实验。(注:BaCl2溶液呈中性)
(第5题)
(1)小柯认为“图甲实验说明了氢氧化钠固体部分变质”。你认为小柯的观点是否正确?并说明理由。不正确,无论氢氧化钠是否完全变质,都会使酚酞试液变红。
(2)分析图乙实验的现象,可以确定样品的变质情况为部分变质。
(3)进一步探究:另取少量样品溶液,加入一定质量分数的稀盐酸,直至过量。请在图丙中画出生成CO2的质量随加入稀盐酸质量变化的大致图像。
【解析】 (1)氢氧化钠变质生成的碳酸钠溶液也呈碱性,也会使酚酚变红。(2)滴加BaCl2溶液中产生白色沉淀,有碳酸钡生成,说明氢氧化钠变质生成了碳酸钠,因滴加的量为足量,说明碳酸钠完全反应;取上层清液滴加酚酞试液,溶液变红,说明溶液呈碱性,所以溶液中还有氢氧化钠,由此说明溶液中有碳酸钠和氢氧化钠,即氢氧化钠部分变质。(3)因溶液中有碳酸钠和氢氧化钠,所以在刚开始滴加盐酸时,盐酸先与氢氧化钠反应,此时没有气泡产生,在氢氧化钠反应完全后,盐酸再与碳酸钠反应,有气泡产生,至反应结束。
6.(2017·贵州铜仁)某校科学兴趣小组的小王和小张两位同学对敞口放置在实验室的NaOH溶液产生了兴趣,他们根据已有知识经验分别进行实验探究:
【提出问题】 这瓶NaOH溶液肯定变质了,其变质程度怎样呢?
【猜想与假设】 小王:NaOH溶液部分变质。
小张:NaOH溶液全部变质。
小王、小张认为NaOH溶液一定变质的理由(用化学方程式表示):2NaOH+CO2===Na2CO3+H2O。
【进行实验】
(1)小王设计好方案后,进行了如下实验来验证自己的猜想,请你协助小王完成实验现象的填写:
实验步骤
现象
结论
①取一定量NaOH溶液样品于试管中,滴加足量BaCl2溶液
有白色沉淀产生
NaOH溶液部分变质
②取经过①反应后的滤液,向其中滴加紫色石蕊试液
溶液变成蓝色
(2)小张取用小王第①步反应后的滤液,滴加CuCl2溶液,有蓝色沉淀产生,证明自己的猜想错误。
【反思与评价】
(1)如果NaOH溶液中混有少量的Na2CO3杂质,常加入适量Ca(OH)2(填物质的化学式),再过滤除去该杂质。
(2)小王、小张通过以上探究分析推出:实验室里保存Ba(OH)2溶液的方法应该是密封保存。
【解析】 【猜想与假设】NaOH溶液一定变质的理由是氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水。
【进行实验】(1)①取一定量NaOH溶液样品于试管中,滴加足量BaCl2溶液有白色沉淀产生,说明溶液中含有碳酸钠。②取经过①反应后的滤液,向其中滴加紫色石蕊试液,溶液变蓝色,说明溶液中含有氢氧化钠。(2)小张取用小王第①步反应后的滤液,滴加CuCl2溶液,有蓝色沉淀产生,说明溶液中含有氢氧化钠,进一步证明自己的猜想错误。【反思与评价】(1)如果NaOH溶液中混有少量的Na2CO3杂质,常加入适量的氢氧化钙溶液,再过滤除去该杂质。(2)通过以上探究分析推出:氢氧化钡能和空气中的二氧化碳反应生成碳酸钡沉淀和水,因此实验室中保存Ba(OH)2溶液的方法应该是密封保存。
7.(2018·随州模拟)小明家有包开启了的发酵粉(小苏打,化学式为NaHCO3),久置在灶台上方,可能因受热而变质。小明对此开展了探究,请分析其过程并完成相关内容。
【查阅资料】 ①2NaHCO3Na2CO3+CO2↑+H2O;
②NaHCO3+NaOH===Na2CO3+H2O;
③2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O;
④Ca(HCO3)2+Na2CO3===CaCO3↓+2NaHCO3;
⑤Na2CO3受热不分解,NaHCO3、Ca(HCO3)2都能溶于水。
【假设猜想】 假设一:小苏打没有变质,化学成分为 NaHCO3。
假设二:小苏打完全变质,化学成分为Na2CO3。
假设三:小苏打部分变质,化学成分为NaHCO3和Na2CO3。
【实验方案】 可选药品:①Ca(OH)2溶液;②CaCl2溶液;③NaOH溶液;④稀盐酸。
实验操作
实验现象
实验结论
操作一:取小苏打样品少量溶于足量水后,加入过量的②(填药品编号,下同),观察,如有沉淀,则继续进行下一步操作。
操作二:待操作一中反应充分后过滤,并在滤液中加入过量的④观察。
操作一中无沉淀出现
假设一成立
操作一中有沉淀出现
假设二成立
操作二中产生气泡
假设三成立
【问题讨论】 有同学认为,取一定量样品直接加热,再将产生的气体通入澄清石灰水,根据实验现象,对上述三种假设的每一种是否成立都能进行判断。请评价这种方案是否合理及理由:否;不能判断是部分变质还是没有变质。
【解析】 【实验方案】 因为碳酸氢钠与氯化钙溶液不能发生化学反应,碳酸钠能与氯化钙溶液反应生成碳酸钙白色沉淀和氯化钠,碳酸氢钠能与氢氧化钙溶液反应生成碳酸钙白色沉淀、碳酸钠和水,故应用氯化钙溶液先检验碳酸钠的存在,再用氢氧化钙溶液来检验碳酸氢钠的存在。应先加过量氯化钙溶液,如果没有沉淀出现,那么假设一成立,如果有沉淀出现,那么说明溶液中存在碳酸钠,由于氯化钙过量,碳酸钠完全反应,继续加入稀盐酸,如果有气泡产生,那么说明溶液中还存在碳酸氢钠,假设三成立,如果没有气泡产生,那么假设二成立。【问题讨论】 无论碳酸氢钠没有变质还是部分变质,其中的碳酸氢钠加热都会产生二氧化碳气体,故这种方案不合理。
8.(2017·黑龙江绥化)一次用餐中,小丽对“固体酒精”产生好奇,于是她买回一袋,和同学一起对其进行研究。
【查阅资料】 固体酒精中含有酒精、氢氧化钠等物质。
【提出问题】 固体酒精中的氢氧化钠是否变质及变质的程度如何?
【提出猜想】 小丽猜想:没有变质,只含有氢氧化钠。
小明猜想:全部变质,只含有碳酸钠。
你的猜想:部分变质,含有氢氧化钠和碳酸钠。
氢氧化钠在空气中变质的化学方程式为CO2+2NaOH===Na2CO3+H2O。
【实验探究】 小丽取少量固体酒精在水中充分溶解后过滤,取上述滤液于试管中,滴入几滴稀盐酸,无明显现象;小丽说氢氧化钠没有变质,小明认为她的结论不正确,其理由是氢氧化钠和碳酸钠同时存在时,加入少量盐酸,盐酸先和氢氧化钠反应,无明显现象。
请你补全实验设计,填写表格中的①②③,证明固体酒精中氢氧化钠是否变质及变质的程度如何。
实验操作
实验现象
实验结论
①用试管取少量滤液加入过量的稀盐酸,充分反应
有气泡产生
小丽的猜想不正确
②用试管取少量滤液加入过量的氯化钙溶液,充分反应后,再加入几滴酚酞试液
③有白色沉淀产生,溶液变红色
你的猜想正确
【拓展应用】 除去部分变质的氢氧化钠溶液中的杂质,方法是Ca(OH)2+Na2CO3===CaCO3↓+2NaOH(或Ba(OH)2+Na2CO3===BaCO3↓+2NaOH,合理均可)(用化学方程式表示)。
【解析】 【提出猜想】氢氧化钠易与空气中的二氧化碳反应生成碳酸钠和水。【实验探究】氢氧化钠和碳酸钠同时存在时,加入少量盐酸,盐酸先和氢氧化钠反应,无明显现象,继续加入盐酸至氢氧化钠完全反应后,盐酸与碳酸钠反应才会有气泡产生,所以该结论不正确。用试管取少量滤液加入过量的稀盐酸,充分反应,有气泡产生,小丽的猜想不成立。用试管取少量滤液加入过量的氯化钙溶液,充分反应后再加入几滴酚酞试液,有白色沉淀产生,溶液变红色,则你的猜想成立。【拓展应用】如果氢氧化钠变质了,那么溶液中存在碳酸钠,可以向溶液中加入适量的氢氧化钡溶液或氢氧化钙溶液将碳酸钠除去,并且不带入新杂质。
专题三 酸碱盐成分的探究
9.(2018·湖南益阳)某科学兴趣小组的同学在整理化学药品柜时,发现有一瓶标签受损的无色溶液(受损标签如图所示)。咨询实验老师得知,这瓶无色溶液是一种常用的盐溶液。小组同学对这瓶溶液进行了如下探究:
(第9题)
【提出问题】 这瓶无色溶液是什么物质的溶液?
【猜想与假设】 小组同学提出了如下假设:
①碳酸钠溶液;②硫酸钠溶液;③氯化钠溶液。
【讨论交流】 在老师的指导下,小组同学经过讨论,认为有一条假设不合理。请你指出不合理的假设,并说明不合理的理由:③,氯化钠中不含氧元素。
【查阅资料】 硫酸钡既不溶解于水又不溶解于酸;碳酸钠溶液呈碱性;Ba(OH)2 的化学性质与Ca(OH)2相似。
【进行实验】 小组同学设计并进行了如下实验,请你完善小组同学的“相互评价”。
组次
实验操作
出现的现象与结论
同学相互评价
第1组
产生白色沉淀,第 1 组同学认为猜想②成立
第2组同学认为此方案结论不正确。你认为其理由是硫酸钡和碳酸钡都不溶于水
第2组
试管中无明显现象,第2 组同学认为猜想②成立
第3组同学认为此方案结论不正确。你认为其理由可能是氢氧化钠和盐酸反应也没有明显现象
第3组
溶液无明显变化,第3组同学认为猜想②成立
第1组同学认为此方案结论正确。你认为实验中用点滴板比试管具有更多的优点是节约样品(写一条即可)
【实验反思】 针对上述情况,小组同学总结了取用药品时的各种注意事项。你认为倾倒液体药品时,要注意标签向着手心。
【解析】 【讨论交流】残缺的标签中含有氧元素,所以不可能是氯化钠。【进行实验】碳酸钡、硫酸钡都难溶于水,氢氧化钠和盐酸反应没有明显现象,碳酸钠溶液显碱性。【实验反思】倾倒液体药品时,要注意标签向着手心,防止腐蚀标签。
10.(2017·湖南衡阳)实验室有一瓶标签腐蚀的溶液A(如图所示),某组同学将碳酸钠溶液与样品反应,有白色沉淀产生,过滤后得到澄清滤液,同学们进行了一系列的探究。
(第10题)
探究一:A溶液中溶质是什么?
【提出猜想】 ①CaCl2,②Ca(OH)2。
【查阅资料】 CaCl2溶液呈中性。
【设计实验】 同学们设计了如下方案并进行实验。
实验操作
实验现象
实验结论
取少量A溶液于试管中,向其中滴加无色酚酞试液
溶液不变色
猜想①正确
碳酸钠与其反应的化学方程式为Na2CO3+CaCl2===CaCO3↓+2NaCl。
探究二:过滤后的滤液中会有哪些溶质?
【提出猜想】 小明的猜想:NaCl、CaCl2;小红的猜想:NaCl;你的猜想:NaCl和Na2CO3。
【设计实验】 请设计实验对“你的猜想”进行验证:
实验步骤
实验现象
实验结论
取少量过滤后的溶液于试管中,向其中滴入盐酸
有气泡产生
猜想正确
【解析】 探究一:【提出猜想】由标签可知,溶质为钙的化合物,能与碳酸钠反应说明可能是氢氧化钙或氯化钙。【设计实验】由于氢氧化钙溶液显碱性,氯化钙溶液呈中性,所以加入酚酞试液溶液不变色证明猜想①成立。探究二:【提出猜想】由于碳酸钠与氯化钙反应生成了碳酸钙沉淀和氯化钠,由于反应物的取用量不同,过滤后澄清滤液中的溶质可能是NaCl和Na2CO3或NaCl或NaCl和CaCl2。【设计实验】碳酸钠与盐酸反应生成二氧化碳气体,可以证明碳酸钠的存在。
11.(2017·山东菏泽)实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图甲所示),科学小组的同学经过询问老师后只知道是NaCl、NaOH、Na2CO3、NaHCO3溶液中的一种,为确认原瓶中是何种溶质并判断其是否变质,科学小组的同学进行了如下的探究活动:
(第11题甲)
【进行猜想】 猜想Ⅰ:原溶液的溶质是NaCl。
猜想Ⅱ:原溶液的溶质是NaOH。
猜想Ⅲ:原溶液的溶质是Na2CO3。
猜想Ⅳ:原溶液的溶质是NaHCO3。
【查阅资料】 常温下,有关物质的相关信息如下表:
物质
NaCl
NaOH
Na2CO3
NaHCO3
常温下的溶解度/g
36
109
21.5
9.6
常温下稀溶液的pH
7
13
11
9
从物质的相关信息可知,原溶液的溶质一定不是NaHCO3,因为碳酸氢钠饱和溶液的溶质质量分数在该温度下不能达到10%。
【进行实验】
(1)取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是NaCl。
(2)同学们另取样品又进行了如图乙所示实验,实验过程如下:
(第11题乙)
①写出生成白色沉淀A的反应的化学方程式:Na2CO3+CaCl2===CaCO3↓+2NaCl。
②通过实验可以判断样品无色溶液中含有的溶质有NaOH、Na2CO3。
【获得结论】 实验完成后,最终得到的结论:原瓶中的溶质是NaOH,且已变质。
【解析】 【查阅资料】根据计算可以知道在20 ℃时饱和碳酸氢钠的质量分数为×100%≈8.8%<10%,所以能够排除碳酸氢钠。【进行实验】(1)测定溶液的pH大于7,而氯化钠溶液呈中性,所以不可能是氯化钠。(2)①过量氯化钙溶液可以检验并除尽碳酸钠,碳酸钠可以和氯化钙反应生成碳酸钙沉淀和氯化钠。②滴加无色酚酞试液,滤液变红,说明溶液呈碱性,还有氢氧化钠,可以判断原无色溶液中含有的溶质有NaOH、Na2CO3。【获得结论】该瓶原来装的无色溶液的溶质是NaOH,并且部分变质。
12.(2018·山东威海)某纯碱厂生产的某批次碳酸钠产品中可能含有氯化钠杂质。
【定性检验】 (1)要确定该产品中是否含有杂质氯化钠,你的方法是取少量样品于试管中,加入足量稀硝酸,再加入硝酸银溶液,若观察到产生白色沉淀,则证明样品中含有氯化钠。
【定量测定】 (2)若利用沉淀法测定该产品中碳酸钠的质量分数,你确定的反应原理是Na2CO3+BaCl2===BaCO3↓+2NaCl(或NaCO3+CaCl2===CaCO3↓+2NaCl)(用化学方程式表示)。
(3)根据你确定的反应原理,你需要通过实验测量沉淀BaCO3(或CaCO3)(填化学式)的质量。
(4)假设你取样的质量为m1、测得的沉淀的质量为m2,请你设计实验方案获取数据m1、m2,把方案填在下表中。
适用的仪器名称
实验步骤
烧杯、玻璃棒、胶头滴管、铁架台(带铁圈)、漏斗、托盘天平、洗瓶、干燥仪器
①称量样品的质量;②溶解;③加试剂(需指明试剂过量或足量);④过滤;⑤洗涤、干燥;⑥称量沉淀的质量
【数据处理】 (5)请用含m1、m2的式子表示所测样品中碳酸钠的质量分数:×100%(或×100%)。
【分析讨论】 (6)要测定混合物中某成分的含量,可通过化学方法将不易测定的物质转化为易测量的物质。除沉淀法外,还可依据反应Na2CO3+2HCl===2NaCl+H2O+CO2↑(用化学方程式表示)来测定该纯碱样品中碳酸钠的质量分数。导学号:16786010
【解析】 (1)要检验碳酸钠中是否含有氯化钠就需要先排除碳酸钠的影响,可取样品于试管中,加入足量的稀硝酸,使碳酸钠反应完全,再加入硝酸银溶液,观察是否产生白色沉淀。(2)若利用沉淀法测定该产品中碳酸钠的质量分数,可以向待测溶液中加入过量的氯化钡溶液(或氯化钙溶液),碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠(或碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠)。(3)根据生成碳酸钡沉淀或碳酸钙沉淀的质量来计算出碳酸钠的质量。(4)需要称取一定质量的样品并将其溶解,然后加入足量的氯化钡溶液或氯化钙溶液,实验结束后将沉淀过滤出来,洗涤干燥称量。(5)若是利用过量的氯化钡溶液来测定的话,设碳酸钠的质量为x,则:
Na2CO3+BaCl2===BaCO3↓+2NaCl
106 197
x m2
= x=
则所测样品中碳酸钠的质量分数为×100%=×100%。
若是利用过量的氯化钙溶液来测定的话,设碳酸钠的质量为y,则:
Na2CO3+CaCl2===CaCO3↓+2NaCl
106 100
y m2
= y=
则所测样品中碳酸钠的质量分数为×100%=×100%。
(6)利用氯化钠与盐酸不反应,碳酸钠能与稀盐酸反应生成氯化钠、水和二氧化碳,将反应生成的气体干燥后用足量的氢氧化钠溶液来吸收,根据氢氧化钠溶液增重的质量(即生成二氧化碳的质量),通过化学方程式计算出碳酸钠的质量,并进一步计算出该纯碱样品中碳酸钠的质量分数。
13.(2017·浙江金华)小苏打(NaHCO3)和食盐(NaCl)是厨房中常用的物质。现有一包白色固体,可能由NaHCO3和NaCl中的一种或两种组成。某科学小组的同学展开了一系列拓展性探究。
(1)定性分析:
【实验目的】 确定白色固体的组成。
【实验方案】
(第13题甲)
【实验结论】 该白色固体由NaHCO3和NaCl两种物质组成。
①基于上述实验结论,步骤①中加入的过量稀酸应该是稀硝酸。
②写出步骤②中生成白色沉淀的化学反应方程式:CO2+Ca(OH)2===CaCO3↓+H2O。
(2)定量分析:
【实验目的】 测定该白色固体中NaHCO3的质量分数。
为了测定该样品中NaHCO3的质量分数,小吕、小周分别取a克该样品,设计了如下方案:
小吕方案:利用NaHCO3与稀硫酸反应产生CO2,通过测定生成CO2的质量,计算样品中NaHCO3的质量分数。
①小吕用如图乙所示的装置完成本实验,装置的连接顺序是ADBEC(或ADBCE)(填字母,装置不重复使用)。
(第13题乙)
②装置D中的反应完全后,需再次通入空气,其目的是把生成的二氧化碳全部排入装置E(或C)中,使之充分被吸收。
小周方案:小周用沉淀法测定样品中NaHCO3的质量分数,操作流程如图丙所示。
(已知:NaHCO3+NaOH===Na2CO3+H2O)
(第13题丙)
③为使定量分析更准确,在操作Ⅰ之前,需判断所加BaCl2溶液是否过量,请你设计一个合理方案:待浊液澄清后,继续滴加BaCl2溶液,若无沉淀产生则说明BaCl2已过量。导学号:16786011
【解析】 (1)①由图甲可知,加入的酸不影响后续Cl-的检验,可知是稀硝酸。②CO2使澄清石灰水变浑浊的化学反应方程式为CO2+Ca(OH)2===CaCO3↓+H2O。(2)①A瓶可以除去空气中的CO2,要置于反应装置D前,B瓶浓硫酸用于除去气体中的水蒸气,因此置于反应装置D后,C、E用于吸收CO2和尾气处理,因此装置的连接顺序可以是ADBEC或ADBCE。②需再次通入空气,其目的是把生成的二氧化碳全部排入装置E或C中,使之充分被吸收。③判断所加BaCl2溶液是否过量,可以待浊液澄清后,继续滴加BaCl2溶液,若无沉淀产生则说明BaCl2已过量。
