鲁科版高中化学选修6 主题4课题1 实验室制备日用化学品(43张ppt)
文档属性
| 名称 | 鲁科版高中化学选修6 主题4课题1 实验室制备日用化学品(43张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 379.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-05 20:44:20 | ||
图片预览









文档简介
课件43张PPT。课题1 实验室制备日用化学品 课堂互动讲练课前自主学案探究整合应用课题
1
实验室制备日用化学品知能优化训练学习目标学习目标
1.了解肥皂的制备原理及实验操作。
2.熟悉纯碱的制备方案和实验实施过程。
3.了解肥皂、纯碱等去污原理。一、肥皂的制备
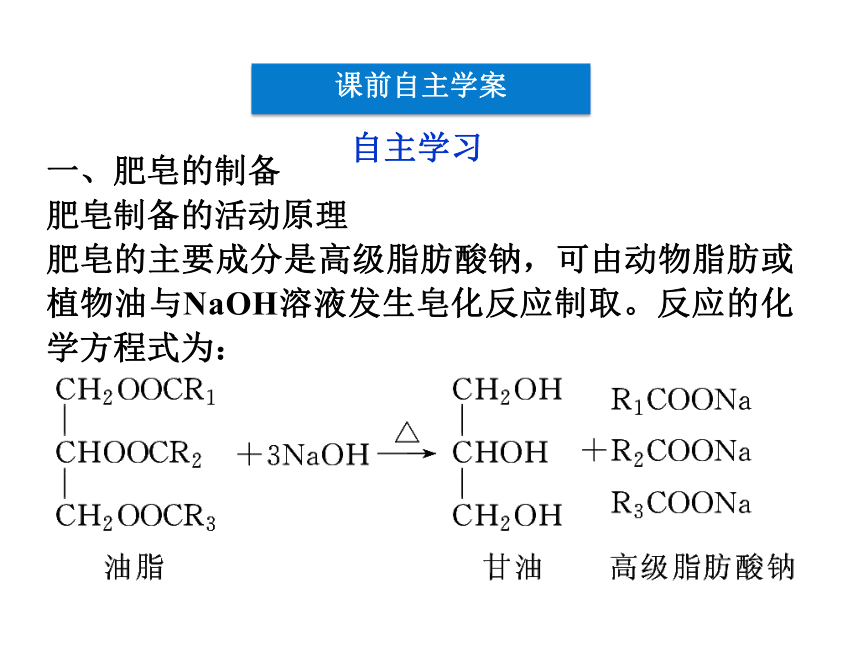
肥皂制备的活动原理
肥皂的主要成分是高级脂肪酸钠,可由动物脂肪或植物油与NaOH溶液发生皂化反应制取。反应的化学方程式为:课前自主学案自主学习反应完成后,生成的_______________、_______和水形成了混合物。为了将高级脂肪酸钠从混合物中分离出来,需要向其中加入饱和____________________以降低高级脂肪酸钠的溶解度,使其从混合物中析出,浮到液面上。这个过程叫做_______。
最后,将分离出的高级脂肪酸钠与_________ (如松香、硅酸钠等)混合,再_______、 _______,便可制得肥皂成品。高级脂肪酸钠甘油食盐水(或食盐细粒)盐析填充剂成型干燥思考感悟
1.简述肥皂去污原理。
【提示】 在洗涤过程中,污垢中的油脂与肥皂接触后,高级脂肪酸根离子的烃基插入油污内,而易溶于水的羧基部分伸在油污外面插入水中,这样油污就被包围起来,再经摩擦、振动,大的油污便分散成小油珠,最后脱离纤维织品分散到水中形成乳浊液,从而达到洗涤的目的。二、纯碱的制备
1.纯碱的制备活动原理
(1)碳酸钠俗称______、 ______,是一种常用的日用化学品。碳酸钠易溶于水,水溶液呈碱性。在日常生活中常用它去掉做面食时发酵产生的酸味,也可用它洗涤餐具及沾有油污的衣物等。此外,碳酸钠还是重要的化工原料,用于玻璃、造纸、纺织、石油精炼等工业生产。
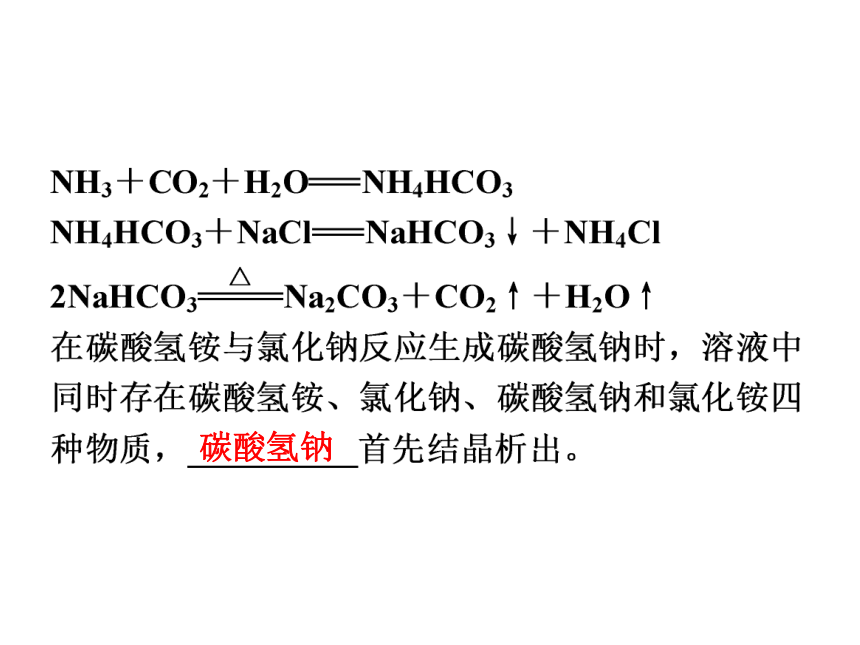
(2)工业上将二氧化碳和氨气通入饱和食盐水中制得___________,再煅烧___________使其转化为碳酸钠。反应的化学方程式为:纯碱苏打碳酸氢钠碳酸氢钠碳酸氢钠2.制备步骤
(1)配制含氨的饱和食盐水
在100 mL的锥形瓶中加入20 mL______ (体积比为1∶1),再加入8 g ______,塞紧橡胶塞,振荡几分钟,过滤除去不溶物,得到含氨的饱和食盐水。
(2)制备碳酸氢钠
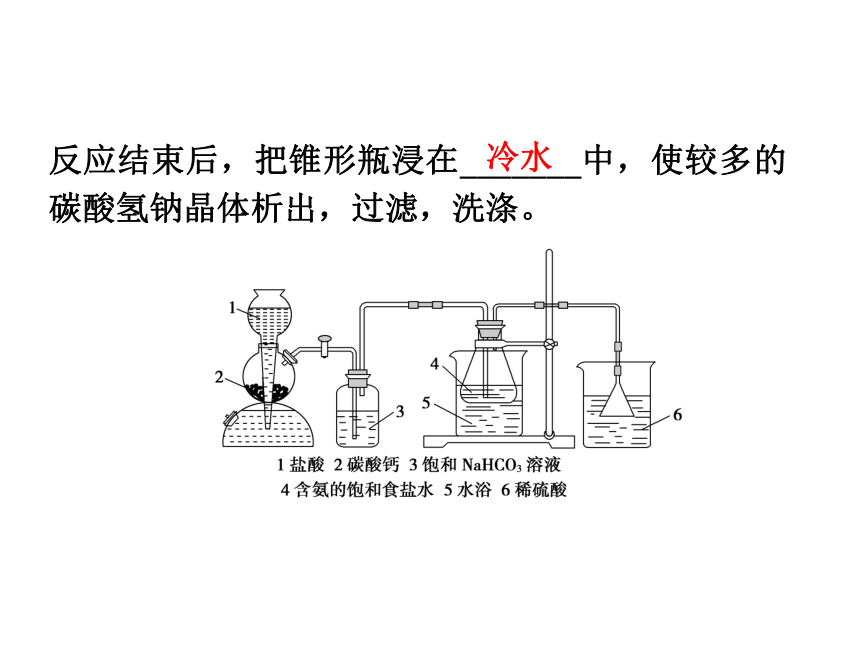
按下图组装实验装置,先检查装置的________,再向各仪器中加入相应试剂,打开启普发生器的活塞,开始制备碳酸氢钠。实验过程中,要注意控制水浴温度(30~35 ℃)和二氧化碳的通入速度(以出现能数得清的连续气泡为宜)。氨水食盐气密性反应结束后,把锥形瓶浸在_______中,使较多的碳酸氢钠晶体析出,过滤,洗涤。冷水(3)制备碳酸钠
将制得的碳酸氢钠转移至________中,加热至没有水蒸气逸出为止。
(4)称量产品质量。蒸发皿思考感悟
2.纯碱去污(油脂)的反应原理如何?自主体验1.利用厨房用过的废食用油,加入强碱共煮后可制得下列物质中的( )
A.蜡烛 B.机油
C.肥皂 D.面霜
解析:选C。油脂的碱性水解反应叫做皂化反应,可以用于制造肥皂。2.关于肥皂与合成洗涤剂的比较,下列说法正确的是(双选)( )
A.肥皂可以在硬水中使用,而合成洗涤剂不行
B.合成洗涤剂去污能力比肥皂强,适合洗衣机使用
C.制造合成洗涤剂的原料便宜
D.制造肥皂的原料便宜解析:选BC。肥皂的有效成分为硬脂酸钠,而C17H35COO-能与硬水中的Ca2+、Mg2+结合形成沉淀,而使C17H35COO-失去除污能力,降低了洗涤效果;合成洗涤剂为十二烷基苯磺酸钠,其中所含的表面活性剂拥有更强的亲水和亲油基团,去污能力更强;合成洗涤剂的原料主要是石油化工的副产品,比较便宜,而肥皂的原料为油脂,成本相对高一些。3.在制小苏打(NaCl+CO2+NH3+H2O===NaHCO3↓+NH4Cl)的操作中,应在饱和食盐水中( )
A.先通入CO2,达到饱和后再通入NH3
B.先通入NH3,达到饱和后再通入CO2
C.CO2和NH3同时通入
D.以上三种方法都行
解析:选B。CO2在NaCl溶液中溶解度小,先通NH3后溶液呈碱性,能溶解大量的CO2,生成大量的HCO,从而析出大量的NaHCO3晶体。课堂互动讲练1.在制备肥皂的实验中为什么要加入乙醇?
答:在制备肥皂时加入乙醇,是因为酒精既能溶解碱,又能溶解油脂,是油脂和NaOH的共同溶剂,能使反应物融为均一的液体,使皂化反应在均匀的系统中进行并且速率加快。2.在制备肥皂的实验步骤1中,加入NaOH溶液的作用是什么?
答:油脂在适量碱溶液中水解即生成高级脂肪酸钠(肥皂)和甘油。加入NaOH溶液的作用,就是使油脂在碱性条件下水解,以制取肥皂。3.在制备肥皂的实验步骤1中,加入饱和NaCl溶液的作用是什么?
答:加入饱和NaCl溶液的作用,使高级脂肪酸钠(肥皂)发生凝聚而从混合液中析出,并浮在表面,而皂化反应的另一副产物甘油、未作用的碱和酒精能在NaCl溶液中溶解,得到质地较好的肥皂。4.如何检验皂化是否完全?
答:可以用玻璃棒蘸取几滴样品放在试管中,加入4~5 mL水,将试管浸在热水中或在火焰上加热,并不断振荡。若混合物完全溶解,无油滴出现,表示皂化完全,否则说明皂化不完全。5.如何鉴别矿物油和植物油?
答:(1)在两支试管中分别取两种液体少许,然后向这两支试管中分别滴加少许溴水,能使溴水退色的是植物油;不能使溴水退色,且分层的是矿物油。
(2)在两支试管中分别取两种液体少许,然后加入NaOH溶液,共热,如逐渐溶解且不分层的是植物油;如仍分为两层的是矿物油。 可以判断油脂皂化反应基本完成的现象是( )
A.反应液使红色石蕊试纸变蓝色
B.反应液使蓝色石蕊试纸变红色
C.反应后静置,反应液分为两层
D.反应后静置,反应液不分层【解析】 由于油脂在发生皂化反应时,向油脂中加入了NaOH溶液,反应液始终呈碱性,所以A不能说明油脂是否水解完全;B是错误的;反应完全后,生成物为高级脂肪酸钠、甘油、水的混合物,三者互溶为一体,不分层,故D正确。
【答案】 D【误区警示】 油脂是不溶于水的,反应前油脂和NaOH溶液是分层的,反应完成后,生成的高级脂肪酸钠、甘油和水形成了混合物。加入食盐盐析后,才分层。变式训练1 (2011年泰安高二检测)油脂完全皂化后得到甘油和高级脂肪酸钠的混合溶液,若要使高级脂肪酸钠和甘油分离,可以采用的方法是( )
A.渗析 B.分液
C.蒸馏 D.盐析
解析:选D。向混合溶液中加入食盐粒,搅拌、静置,高级脂肪酸钠就会从混合物中以固体形式析出,浮在液面。1.在实验室中,你将如何获得二氧化碳?请确定所需要的试剂和仪器。
答:获得二氧化碳:利用化学反应:CaCO3+2HCl===CaCl2+CO2↑+H2O。所需试剂为:大理石、稀盐酸;所需仪器为启普发生器或其简易装置。2.在制得的二氧化碳中可能含有哪些杂质?应该怎样除去?
答:制得的二氧化碳中混有氯化氢气体;使气体通过水或饱和NaHCO3溶液,除去氯化氢。
3.在实验过程中是否需要对尾气进行吸收?如需要,请你选择合适的试剂并设计尾气吸收装置。
答:需要对尾气进行吸收,因为逸出的氨气具有刺激性气味。用稀硫酸吸收尾气,为防止氨气因溶解而倒吸,吸收装置需使用倒扣的漏斗。4.在加热碳酸氢钠制备碳酸钠时,你将如何判断分解反应是否进行完全?
答:将加热碳酸氢钠装置中的出气导管置于石灰水中,导管口不再产生气泡,则证明分解反应进行完全。5.在制备碳酸氢钠时,有的同学提供了下列三种实验方案,你认为哪种方案最好?说明理由。
方案1:分别将二氧化碳和氨气通入饱和食盐水中;
方案2:将二氧化碳通入含氨的NaCl饱和溶液中;
方案3:将氨气通入含二氧化碳的NaCl饱和溶液中。6.如何分离出碳酸氢钠母液中含有的氯化铵和食盐?
答:可以向其中再加些食盐,然后升温蒸发水,再降温,利用氯化铵的溶解度随温度变化较大的特性,同时并用结晶和盐析两种方法,达到析出氯化铵而氯化钠留在溶液中的目的,使两者分离。 某课外兴趣小组同学,按照“侯氏制碱法”原理,设计了如下一套实验装置:实验室可供选用的药品有:浓氨水、纯碱、大理石、稀盐酸、稀硫酸、熟石灰、氯化铵、氯化钠。
(1)A、D中最合适的试剂(填名称)为:A____________;D__________。
(2)本实验具体操作过程中,应先通________气体,再通________气体,原因是___________________。
(3)指出该装置中的错误(至少两处)
________________________________________。(4)在改进装置后,该同学进行了实验,实验所用的饱和NaCl溶液中含溶质58.5 g,实验最后得到无水碳酸钠26.0 g,则其产率为________;该同学针对其实验结果,认真分析了造成损失的原因,发现其操作步骤并没有错误,则主要原因是_______________________________。
(5)在“侯氏制碱法”工业生产中,原料的利用率高,大大降低了成本。请问本实验中哪些物质可重复利用?______________。
【思路点拨】 解答本题应注意以下两点:
①侯氏制碱法的反应原理;
②装置的连接和实验基本操作。
【解析】 本题借助侯氏制碱法,考查化学实验的一些基础知识与基本技能:药品的选用、操作过程分析、实验装置评价等。
由于CO2在水中溶解度小,所以实验中先制得NH3(左边装置)通入饱和食盐水,右侧再制得CO2通入被氨和食盐饱和的水溶液中,可得碳酸氢钠晶体,析出的碳酸氢钠晶体加热分解可得到纯碱。【答案】 (1)氯化铵和熟石灰 稀盐酸
(2)NH3 CO2 CO2在水中溶解度小,先通NH3至饱和,有利于NaHCO3析出
(3)B、C之间缺少止水夹;B装置应与大气相通,不能为密闭装置;通NH3的导管不应伸入液面以下(任填两种即可)
(4)49.0% NaHCO3在水中有较大的溶解度,未能全部沉淀出来
(5)CO2、NaCl变式训练2 阅读下列短文:我国化工专家侯德榜先生发明的“侯氏制碱法”的基本原理是:在浓氨水中通入足量的二氧化碳生成一种盐,然后在此盐溶液中加入细的食盐粉末,由于碳酸氢钠在该状态下溶解度很小,呈晶体析出。同时由于大部分酸式碳酸盐不稳定,加热后容易转变为正盐、水和二氧化碳,所以将析出的碳酸氢钠加热分解即可制得纯碱。
根据以上叙述,简要地回答下列问题。(1)用上述方法进行时,所用的起始原料是哪些物质?它们的化学式分别是_________________。
(2)最终产品是哪些物质?它们的化学式分别是__________________________。
(3)有人认为侯氏制碱法的优点有四:①生产过程中部分产品可作为起始原料使用;②副产品是一种可利用的氮肥;③反应不需要加热,可以节约能源;④副产品不会造成环境污染。你认为其中正确的是________。解析:此题中主要给出三个信息:(1)第二个反应产物是碳酸氢钠;(2)在此状态下碳酸氢钠溶解度很小,可以以晶体形式析出;(3)碳酸氢钠加热时不稳定,易分解。该题的解题难点:一是二氧化碳既是原料又是产品;二是根据第二个反应产物是碳酸氢钠,推断第一个反应的产物是碳酸氢铵;三是碳酸氢铵与食盐可以发生复分解反应。如何利用信息处理问题?难点①答题时只要前后联想则不易造成失误;难点②掌握复分解反应的概念,其实质是互换成分,依信息则可推出反应物之一是碳酸氢铵;难点③学生一般认为钠盐易溶于水,难将碳酸氢钠可以以晶体形式析出联系在一起。
答案:(1)NH3、H2O、CO2、NaCl
(2)Na2CO3、NH4Cl
(3)①②④化学实验的“绿色化”
1.绿色化学的含义:绿色化学又称环境友好化学或清洁化学,是从源头上防止污染产生或把化学过程对环境的负面影响降低到最低程度的化学。
2.绿色化学的要求:①原料和产品无害;②在化学过程中不产生“三废”或使“三废”降低到最低程度。探究整合应用3.化学实验绿色化的五条途径
(1)开发绿色实验。如实验室用H2O2分解制O2代替KClO3分解法,实现了原料和反应过程的绿色化。
(2)防止实验过程中尾气、废物等对环境的污染,实验中有危害性气体产生时要加强尾气吸收,对实验产物尽可能再利用等。
(3)在保证实验效果的前提下,尽量减少实验试剂的用量,使实验小型化、微型化。(4)对于危险或反应条件苛刻,污染严重或仪器、试剂价格昂贵的实验,可采用计算机模拟化学实验或观看实验录像等办法。
(5)妥善处置实验产生的废物,防止污染环境。
4.原子经济性:最理想的“原子经济”是指反应物的原子全部转化到期望的最终目标产物中,达到原子利用率为100%。
5.符合“绿色化学”要求的化学反应:化合反应、加成反应、加聚反应。
1
实验室制备日用化学品知能优化训练学习目标学习目标
1.了解肥皂的制备原理及实验操作。
2.熟悉纯碱的制备方案和实验实施过程。
3.了解肥皂、纯碱等去污原理。一、肥皂的制备
肥皂制备的活动原理
肥皂的主要成分是高级脂肪酸钠,可由动物脂肪或植物油与NaOH溶液发生皂化反应制取。反应的化学方程式为:课前自主学案自主学习反应完成后,生成的_______________、_______和水形成了混合物。为了将高级脂肪酸钠从混合物中分离出来,需要向其中加入饱和____________________以降低高级脂肪酸钠的溶解度,使其从混合物中析出,浮到液面上。这个过程叫做_______。
最后,将分离出的高级脂肪酸钠与_________ (如松香、硅酸钠等)混合,再_______、 _______,便可制得肥皂成品。高级脂肪酸钠甘油食盐水(或食盐细粒)盐析填充剂成型干燥思考感悟
1.简述肥皂去污原理。
【提示】 在洗涤过程中,污垢中的油脂与肥皂接触后,高级脂肪酸根离子的烃基插入油污内,而易溶于水的羧基部分伸在油污外面插入水中,这样油污就被包围起来,再经摩擦、振动,大的油污便分散成小油珠,最后脱离纤维织品分散到水中形成乳浊液,从而达到洗涤的目的。二、纯碱的制备
1.纯碱的制备活动原理
(1)碳酸钠俗称______、 ______,是一种常用的日用化学品。碳酸钠易溶于水,水溶液呈碱性。在日常生活中常用它去掉做面食时发酵产生的酸味,也可用它洗涤餐具及沾有油污的衣物等。此外,碳酸钠还是重要的化工原料,用于玻璃、造纸、纺织、石油精炼等工业生产。
(2)工业上将二氧化碳和氨气通入饱和食盐水中制得___________,再煅烧___________使其转化为碳酸钠。反应的化学方程式为:纯碱苏打碳酸氢钠碳酸氢钠碳酸氢钠2.制备步骤
(1)配制含氨的饱和食盐水
在100 mL的锥形瓶中加入20 mL______ (体积比为1∶1),再加入8 g ______,塞紧橡胶塞,振荡几分钟,过滤除去不溶物,得到含氨的饱和食盐水。
(2)制备碳酸氢钠
按下图组装实验装置,先检查装置的________,再向各仪器中加入相应试剂,打开启普发生器的活塞,开始制备碳酸氢钠。实验过程中,要注意控制水浴温度(30~35 ℃)和二氧化碳的通入速度(以出现能数得清的连续气泡为宜)。氨水食盐气密性反应结束后,把锥形瓶浸在_______中,使较多的碳酸氢钠晶体析出,过滤,洗涤。冷水(3)制备碳酸钠
将制得的碳酸氢钠转移至________中,加热至没有水蒸气逸出为止。
(4)称量产品质量。蒸发皿思考感悟
2.纯碱去污(油脂)的反应原理如何?自主体验1.利用厨房用过的废食用油,加入强碱共煮后可制得下列物质中的( )
A.蜡烛 B.机油
C.肥皂 D.面霜
解析:选C。油脂的碱性水解反应叫做皂化反应,可以用于制造肥皂。2.关于肥皂与合成洗涤剂的比较,下列说法正确的是(双选)( )
A.肥皂可以在硬水中使用,而合成洗涤剂不行
B.合成洗涤剂去污能力比肥皂强,适合洗衣机使用
C.制造合成洗涤剂的原料便宜
D.制造肥皂的原料便宜解析:选BC。肥皂的有效成分为硬脂酸钠,而C17H35COO-能与硬水中的Ca2+、Mg2+结合形成沉淀,而使C17H35COO-失去除污能力,降低了洗涤效果;合成洗涤剂为十二烷基苯磺酸钠,其中所含的表面活性剂拥有更强的亲水和亲油基团,去污能力更强;合成洗涤剂的原料主要是石油化工的副产品,比较便宜,而肥皂的原料为油脂,成本相对高一些。3.在制小苏打(NaCl+CO2+NH3+H2O===NaHCO3↓+NH4Cl)的操作中,应在饱和食盐水中( )
A.先通入CO2,达到饱和后再通入NH3
B.先通入NH3,达到饱和后再通入CO2
C.CO2和NH3同时通入
D.以上三种方法都行
解析:选B。CO2在NaCl溶液中溶解度小,先通NH3后溶液呈碱性,能溶解大量的CO2,生成大量的HCO,从而析出大量的NaHCO3晶体。课堂互动讲练1.在制备肥皂的实验中为什么要加入乙醇?
答:在制备肥皂时加入乙醇,是因为酒精既能溶解碱,又能溶解油脂,是油脂和NaOH的共同溶剂,能使反应物融为均一的液体,使皂化反应在均匀的系统中进行并且速率加快。2.在制备肥皂的实验步骤1中,加入NaOH溶液的作用是什么?
答:油脂在适量碱溶液中水解即生成高级脂肪酸钠(肥皂)和甘油。加入NaOH溶液的作用,就是使油脂在碱性条件下水解,以制取肥皂。3.在制备肥皂的实验步骤1中,加入饱和NaCl溶液的作用是什么?
答:加入饱和NaCl溶液的作用,使高级脂肪酸钠(肥皂)发生凝聚而从混合液中析出,并浮在表面,而皂化反应的另一副产物甘油、未作用的碱和酒精能在NaCl溶液中溶解,得到质地较好的肥皂。4.如何检验皂化是否完全?
答:可以用玻璃棒蘸取几滴样品放在试管中,加入4~5 mL水,将试管浸在热水中或在火焰上加热,并不断振荡。若混合物完全溶解,无油滴出现,表示皂化完全,否则说明皂化不完全。5.如何鉴别矿物油和植物油?
答:(1)在两支试管中分别取两种液体少许,然后向这两支试管中分别滴加少许溴水,能使溴水退色的是植物油;不能使溴水退色,且分层的是矿物油。
(2)在两支试管中分别取两种液体少许,然后加入NaOH溶液,共热,如逐渐溶解且不分层的是植物油;如仍分为两层的是矿物油。 可以判断油脂皂化反应基本完成的现象是( )
A.反应液使红色石蕊试纸变蓝色
B.反应液使蓝色石蕊试纸变红色
C.反应后静置,反应液分为两层
D.反应后静置,反应液不分层【解析】 由于油脂在发生皂化反应时,向油脂中加入了NaOH溶液,反应液始终呈碱性,所以A不能说明油脂是否水解完全;B是错误的;反应完全后,生成物为高级脂肪酸钠、甘油、水的混合物,三者互溶为一体,不分层,故D正确。
【答案】 D【误区警示】 油脂是不溶于水的,反应前油脂和NaOH溶液是分层的,反应完成后,生成的高级脂肪酸钠、甘油和水形成了混合物。加入食盐盐析后,才分层。变式训练1 (2011年泰安高二检测)油脂完全皂化后得到甘油和高级脂肪酸钠的混合溶液,若要使高级脂肪酸钠和甘油分离,可以采用的方法是( )
A.渗析 B.分液
C.蒸馏 D.盐析
解析:选D。向混合溶液中加入食盐粒,搅拌、静置,高级脂肪酸钠就会从混合物中以固体形式析出,浮在液面。1.在实验室中,你将如何获得二氧化碳?请确定所需要的试剂和仪器。
答:获得二氧化碳:利用化学反应:CaCO3+2HCl===CaCl2+CO2↑+H2O。所需试剂为:大理石、稀盐酸;所需仪器为启普发生器或其简易装置。2.在制得的二氧化碳中可能含有哪些杂质?应该怎样除去?
答:制得的二氧化碳中混有氯化氢气体;使气体通过水或饱和NaHCO3溶液,除去氯化氢。
3.在实验过程中是否需要对尾气进行吸收?如需要,请你选择合适的试剂并设计尾气吸收装置。
答:需要对尾气进行吸收,因为逸出的氨气具有刺激性气味。用稀硫酸吸收尾气,为防止氨气因溶解而倒吸,吸收装置需使用倒扣的漏斗。4.在加热碳酸氢钠制备碳酸钠时,你将如何判断分解反应是否进行完全?
答:将加热碳酸氢钠装置中的出气导管置于石灰水中,导管口不再产生气泡,则证明分解反应进行完全。5.在制备碳酸氢钠时,有的同学提供了下列三种实验方案,你认为哪种方案最好?说明理由。
方案1:分别将二氧化碳和氨气通入饱和食盐水中;
方案2:将二氧化碳通入含氨的NaCl饱和溶液中;
方案3:将氨气通入含二氧化碳的NaCl饱和溶液中。6.如何分离出碳酸氢钠母液中含有的氯化铵和食盐?
答:可以向其中再加些食盐,然后升温蒸发水,再降温,利用氯化铵的溶解度随温度变化较大的特性,同时并用结晶和盐析两种方法,达到析出氯化铵而氯化钠留在溶液中的目的,使两者分离。 某课外兴趣小组同学,按照“侯氏制碱法”原理,设计了如下一套实验装置:实验室可供选用的药品有:浓氨水、纯碱、大理石、稀盐酸、稀硫酸、熟石灰、氯化铵、氯化钠。
(1)A、D中最合适的试剂(填名称)为:A____________;D__________。
(2)本实验具体操作过程中,应先通________气体,再通________气体,原因是___________________。
(3)指出该装置中的错误(至少两处)
________________________________________。(4)在改进装置后,该同学进行了实验,实验所用的饱和NaCl溶液中含溶质58.5 g,实验最后得到无水碳酸钠26.0 g,则其产率为________;该同学针对其实验结果,认真分析了造成损失的原因,发现其操作步骤并没有错误,则主要原因是_______________________________。
(5)在“侯氏制碱法”工业生产中,原料的利用率高,大大降低了成本。请问本实验中哪些物质可重复利用?______________。
【思路点拨】 解答本题应注意以下两点:
①侯氏制碱法的反应原理;
②装置的连接和实验基本操作。
【解析】 本题借助侯氏制碱法,考查化学实验的一些基础知识与基本技能:药品的选用、操作过程分析、实验装置评价等。
由于CO2在水中溶解度小,所以实验中先制得NH3(左边装置)通入饱和食盐水,右侧再制得CO2通入被氨和食盐饱和的水溶液中,可得碳酸氢钠晶体,析出的碳酸氢钠晶体加热分解可得到纯碱。【答案】 (1)氯化铵和熟石灰 稀盐酸
(2)NH3 CO2 CO2在水中溶解度小,先通NH3至饱和,有利于NaHCO3析出
(3)B、C之间缺少止水夹;B装置应与大气相通,不能为密闭装置;通NH3的导管不应伸入液面以下(任填两种即可)
(4)49.0% NaHCO3在水中有较大的溶解度,未能全部沉淀出来
(5)CO2、NaCl变式训练2 阅读下列短文:我国化工专家侯德榜先生发明的“侯氏制碱法”的基本原理是:在浓氨水中通入足量的二氧化碳生成一种盐,然后在此盐溶液中加入细的食盐粉末,由于碳酸氢钠在该状态下溶解度很小,呈晶体析出。同时由于大部分酸式碳酸盐不稳定,加热后容易转变为正盐、水和二氧化碳,所以将析出的碳酸氢钠加热分解即可制得纯碱。
根据以上叙述,简要地回答下列问题。(1)用上述方法进行时,所用的起始原料是哪些物质?它们的化学式分别是_________________。
(2)最终产品是哪些物质?它们的化学式分别是__________________________。
(3)有人认为侯氏制碱法的优点有四:①生产过程中部分产品可作为起始原料使用;②副产品是一种可利用的氮肥;③反应不需要加热,可以节约能源;④副产品不会造成环境污染。你认为其中正确的是________。解析:此题中主要给出三个信息:(1)第二个反应产物是碳酸氢钠;(2)在此状态下碳酸氢钠溶解度很小,可以以晶体形式析出;(3)碳酸氢钠加热时不稳定,易分解。该题的解题难点:一是二氧化碳既是原料又是产品;二是根据第二个反应产物是碳酸氢钠,推断第一个反应的产物是碳酸氢铵;三是碳酸氢铵与食盐可以发生复分解反应。如何利用信息处理问题?难点①答题时只要前后联想则不易造成失误;难点②掌握复分解反应的概念,其实质是互换成分,依信息则可推出反应物之一是碳酸氢铵;难点③学生一般认为钠盐易溶于水,难将碳酸氢钠可以以晶体形式析出联系在一起。
答案:(1)NH3、H2O、CO2、NaCl
(2)Na2CO3、NH4Cl
(3)①②④化学实验的“绿色化”
1.绿色化学的含义:绿色化学又称环境友好化学或清洁化学,是从源头上防止污染产生或把化学过程对环境的负面影响降低到最低程度的化学。
2.绿色化学的要求:①原料和产品无害;②在化学过程中不产生“三废”或使“三废”降低到最低程度。探究整合应用3.化学实验绿色化的五条途径
(1)开发绿色实验。如实验室用H2O2分解制O2代替KClO3分解法,实现了原料和反应过程的绿色化。
(2)防止实验过程中尾气、废物等对环境的污染,实验中有危害性气体产生时要加强尾气吸收,对实验产物尽可能再利用等。
(3)在保证实验效果的前提下,尽量减少实验试剂的用量,使实验小型化、微型化。(4)对于危险或反应条件苛刻,污染严重或仪器、试剂价格昂贵的实验,可采用计算机模拟化学实验或观看实验录像等办法。
(5)妥善处置实验产生的废物,防止污染环境。
4.原子经济性:最理想的“原子经济”是指反应物的原子全部转化到期望的最终目标产物中,达到原子利用率为100%。
5.符合“绿色化学”要求的化学反应:化合反应、加成反应、加聚反应。
