2.5 物质的转化 同步练习
图片预览


文档简介
第5节 物质的转化
一、填空题
1.硫磺在空气里燃烧,发出_______ 色火焰,放出大量的 ______,生成______色 ______气味的______;在氧气中燃烧,发出______色火焰,化学方程式为_______________________。
2.向滴有紫色石蕊试液的水中通入二氧化碳气体,看到溶液颜色的变化为:_________;说明原因__________________(用化学方程式表示);然后把液体放入试管中用酒精灯加热,又看到的现象:__________________;说明理由__________________(用化学方程式表示)。
3.完成下列物质间转化的化学方程式。
Ca CaO Ca(OH)2 CaCO3 CaO
①______________________________________________________;
②_______________________________________________________;
③_______________________________________________________;
④ ______________________________________________________。
二、选择题
4.下列有关铁及其化合物的转化关系中,不能一步实现的是( )
A.Fe→Fe3O4 B.Fe2O3→FeCl3
C.Fe(OH)3→Fe2(SO4)3 D.Fe(NO3)3→FeCl3
5.进行如图实验,加热一段时间后,可观察到有红色物质出现,说明氢气具有( )
A.还原性 B.可燃性 C.氧化性 D.助燃性
6.有理论认为,从疾病发生机制上考虑,氧化损伤几乎是所有疾病最基本的病理过程。研究人员发现,氢气对一些疾病有治疗作用。根据上述理论.氢气对一些疾病有治疗作用的原因可能是( )
A.氢气有还原性 B.氢气是密度最小的气体
C.常温下氢气较稳定 D.氢气对人体无毒
7.青铜是铜锡合金。我国古代金属锡的冶炼发生的反应主要是:SnO2+2CSn+2CO↑。下列分析正确的是( )
A.青铜属于纯净物 B.反应类型属于复分解反应
C.二氧化锡是氧化物 D.CO在反应中是还原剂
8.某科学兴趣小组要在实验室制取一定量的MgSO4。同学们分别在实验室里找到了以下四种反应物,其中不能通过与稀硫酸反应制得MgSO4的是( )
A.Mg B.MgO C.Mg(OH)2 D.MgCl2
9.如下两个转化都可以通过一步反应实现:CO→CO2、H2SO4→MgSO4。对上述转化过程分析正确的是( )
A.都能通过与非金属单质反应实现 B.都能通过与金属氧化物反应实现
C.都能通过化合反应实现 D.都能通过置换反应实现
10.我们可以利用物质与物质间的反应制造出新的物质。下列物质间的转化,不能一步实现的是( )
A.CuCl2→Cu B.Ba(OH)2→NaOH C.H2SO4→HCl D.NaNO3→NaCl
11.为除去下列物质中的杂质(括号内是杂质),下列操作方法正确的是( )
选项
物质
操作方法
A
Fe(Fe2O3)
加入过量稀盐酸,充分反应后过滤
B
CaO粉末(CaCO3粉末)
加入足量的水,充分搅拌后过滤
C
NaOH溶液Ca(OH)2溶液
通入过量CO2气体,充分反应后过滤
D
CuSO4溶液(硫酸)
加入过量CuO粉末,加热,充分反应后过滤
12.海洋是一个巨大的资源宝库,海水中有大量可以利用的化学资源,例如氯化镁、氯化钠、溴化钠等。下图为综合利用海水制备金属镁的流程。
该流程中没有涉及的化学反应是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
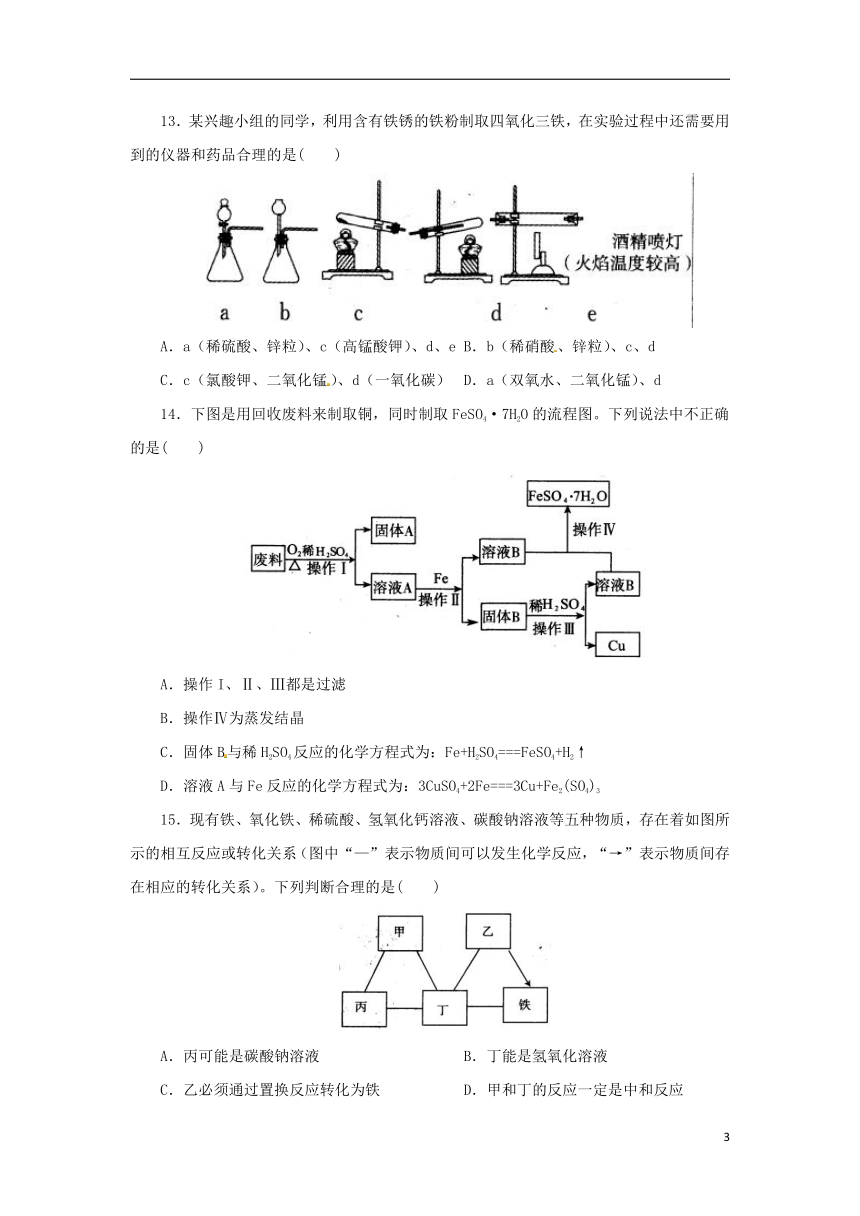
13.某兴趣小组的同学,利用含有铁锈的铁粉制取四氧化三铁,在实验过程中还需要用到的仪器和药品合理的是( )
A.a(稀硫酸、锌粒)、c(高锰酸钾)、d、e B.b(稀硝酸、锌粒)、c、d
C.c(氯酸钾、二氧化锰)、d(一氧化碳) D.a(双氧水、二氧化锰)、d
14.下图是用回收废料来制取铜,同时制取FeSO4·7H2O的流程图。下列说法中不正确的是( )
A.操作I、Ⅱ、Ⅲ都是过滤
B.操作Ⅳ为蒸发结晶
C.固体B与稀H2SO4反应的化学方程式为:Fe+H2SO4===FeSO4+H2↑
D.溶液A与Fe反应的化学方程式为:3CuSO4+2Fe===3Cu+Fe2(SO4)3
15.现有铁、氧化铁、稀硫酸、氢氧化钙溶液、碳酸钠溶液等五种物质,存在着如图所示的相互反应或转化关系(图中“—”表示物质间可以发生化学反应,“→”表示物质间存在相应的转化关系)。下列判断合理的是( )
A.丙可能是碳酸钠溶液 B.丁能是氢氧化溶液
C.乙必须通过置换反应转化为铁 D.甲和丁的反应一定是中和反应
三、综合题
16.金属冶炼是把金属化合物。转变成金属单质,如炼铜的方法有:
(1)湿法炼铜:Fe+CuSO4===Cu+FeSO4,这是利用铁的活动性比铜__________________。
(2)干法炼铜:CO+CuO Cu+CO2,这是利用CO的__________________性。
17.铁粉和硫粉以适当的质量比例混合,堆放在石棉网上,然后用烧红的玻璃棒一端接触混合物,这时部分混合物迅速变红热状态,撤离玻璃棒后,反应继续进行,直至全部混合物都呈红热的状态,冷却后得到一种黑色无磁性的固态物质。
(1)该黑色无磁性的固态物质在物质分类上属于________(填“酸”“碱”“盐”或“氧化物”)。
(2)铁与硫的反应是_________(填“吸热”“放热”或“既不吸热也不放热的”)反应。
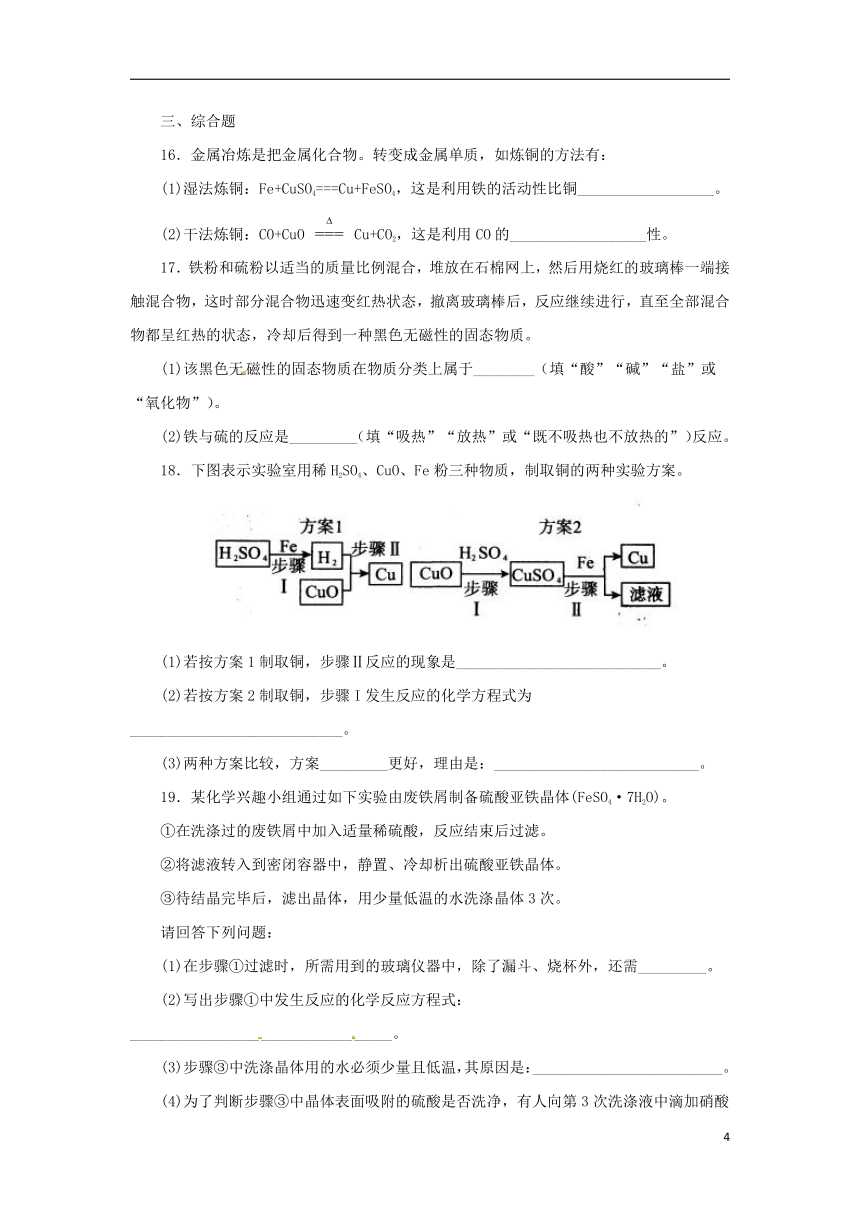
18.下图表示实验室用稀H2SO4、CuO、Fe粉三种物质,制取铜的两种实验方案。
(1)若按方案1制取铜,步骤Ⅱ反应的现象是___________________________。
(2)若按方案2制取铜,步骤I发生反应的化学方程式为____________________________。
(3)两种方案比较,方案_________更好,理由是:___________________________。
19.某化学兴趣小组通过如下实验由废铁屑制备硫酸亚铁晶体(FeSO4·7H2O)。
①在洗涤过的废铁屑中加入适量稀硫酸,反应结束后过滤。
②将滤液转入到密闭容器中,静置、冷却析出硫酸亚铁晶体。
③待结晶完毕后,滤出晶体,用少量低温的水洗涤晶体3次。
请回答下列问题:
(1)在步骤①过滤时,所需用到的玻璃仪器中,除了漏斗、烧杯外,还需_________。
(2)写出步骤①中发生反应的化学反应方程式:__________________________________。
(3)步骤③中洗涤晶体用的水必须少量且低温,其原因是:_________________________。
(4)为了判断步骤③中晶体表面吸附的硫酸是否洗净,有人向第3次洗涤液中滴加硝酸钡溶液和稀硝酸,得到白色沉淀,由此证明该晶体并未洗净。该结论是否可靠?为什么?
_____________________________________________。
参考答案
1.微弱的淡蓝 热 无 有刺激性 气体 蓝紫 S+O2SO2
2.由紫色变成红色 CO2+H2O===H2CO3 由红色变成紫色 H2CO3H2O+CO2↑
3.①2Ca+O22CaO
②CaO+H2O===Ca(OH)2
③Ca(OH)2+CO2===CaCO3↓+H2O
④CaCO3CaO+CO2↑
4.D
5.A 解析:加热一段时间后,可观察到黑色氧化铜变成红色的物质,说明氢气与氧化铜发生反应,生成铜单质,氢气得到氧是还原剂,具有还原性。
6.A解析:题中出现了“氧化损伤”一词,且氢气可以对一些疾病起治疗作用,因此不难得出,利用的是氢气的还原性。
7.C解析:青铜是铜锡合金,属于混合物;该反应的反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物,属于置换反应;二氧化锡由锡和氧两种元素组成的化合物,属于氧化物;一氧化碳是生成物,还原剂是指反应物中的物质;碳发生了氧化反应,在反应中作还原剂。
8.D解析:镁可与硫酸反应生成硫酸镁和氢气;氧化镁可与硫酸反应生成硫酸镁和水;氢氧化镁和硫酸反应生成硫酸镁和水;氯化镁与硫酸不反应,生成物中无气体、沉淀和水,故不能通过与稀硫酸反应制得MgSO4,符合题意。
9.B 解析:CO→CO2的转化,可以通过CO与氧气化合反应实现;也可以通过CO与氧化铜等金属氧化物的反应实现;而H2SO4→MgSO4的转化不能通过与非金属单质的反应,而要通过H2SO4与金属镁的置换反应,或与氧化镁、碳酸镁、氢氧化镁的复分解反应制得。故只有B正确。
10.D 解析:CuCl2→Cu,加入比铜活泼的金属,如锌、铁等都可以实现;Ba(OH)2→NaOH可加入Na2SO4实现;H2SO4→HCl可加入BaCl2实现;故A、B、D三项均可一步实现;D中,NaNO3一般不与其他物质发生化学反应,无法生成NaCl。
11.D 解析:除杂质的原则是:加入的试剂只与杂质反应,反应后不能引入新的杂质。A中Fe2O3和Fe均能与稀盐酸反应,故A错误。B中CaCO3粉末不溶于水,CaO能与水反应生成氢氧化钙,故B错误。C中Ca(OH)2溶液和NaOH溶液均能与CO2反应,故C错误。
12.C 解析:从图中看出,贝壳煅烧是碳酸钙的分解反应;氯化镁通电也是发生分解反应;CaO和水反应属于化合反应;MgCl2与石灰乳以及Mg(OH)2与盐酸的反应属于复分解反应。整个过程中没有置换反应。
13.A 解析:稀硫酸和锌反应可生成氢气,该反应可以在a装置中进行实验,而还原铁的实验可以在e装置中进行,而c装置可以用来制取氧气,然后将得到的铁粉放入d装置,通入氧气加热即得到四氧化三铁,A正确;稀硝酸和锌反应不生成氢气,B错误;缺少还原铁粉的装置,故C错误;缺少制取还原剂的物质,D错误。
14.D 解析:经分析知,溶液A为硫酸铜溶液,溶液A与Fe反应的化学方程式为:CuSO4+Fe===Cu+FeSO4,D错误。
15.A 解析:根据下列图示解答
铁
氧化铁
硫酸
氢氧化钙
碳酸钠
铁
——
不会反应
会反应
不会反应
不会反应
氧化铁
不会反应
——
会反应
不会反应
不会反应
硫酸
会反应
会反应
——
会反应
会反应
氢氧化钙
不会反应
不会反应
会反应
——
会反应
碳酸钠
不会反应
不会反应
会反应
会反应
——
A.根据上表可以看出,碳酸钠和氢氧化钙都会和两种物质反应,所以甲和丙要从碳酸钠和氢氧化钙中选,丙可能是碳酸钠溶液,故A正确。B.根据上表可以看出,会与四种物质发生反应的只有硫酸,可知丁一定是硫酸,故B错。C.只有氧化铁会转化成铁,但是不一定都是置换反应,比如一氧化碳还原氧化铁就不是置换反应,故C错。D.中和反应必须是酸和碱反应生成盐和水,丁是硫酸,属于酸,但是甲可能是氢氧化钙,也可能是碳酸钠,所以不一定是中和反应,故D错。
16.(1)强(活泼、大等均可) (2)还原
解析:掌握金属活动性顺序、一氧化碳的化学性质是正确解答本题的关键。(1)在金属活动性顺序中,位置在前面的金属能把位于后面的金属从其盐溶液中置换出来,根据题意,铁能把铜从其盐溶液中置换出来,是利用铁的活动性比铜强。(2)一氧化碳具有还原性,可用于冶炼金属,干法炼铜中:CO+CuOCu+CO2,一氧化碳夺取了氧,是利用CO的还原性。
17.(1)盐 (2)放热
18.(1)黑色固体变为红色,且有水珠出现 (2) CuO+H2SO4===CuSO4 +H2O (3)2 安全、节能、炼铜率高
解析:方案1主要反应是氢气还原氧化铜,需要加热,且生成的氢气不易储存、容易爆炸,不安全、不节能;方案2主要反应是铁置换硫酸铜中的铜,在常温下进行,安全且操作方便,故方案2更好。
19.(1)玻璃棒 (2) Fe+H2SO4===FeSO4+H2↑
(3)因为晶体易溶于水,温度越低,溶解度越小,用水越少,晶体损失越少
(4)不可靠;无论是否洗干净,洗涤液中一定含有SO42-
解析:(1)考查过滤的基本实验仪器。缺少玻璃棒,起引流作用。(2)步骤①中化学反应为铁和硫酸反应,方程式为:Fe+H2SO4===FeSO4+H2↑。(3)因为晶体易溶于水,温度越低,溶解度越小,用水越少,晶体损失越少。(4)不可靠;不论是否洗干净,洗涤液中一定含有SO42-,应该检验H+,而不是SO42-。
一、填空题
1.硫磺在空气里燃烧,发出_______ 色火焰,放出大量的 ______,生成______色 ______气味的______;在氧气中燃烧,发出______色火焰,化学方程式为_______________________。
2.向滴有紫色石蕊试液的水中通入二氧化碳气体,看到溶液颜色的变化为:_________;说明原因__________________(用化学方程式表示);然后把液体放入试管中用酒精灯加热,又看到的现象:__________________;说明理由__________________(用化学方程式表示)。
3.完成下列物质间转化的化学方程式。
Ca CaO Ca(OH)2 CaCO3 CaO
①______________________________________________________;
②_______________________________________________________;
③_______________________________________________________;
④ ______________________________________________________。
二、选择题
4.下列有关铁及其化合物的转化关系中,不能一步实现的是( )
A.Fe→Fe3O4 B.Fe2O3→FeCl3
C.Fe(OH)3→Fe2(SO4)3 D.Fe(NO3)3→FeCl3
5.进行如图实验,加热一段时间后,可观察到有红色物质出现,说明氢气具有( )
A.还原性 B.可燃性 C.氧化性 D.助燃性
6.有理论认为,从疾病发生机制上考虑,氧化损伤几乎是所有疾病最基本的病理过程。研究人员发现,氢气对一些疾病有治疗作用。根据上述理论.氢气对一些疾病有治疗作用的原因可能是( )
A.氢气有还原性 B.氢气是密度最小的气体
C.常温下氢气较稳定 D.氢气对人体无毒
7.青铜是铜锡合金。我国古代金属锡的冶炼发生的反应主要是:SnO2+2CSn+2CO↑。下列分析正确的是( )
A.青铜属于纯净物 B.反应类型属于复分解反应
C.二氧化锡是氧化物 D.CO在反应中是还原剂
8.某科学兴趣小组要在实验室制取一定量的MgSO4。同学们分别在实验室里找到了以下四种反应物,其中不能通过与稀硫酸反应制得MgSO4的是( )
A.Mg B.MgO C.Mg(OH)2 D.MgCl2
9.如下两个转化都可以通过一步反应实现:CO→CO2、H2SO4→MgSO4。对上述转化过程分析正确的是( )
A.都能通过与非金属单质反应实现 B.都能通过与金属氧化物反应实现
C.都能通过化合反应实现 D.都能通过置换反应实现
10.我们可以利用物质与物质间的反应制造出新的物质。下列物质间的转化,不能一步实现的是( )
A.CuCl2→Cu B.Ba(OH)2→NaOH C.H2SO4→HCl D.NaNO3→NaCl
11.为除去下列物质中的杂质(括号内是杂质),下列操作方法正确的是( )
选项
物质
操作方法
A
Fe(Fe2O3)
加入过量稀盐酸,充分反应后过滤
B
CaO粉末(CaCO3粉末)
加入足量的水,充分搅拌后过滤
C
NaOH溶液Ca(OH)2溶液
通入过量CO2气体,充分反应后过滤
D
CuSO4溶液(硫酸)
加入过量CuO粉末,加热,充分反应后过滤
12.海洋是一个巨大的资源宝库,海水中有大量可以利用的化学资源,例如氯化镁、氯化钠、溴化钠等。下图为综合利用海水制备金属镁的流程。
该流程中没有涉及的化学反应是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
13.某兴趣小组的同学,利用含有铁锈的铁粉制取四氧化三铁,在实验过程中还需要用到的仪器和药品合理的是( )
A.a(稀硫酸、锌粒)、c(高锰酸钾)、d、e B.b(稀硝酸、锌粒)、c、d
C.c(氯酸钾、二氧化锰)、d(一氧化碳) D.a(双氧水、二氧化锰)、d
14.下图是用回收废料来制取铜,同时制取FeSO4·7H2O的流程图。下列说法中不正确的是( )
A.操作I、Ⅱ、Ⅲ都是过滤
B.操作Ⅳ为蒸发结晶
C.固体B与稀H2SO4反应的化学方程式为:Fe+H2SO4===FeSO4+H2↑
D.溶液A与Fe反应的化学方程式为:3CuSO4+2Fe===3Cu+Fe2(SO4)3
15.现有铁、氧化铁、稀硫酸、氢氧化钙溶液、碳酸钠溶液等五种物质,存在着如图所示的相互反应或转化关系(图中“—”表示物质间可以发生化学反应,“→”表示物质间存在相应的转化关系)。下列判断合理的是( )
A.丙可能是碳酸钠溶液 B.丁能是氢氧化溶液
C.乙必须通过置换反应转化为铁 D.甲和丁的反应一定是中和反应
三、综合题
16.金属冶炼是把金属化合物。转变成金属单质,如炼铜的方法有:
(1)湿法炼铜:Fe+CuSO4===Cu+FeSO4,这是利用铁的活动性比铜__________________。
(2)干法炼铜:CO+CuO Cu+CO2,这是利用CO的__________________性。
17.铁粉和硫粉以适当的质量比例混合,堆放在石棉网上,然后用烧红的玻璃棒一端接触混合物,这时部分混合物迅速变红热状态,撤离玻璃棒后,反应继续进行,直至全部混合物都呈红热的状态,冷却后得到一种黑色无磁性的固态物质。
(1)该黑色无磁性的固态物质在物质分类上属于________(填“酸”“碱”“盐”或“氧化物”)。
(2)铁与硫的反应是_________(填“吸热”“放热”或“既不吸热也不放热的”)反应。
18.下图表示实验室用稀H2SO4、CuO、Fe粉三种物质,制取铜的两种实验方案。
(1)若按方案1制取铜,步骤Ⅱ反应的现象是___________________________。
(2)若按方案2制取铜,步骤I发生反应的化学方程式为____________________________。
(3)两种方案比较,方案_________更好,理由是:___________________________。
19.某化学兴趣小组通过如下实验由废铁屑制备硫酸亚铁晶体(FeSO4·7H2O)。
①在洗涤过的废铁屑中加入适量稀硫酸,反应结束后过滤。
②将滤液转入到密闭容器中,静置、冷却析出硫酸亚铁晶体。
③待结晶完毕后,滤出晶体,用少量低温的水洗涤晶体3次。
请回答下列问题:
(1)在步骤①过滤时,所需用到的玻璃仪器中,除了漏斗、烧杯外,还需_________。
(2)写出步骤①中发生反应的化学反应方程式:__________________________________。
(3)步骤③中洗涤晶体用的水必须少量且低温,其原因是:_________________________。
(4)为了判断步骤③中晶体表面吸附的硫酸是否洗净,有人向第3次洗涤液中滴加硝酸钡溶液和稀硝酸,得到白色沉淀,由此证明该晶体并未洗净。该结论是否可靠?为什么?
_____________________________________________。
参考答案
1.微弱的淡蓝 热 无 有刺激性 气体 蓝紫 S+O2SO2
2.由紫色变成红色 CO2+H2O===H2CO3 由红色变成紫色 H2CO3H2O+CO2↑
3.①2Ca+O22CaO
②CaO+H2O===Ca(OH)2
③Ca(OH)2+CO2===CaCO3↓+H2O
④CaCO3CaO+CO2↑
4.D
5.A 解析:加热一段时间后,可观察到黑色氧化铜变成红色的物质,说明氢气与氧化铜发生反应,生成铜单质,氢气得到氧是还原剂,具有还原性。
6.A解析:题中出现了“氧化损伤”一词,且氢气可以对一些疾病起治疗作用,因此不难得出,利用的是氢气的还原性。
7.C解析:青铜是铜锡合金,属于混合物;该反应的反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物,属于置换反应;二氧化锡由锡和氧两种元素组成的化合物,属于氧化物;一氧化碳是生成物,还原剂是指反应物中的物质;碳发生了氧化反应,在反应中作还原剂。
8.D解析:镁可与硫酸反应生成硫酸镁和氢气;氧化镁可与硫酸反应生成硫酸镁和水;氢氧化镁和硫酸反应生成硫酸镁和水;氯化镁与硫酸不反应,生成物中无气体、沉淀和水,故不能通过与稀硫酸反应制得MgSO4,符合题意。
9.B 解析:CO→CO2的转化,可以通过CO与氧气化合反应实现;也可以通过CO与氧化铜等金属氧化物的反应实现;而H2SO4→MgSO4的转化不能通过与非金属单质的反应,而要通过H2SO4与金属镁的置换反应,或与氧化镁、碳酸镁、氢氧化镁的复分解反应制得。故只有B正确。
10.D 解析:CuCl2→Cu,加入比铜活泼的金属,如锌、铁等都可以实现;Ba(OH)2→NaOH可加入Na2SO4实现;H2SO4→HCl可加入BaCl2实现;故A、B、D三项均可一步实现;D中,NaNO3一般不与其他物质发生化学反应,无法生成NaCl。
11.D 解析:除杂质的原则是:加入的试剂只与杂质反应,反应后不能引入新的杂质。A中Fe2O3和Fe均能与稀盐酸反应,故A错误。B中CaCO3粉末不溶于水,CaO能与水反应生成氢氧化钙,故B错误。C中Ca(OH)2溶液和NaOH溶液均能与CO2反应,故C错误。
12.C 解析:从图中看出,贝壳煅烧是碳酸钙的分解反应;氯化镁通电也是发生分解反应;CaO和水反应属于化合反应;MgCl2与石灰乳以及Mg(OH)2与盐酸的反应属于复分解反应。整个过程中没有置换反应。
13.A 解析:稀硫酸和锌反应可生成氢气,该反应可以在a装置中进行实验,而还原铁的实验可以在e装置中进行,而c装置可以用来制取氧气,然后将得到的铁粉放入d装置,通入氧气加热即得到四氧化三铁,A正确;稀硝酸和锌反应不生成氢气,B错误;缺少还原铁粉的装置,故C错误;缺少制取还原剂的物质,D错误。
14.D 解析:经分析知,溶液A为硫酸铜溶液,溶液A与Fe反应的化学方程式为:CuSO4+Fe===Cu+FeSO4,D错误。
15.A 解析:根据下列图示解答
铁
氧化铁
硫酸
氢氧化钙
碳酸钠
铁
——
不会反应
会反应
不会反应
不会反应
氧化铁
不会反应
——
会反应
不会反应
不会反应
硫酸
会反应
会反应
——
会反应
会反应
氢氧化钙
不会反应
不会反应
会反应
——
会反应
碳酸钠
不会反应
不会反应
会反应
会反应
——
A.根据上表可以看出,碳酸钠和氢氧化钙都会和两种物质反应,所以甲和丙要从碳酸钠和氢氧化钙中选,丙可能是碳酸钠溶液,故A正确。B.根据上表可以看出,会与四种物质发生反应的只有硫酸,可知丁一定是硫酸,故B错。C.只有氧化铁会转化成铁,但是不一定都是置换反应,比如一氧化碳还原氧化铁就不是置换反应,故C错。D.中和反应必须是酸和碱反应生成盐和水,丁是硫酸,属于酸,但是甲可能是氢氧化钙,也可能是碳酸钠,所以不一定是中和反应,故D错。
16.(1)强(活泼、大等均可) (2)还原
解析:掌握金属活动性顺序、一氧化碳的化学性质是正确解答本题的关键。(1)在金属活动性顺序中,位置在前面的金属能把位于后面的金属从其盐溶液中置换出来,根据题意,铁能把铜从其盐溶液中置换出来,是利用铁的活动性比铜强。(2)一氧化碳具有还原性,可用于冶炼金属,干法炼铜中:CO+CuOCu+CO2,一氧化碳夺取了氧,是利用CO的还原性。
17.(1)盐 (2)放热
18.(1)黑色固体变为红色,且有水珠出现 (2) CuO+H2SO4===CuSO4 +H2O (3)2 安全、节能、炼铜率高
解析:方案1主要反应是氢气还原氧化铜,需要加热,且生成的氢气不易储存、容易爆炸,不安全、不节能;方案2主要反应是铁置换硫酸铜中的铜,在常温下进行,安全且操作方便,故方案2更好。
19.(1)玻璃棒 (2) Fe+H2SO4===FeSO4+H2↑
(3)因为晶体易溶于水,温度越低,溶解度越小,用水越少,晶体损失越少
(4)不可靠;无论是否洗干净,洗涤液中一定含有SO42-
解析:(1)考查过滤的基本实验仪器。缺少玻璃棒,起引流作用。(2)步骤①中化学反应为铁和硫酸反应,方程式为:Fe+H2SO4===FeSO4+H2↑。(3)因为晶体易溶于水,温度越低,溶解度越小,用水越少,晶体损失越少。(4)不可靠;不论是否洗干净,洗涤液中一定含有SO42-,应该检验H+,而不是SO42-。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
