浙江省中考科学(化学部分)第二篇主题1第三单元空气(3)(课件 41张ppt)
文档属性
| 名称 | 浙江省中考科学(化学部分)第二篇主题1第三单元空气(3)(课件 41张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-03-10 11:25:40 | ||
图片预览








文档简介
第三单元 空气(3)
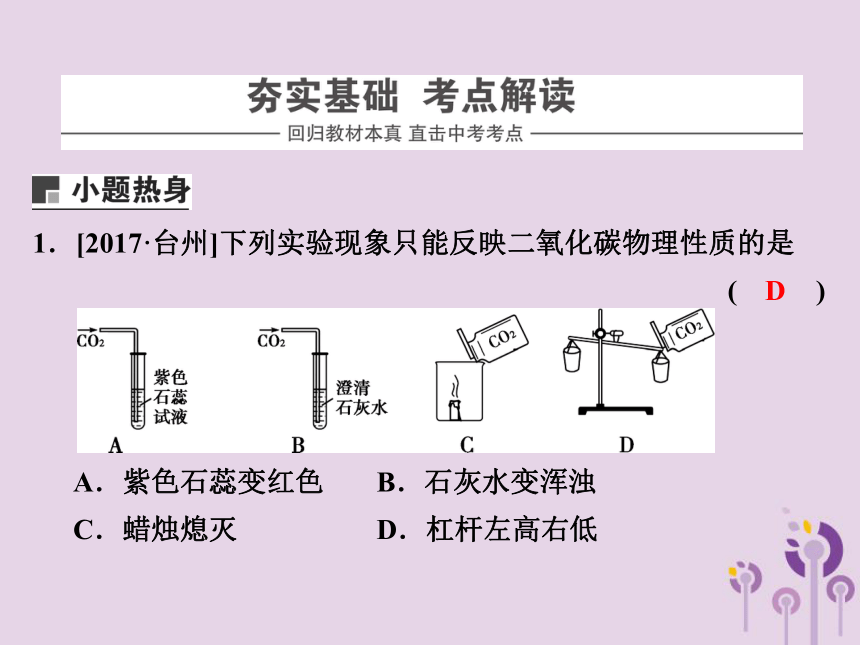
1.[2017·台州]下列实验现象只能反映二氧化碳物理性质的是 ( )
A.紫色石蕊变红色 B.石灰水变浑浊
C.蜡烛熄灭 D.杠杆左高右低
D
2.[2018·临沂模拟]进入久未开启的菜窖之前,人们如何利用较简便的方法检验菜窖中CO2含量是否会对进入菜窖的人的生命构成威胁 ( )
A.让一个身强力壮的男子进去试验一下
B.做“灯火实验”观察
C.放一杯澄清石灰水进去观察
D.放一只小白兔进去观察
B
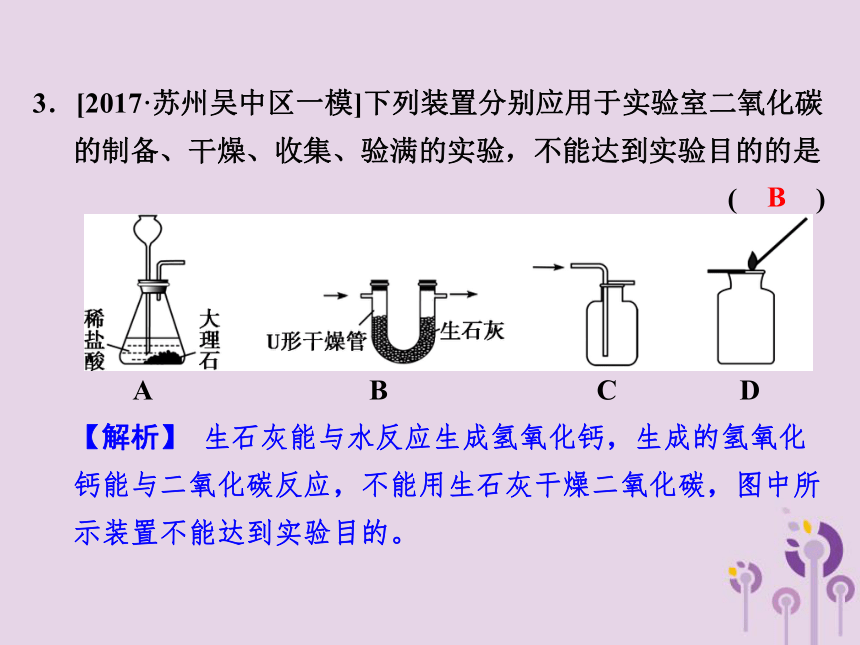
3.[2017·苏州吴中区一模]下列装置分别应用于实验室二氧化碳的制备、干燥、收集、验满的实验,不能达到实验目的的是 ( )
A B C D
【解析】 生石灰能与水反应生成氢氧化钙,生成的氢氧化钙能与二氧化碳反应,不能用生石灰干燥二氧化碳,图中所示装置不能达到实验目的。
B
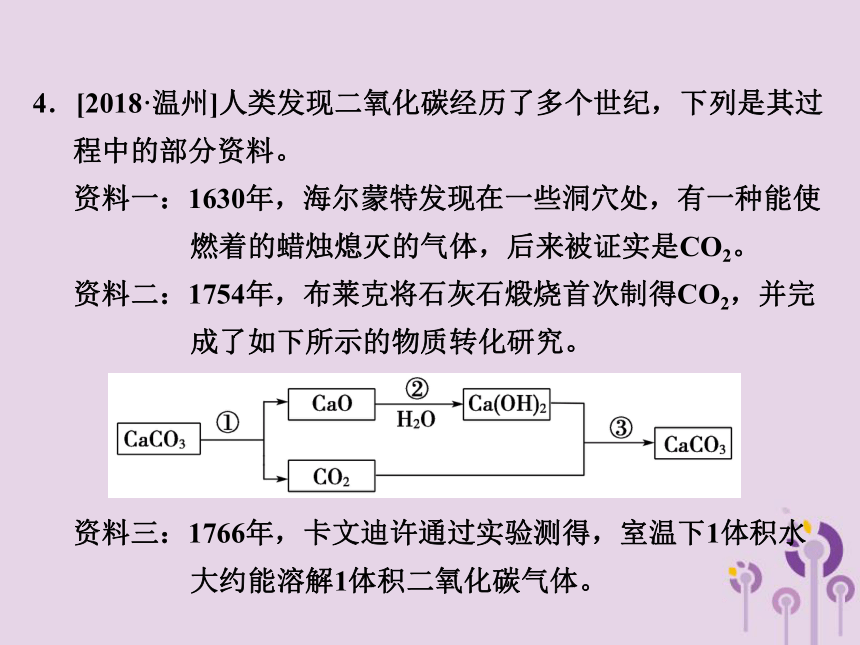
4.[2018·温州]人类发现二氧化碳经历了多个世纪,下列是其过程中的部分资料。
资料一:1630年,海尔蒙特发现在一些洞穴处,有一种能使 燃着的蜡烛熄灭的气体,后来被证实是CO2。
资料二:1754年,布莱克将石灰石煅烧首次制得CO2,并完 成了如下所示的物质转化研究。
资料三:1766年,卡文迪许通过实验测得,室温下1体积水 大约能溶解1体积二氧化碳气体。
(1)根据海尔蒙特的发现,可推测二氧化碳的化学性质:______ ___________________。
(2)写出布莱克实验中反应③的化学方程式:_________________ __________________。
(3)如图,在室温下将容积为200mL的广口瓶
注满蒸馏水,通过导管缓慢通入300mL CO2。
如果卡文迪许的结论是正确的,则在量筒中
收集到的水约为_______mL。
既不
燃烧也不支持燃烧
Ca(OH)2+CO2
===CaCO3↓+H2O
100
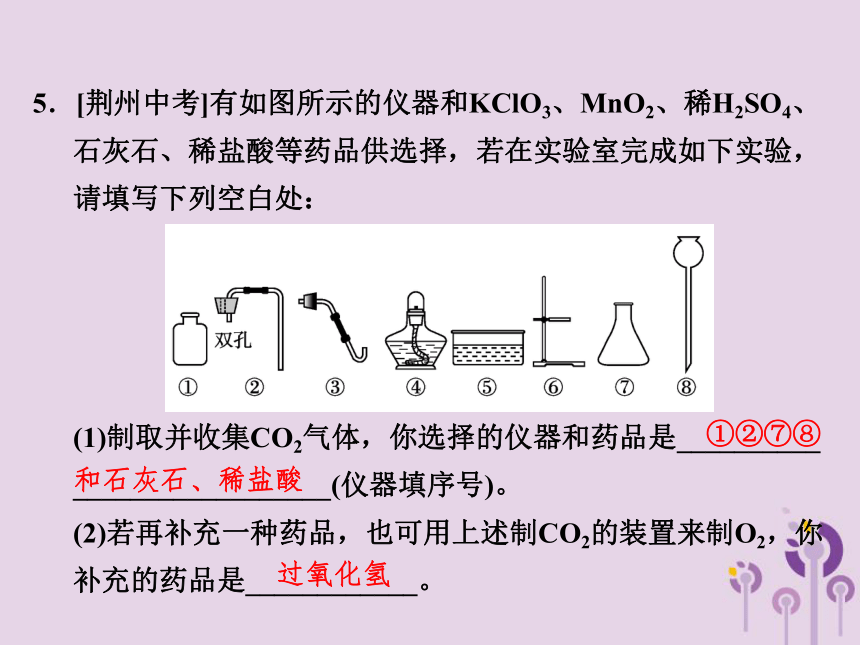
5.[荆州中考]有如图所示的仪器和KClO3、MnO2、稀H2SO4、石灰石、稀盐酸等药品供选择,若在实验室完成如下实验,请填写下列空白处:
(1)制取并收集CO2气体,你选择的仪器和药品是__________ __________________(仪器填序号)。
(2)若再补充一种药品,也可用上述制CO2的装置来制O2,你补充的药品是____________。
①②⑦⑧
和石灰石、稀盐酸
过氧化氢
(3)若再补充一种仪器,并选择上述原有的仪器和药品制取并收集O2,你认为需要补充的仪器是________,你选择的药品是_________________。
试管
KClO3、MnO2
二氧化碳
考点1 说出二氧化碳的主要物理性质(a)
1.在通常状态下,二氧化碳是一种_____________的气体。
2.密度为1.977g/L,相同条件下,二氧化碳的密度比空气的大,约是空气密度的1.5倍,因此能像__________那样从一个容器向另一个容器倾倒。
3.能溶于水,通常1体积水中能溶解1体积的二氧化碳。
4.在加压降温的情况下,二氧化碳能转变为无色液体,甚至变成雪状固体——干冰。
无色、无味
倒液体
考点2 说明二氧化碳的主要化学性质(b)
1.________________________________________。
既不能燃烧也不支持燃烧,不能供给呼吸
碳酸
3.能与NaOH、KOH、Ca(OH)2 等可溶性碱发生反应。
二氧化碳能使澄清石灰水变浑浊:CO2+Ca(OH)2=== CaCO3↓+H2O,此反应可用来______________二氧化碳。但在吸收二氧化碳时又不用石灰水,因为氢氧化钙在水中的溶解度很小,无法将二氧化碳完全吸收,要吸收二氧化碳一般用浓碱溶液,如氢氧化钠浓溶液。
鉴定和检验
【考点延伸】
考点3 说出二氧化碳的主要用途(a)
1.二氧化碳的用途:①可作__________;②可作化工原料,用来制作纯碱、尿素和汽水;③“干冰”作__________,用来保存食品和人工降雨;④用作____________。
灭火剂
致冷剂
气体肥料
2.二氧化碳对生活和环境的影响
(1)二氧化碳对人体健康的影响:CO2本身____________,但当空气中的CO2超过正常含量时,会对人体产生有害的影响。
进入久未开启的菜窖或干涸的深井之前,必须做灯火实验。
(2)二氧化碳对环境的影响:温室效应。
没有毒性
空气中二氧化碳的体积分数(%) 对人体的影响
1 感到气闷、头晕、心悸
4~5 感到气喘、头痛、眩晕
10以上 使人神志不清、呼吸停止,以致死亡
考点4 说出实验室制备、收集二氧化碳的原理、装置及主要步
骤(a)
二氧化碳的实验室制法
(1)药品:大理石(或石灰石)与__________。
一般不用其他药品代替的原因:①不用Na2CO3代替大理石,是因为Na2CO3与盐酸反应速率太快,不便于控制;②不用浓盐酸,是因为浓盐酸易挥发出HCl气体,使CO2不纯;③不用H2SO4代替盐酸,是因为H2SO4与CaCO3反应生成________的__________会覆盖在大理石的表面,阻止反应的继续进行。
(2)原理:CaCO3+2HCl===CaCl2+H2O+CO2 ↑。
稀盐酸
微溶
CaSO4
(3)制取装置如图所示:
(4)收集:CO2密度比空气______、能溶于水且与水反应生成碳酸,一般只用________________收集CO2气体。收集气体时,导气管应伸到集气瓶底部以排尽集气瓶中的空气,使收集到的气体纯度较高。
(5)操作步骤:①按要求连接好仪器;②检查装置的气密性;③向反应器中装入大理石;④向长颈漏斗中注入稀盐酸;⑤收集气体;⑥验满。
大
向上排空气法
【考点延伸】
1.实验室制取气体的思路和方法:首先要明确实验室制取气体的化学反应原理,即选择合适的反应物和反应条件(如常温、加热、加催化剂等),其次要选择合适的实验装置,最后要研究如何验证制得的气体就是所要的气体。
2.用排空气法收集气体时还应注意三点:
(1)所收集的气体若有毒性,能用__________就不要用______ ______,以防污染空气。
(2)导管必须伸到集气瓶________,这样才能把集气瓶内的气体充分排尽。
排水法
排空
气法
底部
(3)如果不知道所收集气体的密度,可计算其相对__________ __,再与空气的平均相对分子质量29比较,比29大的密度就比空气的大,比29小的密度就比空气的小。
3.装置的选择
分子质量
发生装置 收集装置
固体与固体反应,需加热 固体与液体反应,不用加热 密度比空气小,且不与空气中的物质反应 密度比空气大,且不与空气中的物质反应 难溶于水,不与水反应
发生装置选择原则:________________________。
收集装置选择原则:________________________。
集气口诀
与水作用排气法,根据密度定上下。
不溶微溶排水法,所得气体纯度大。
记忆卡片
反应物状态、反应条件
气体密度、气体溶解性
考点5 说明检验二氧化碳气体的方法(b)
CO2气体的验证:①检验方法:将生成的无色、无味的气体通入______________中,若澄清石灰水__________,则该气体为CO2。反应的化学方程式:CO2+Ca(OH)2===CaCO3↓+H2O。②验满的方法:将一根燃着的木条放在集气瓶口(不要伸入瓶内),如果木条立即熄灭,则CO2气体已集满。
澄清石灰水
变浑浊
类型一 掌握二氧化碳的制取、检验综合题
典例 [2017·苏州]实验室常用块状大理石和稀
盐酸制取CO2气体。
(1)写出实验室制取CO2的化学方程式:
______________________________________。
(2)若用如图所示装置(固定装置省略)制取CO2。连接好装置后,需检查装置的气密性。具体操作方法是:先_____(填字母,下同),后_____,若导管口有气泡,放手后导管内上升一段稳定的水柱,则气密性良好。
CaCO3+2HCl=== CaCl2+H2O+CO2↑
B
A
A.用手捂住试管
B.将导管一端浸入水中
(3)实验室收集CO2可用的方法是_____(填字母)。
A.排水法
B.向下排空气法
C.向上排空气法
(4)实验室常用澄清石灰水检验CO2,写出反应的化学方程式:__________________________________。
C
CO2+Ca(OH)2===CaCO3↓+H2O
(5)某些大理石中含少量硫化物,使制得的CO2中混有H2S气体。欲获取纯净、干燥的CO2,需对发生装置中产生的气体进行除杂,实验装置如下:
查阅资料:Ⅰ.H2S能与NaOH等碱溶液、CuSO4溶液反应。
Ⅱ.CO2中混有的HCl气体可用饱和NaHCO3溶液吸收。
①装置甲中所盛试剂应选用______(填字母)。
A.浓硫酸 B.NaOH溶液
C.澄清石灰水 D.CuSO4溶液
②装置丙的作用是________________________________。
D
除去CO2中的水蒸气(或干燥CO2)
跟踪训练 实验室制取干燥的二氧化碳气体,不会用到的装置是 ( )
A.①③⑤ B.②④⑤
C.①④⑤ D.②④⑥
C
类型二 掌握探究二氧化碳的性质综合题
典例 某同学设计了如图A~F气体制取与性质实验的组合装置。打开活塞K,很快看到F装置中蜡烛由下至上依次熄灭。请根据如图回答问题:
(1)仪器①的名称为________。
试管
(3)打开活塞K后,观察到B装置热水中的白磷燃烧。该现象说明燃烧需要的条件之一是____________。
(4)D装置中发生反应的化学方程式为_______________________ ______________。
(5)E装置中观察到的现象为________________________。
(6)F装置中蜡烛由下至上依次熄灭的原因是_________________ _____________________________。
(7)若用G装置收集二氧化碳,气体应从_____(选填“a”或“b”)端通入。
可使反应随时发生或停止,节
约药品
+O2↑
催化作用
需要氧气
CaCO3+2HCl===CaCl2
+H2O+CO2↑
紫色石蕊试液变成红色
二氧化碳既不燃烧
也不支持燃烧,密度比空气大
a
跟踪训练 [2017·重庆B卷]某同学设计了如图所示的装置,用于实验室制取CO2并对它的部分性质进行探究,按要求答题。
A B C D
(1)仪器m的名称是__________,图A中发生反应的化学方程式为_____________________________________。
锥形瓶
CaCO3+2HCl===CaCl2+H2O+CO2↑
(2)若要图B中的两个气球悬浮在空气中,则气体甲可能是_____(填字母)。
a.空气 b.氧气 c.氢气
(3)往图C中的试管通入CO2,当出现________________现象,表明石灰水的溶质刚好完全沉淀。
(4)向图D中的塑料软瓶中倒入一定量的NaOH溶液,迅速拧紧瓶盖,振荡,可观察到瓶子变瘪。若使塑料软瓶恢复原状,可用注射器向瓶中注入过量的________________(填试剂名称)充分反应即可,反应完成后瓶中溶液的溶质是_____________________ ___________ (填化学式)。
c
红色恰好消失
盐酸(或硫酸)
NaCl和HCl(或Na2SO4
和H2SO4)
类型三 二氧化碳的应用
典例 下列说法正确的是 ( )
A.计算机房失火只能用泡沫灭火器灭火
B.二氧化碳有毒,空气中含量过高,会使人中毒死亡
C.在煤矿的矿井里,通风并严禁烟火,可以有效地防止发 生爆炸事故
D.某物质完全燃烧后生成二氧化碳和水,则该物质一定由 碳、氢、氧三种元素组成
C
跟踪训练 [2018·临沂模拟]农业科技人员向农民建议:在进行温室种植时,可向温室内通入适量CO2,这主要是因为 ( )
A.CO2可使害虫窒息死亡从而防治病虫害
B.CO2有利于植物进行光合作用
C.CO2可产生温室效应从而提高室温
D.CO2能灭火,施用后可以防止火灾
B
因认为二氧化碳不可用排水法收集致错
典例 小张用足量的盐酸和石灰石反应,并尝试直接利用如图所示装置制取和收集一瓶CO2。你认为小张 ( )
A B C
A.不可能收集到一瓶CO2,因为CO2可溶于水
B.选择B、C两种装置,导管b接导管d可收集到一瓶CO2
C.选择B、C两种装置,导管c接导管d可收集到一瓶CO2
D.选择A、B两种装置,导管a接导管c可收集到一瓶CO2
【错解】选A
【析错】因认为二氧化碳易溶于水而不能用排水法收集。实际上,1体积水中能溶解1体积的二氧化碳,二氧化碳水溶液饱和之后,仍然可以用排水法收集到二氧化碳,只是相比于氧气、氢气等微溶于水的气体,二氧化碳用排水法收集得慢。
【正解】选B
跟踪训练 [2016·丽水]质疑与探究是科学课堂永恒的主题。下列是小科同学对气体收集方式本质原因的探究。
(1)有些同学说:“CO2要用向上排空气法收集,不能用向下排空气法收集。”小科同学疑惑:为什么不能用向下排空气法收集?于是,进行了如图对比实验:
用图甲和图乙两种方式收集CO2,通入的气体流速和时间相同,发现甲集气瓶收集到的CO2浓度较大,乙集气瓶的CO2浓度很小。请分析两者浓度相差较大的原因。
(2)有些同学说:“O2可以用排水集气法收集,但CO2不能用排水集气法收集。”对此,小科同学疑惑,于是又进行了如图对比实验:用图丙装置分别以相同流速通入O2和CO2,发现收集满O2比CO2耗时少。请分析原因。
【答案】 (1)当CO2沿导管到达图甲集气瓶底部后,由于CO2密度大于空气,排出集气瓶中原有的空气,最后得到较纯的CO2;当CO2沿导管到达图乙集气瓶底部后,由于CO2密度大于空气,大多数CO2会从瓶口逸出,残留在集气瓶中CO2不多,故CO2纯度不高。
(2)由于CO2能溶于水,O2不易溶于水,CO2溶于水中的量多,故用排水法收集满一集气瓶气体时,O2耗时少。
二氧化碳的制取和性质研究
1.实验原理图
2.实验原理
原理1:CaCO3+2HCl===CaCl2+H2O+CO2↑。
原理2:CO2+Ca(OH)2===CaCO3↓+H2O H2O+CO2===H2CO3。
3.实验结论
结论一:二氧化碳密度大于空气密度;二氧化碳不燃烧也不支持燃烧。
结论二:二氧化碳能使澄清石灰水变浑浊。
结论三:二氧化碳的水溶液会使____________试液变红。
4.实验关键点
(1)实验仪器使用和操作过程的注意事项:长颈漏斗使用的时候需要________。
(2)若选用大理石或石灰石为原料,则不能用稀硫酸。因为生成的硫酸钙是微溶性物质,它包裹在______________,从而使反应中止。
紫色石蕊
液封
大理石表面
(3)收集二氧化碳的时候,集气瓶朝上,用向上排空气法,导管应伸入到集气瓶底部。若未伸入到集气瓶底部则会使收集到的气体________。
5.实验拓展
拓展:二氧化碳与氢氧化钠反应没有沉淀、气
体、颜色变化等明显现象,只有气压减小这一不
易观察的现象。故探究二氧化碳性质时,必须借
助其他现象来反映二氧化碳与氢氧化钠发生了反应。
起式:课本实验:通过瓶内气压变化证明二氧化碳与水发生反应,如图;
不纯
变式:
(1)使用塑料瓶,观察塑料瓶变扁,说明瓶内二氧化碳与氢氧化钠发生了反应,如图甲。
(2)密闭容器中使用气球,观察气球的变化,如图乙。
(3)使用U形管,观察反应体系的气压变化,如图丙。
(4)使用等量的清水做对比,观察对比进入试管内水的量确定二氧化碳与氢氧化钠发生反应,如图丁。
(5)使用澄清石灰水对通过氢氧化钠的二氧化碳进行检测,如图戊。
典例 [2018·金华]某拓展性学习小组在
学校科学实验创新比赛中,做了一
个有趣的实验,装置如图。
实验设计:三颈烧瓶中充满二氧
化碳气体,A颈、B颈分别连接充满氢氧化钠溶液和盐酸的注射器,C颈插有两端开口的玻璃导管(伸入瓶内的一端连有小气球),装置气密性良好。
实验操作:先通过A颈往瓶内注入氢氧化钠溶液,观察到小气球的形状发生了变化;过一段时间后再通过B颈往瓶中注入盐酸,发现小气球的形状又发生了改变。
请描述小气球形状的变化情况,并对此作出合理的解释。
【答案】 实验现象:小气球“先膨胀,后变瘪”(或“先变大,后变小)。2NaOH+CO2===Na2CO3+H2O,NaOH溶液吸收CO2,使瓶内气压减小,导致气球膨胀;注入盐酸,Na2CO3+2HCl===2NaCl+H2O+CO2↑,HCl与Na2CO3反应生成CO2,使瓶内气压增大,导致气球变瘪。
1.[2017·台州]下列实验现象只能反映二氧化碳物理性质的是 ( )
A.紫色石蕊变红色 B.石灰水变浑浊
C.蜡烛熄灭 D.杠杆左高右低
D
2.[2018·临沂模拟]进入久未开启的菜窖之前,人们如何利用较简便的方法检验菜窖中CO2含量是否会对进入菜窖的人的生命构成威胁 ( )
A.让一个身强力壮的男子进去试验一下
B.做“灯火实验”观察
C.放一杯澄清石灰水进去观察
D.放一只小白兔进去观察
B
3.[2017·苏州吴中区一模]下列装置分别应用于实验室二氧化碳的制备、干燥、收集、验满的实验,不能达到实验目的的是 ( )
A B C D
【解析】 生石灰能与水反应生成氢氧化钙,生成的氢氧化钙能与二氧化碳反应,不能用生石灰干燥二氧化碳,图中所示装置不能达到实验目的。
B
4.[2018·温州]人类发现二氧化碳经历了多个世纪,下列是其过程中的部分资料。
资料一:1630年,海尔蒙特发现在一些洞穴处,有一种能使 燃着的蜡烛熄灭的气体,后来被证实是CO2。
资料二:1754年,布莱克将石灰石煅烧首次制得CO2,并完 成了如下所示的物质转化研究。
资料三:1766年,卡文迪许通过实验测得,室温下1体积水 大约能溶解1体积二氧化碳气体。
(1)根据海尔蒙特的发现,可推测二氧化碳的化学性质:______ ___________________。
(2)写出布莱克实验中反应③的化学方程式:_________________ __________________。
(3)如图,在室温下将容积为200mL的广口瓶
注满蒸馏水,通过导管缓慢通入300mL CO2。
如果卡文迪许的结论是正确的,则在量筒中
收集到的水约为_______mL。
既不
燃烧也不支持燃烧
Ca(OH)2+CO2
===CaCO3↓+H2O
100
5.[荆州中考]有如图所示的仪器和KClO3、MnO2、稀H2SO4、石灰石、稀盐酸等药品供选择,若在实验室完成如下实验,请填写下列空白处:
(1)制取并收集CO2气体,你选择的仪器和药品是__________ __________________(仪器填序号)。
(2)若再补充一种药品,也可用上述制CO2的装置来制O2,你补充的药品是____________。
①②⑦⑧
和石灰石、稀盐酸
过氧化氢
(3)若再补充一种仪器,并选择上述原有的仪器和药品制取并收集O2,你认为需要补充的仪器是________,你选择的药品是_________________。
试管
KClO3、MnO2
二氧化碳
考点1 说出二氧化碳的主要物理性质(a)
1.在通常状态下,二氧化碳是一种_____________的气体。
2.密度为1.977g/L,相同条件下,二氧化碳的密度比空气的大,约是空气密度的1.5倍,因此能像__________那样从一个容器向另一个容器倾倒。
3.能溶于水,通常1体积水中能溶解1体积的二氧化碳。
4.在加压降温的情况下,二氧化碳能转变为无色液体,甚至变成雪状固体——干冰。
无色、无味
倒液体
考点2 说明二氧化碳的主要化学性质(b)
1.________________________________________。
既不能燃烧也不支持燃烧,不能供给呼吸
碳酸
3.能与NaOH、KOH、Ca(OH)2 等可溶性碱发生反应。
二氧化碳能使澄清石灰水变浑浊:CO2+Ca(OH)2=== CaCO3↓+H2O,此反应可用来______________二氧化碳。但在吸收二氧化碳时又不用石灰水,因为氢氧化钙在水中的溶解度很小,无法将二氧化碳完全吸收,要吸收二氧化碳一般用浓碱溶液,如氢氧化钠浓溶液。
鉴定和检验
【考点延伸】
考点3 说出二氧化碳的主要用途(a)
1.二氧化碳的用途:①可作__________;②可作化工原料,用来制作纯碱、尿素和汽水;③“干冰”作__________,用来保存食品和人工降雨;④用作____________。
灭火剂
致冷剂
气体肥料
2.二氧化碳对生活和环境的影响
(1)二氧化碳对人体健康的影响:CO2本身____________,但当空气中的CO2超过正常含量时,会对人体产生有害的影响。
进入久未开启的菜窖或干涸的深井之前,必须做灯火实验。
(2)二氧化碳对环境的影响:温室效应。
没有毒性
空气中二氧化碳的体积分数(%) 对人体的影响
1 感到气闷、头晕、心悸
4~5 感到气喘、头痛、眩晕
10以上 使人神志不清、呼吸停止,以致死亡
考点4 说出实验室制备、收集二氧化碳的原理、装置及主要步
骤(a)
二氧化碳的实验室制法
(1)药品:大理石(或石灰石)与__________。
一般不用其他药品代替的原因:①不用Na2CO3代替大理石,是因为Na2CO3与盐酸反应速率太快,不便于控制;②不用浓盐酸,是因为浓盐酸易挥发出HCl气体,使CO2不纯;③不用H2SO4代替盐酸,是因为H2SO4与CaCO3反应生成________的__________会覆盖在大理石的表面,阻止反应的继续进行。
(2)原理:CaCO3+2HCl===CaCl2+H2O+CO2 ↑。
稀盐酸
微溶
CaSO4
(3)制取装置如图所示:
(4)收集:CO2密度比空气______、能溶于水且与水反应生成碳酸,一般只用________________收集CO2气体。收集气体时,导气管应伸到集气瓶底部以排尽集气瓶中的空气,使收集到的气体纯度较高。
(5)操作步骤:①按要求连接好仪器;②检查装置的气密性;③向反应器中装入大理石;④向长颈漏斗中注入稀盐酸;⑤收集气体;⑥验满。
大
向上排空气法
【考点延伸】
1.实验室制取气体的思路和方法:首先要明确实验室制取气体的化学反应原理,即选择合适的反应物和反应条件(如常温、加热、加催化剂等),其次要选择合适的实验装置,最后要研究如何验证制得的气体就是所要的气体。
2.用排空气法收集气体时还应注意三点:
(1)所收集的气体若有毒性,能用__________就不要用______ ______,以防污染空气。
(2)导管必须伸到集气瓶________,这样才能把集气瓶内的气体充分排尽。
排水法
排空
气法
底部
(3)如果不知道所收集气体的密度,可计算其相对__________ __,再与空气的平均相对分子质量29比较,比29大的密度就比空气的大,比29小的密度就比空气的小。
3.装置的选择
分子质量
发生装置 收集装置
固体与固体反应,需加热 固体与液体反应,不用加热 密度比空气小,且不与空气中的物质反应 密度比空气大,且不与空气中的物质反应 难溶于水,不与水反应
发生装置选择原则:________________________。
收集装置选择原则:________________________。
集气口诀
与水作用排气法,根据密度定上下。
不溶微溶排水法,所得气体纯度大。
记忆卡片
反应物状态、反应条件
气体密度、气体溶解性
考点5 说明检验二氧化碳气体的方法(b)
CO2气体的验证:①检验方法:将生成的无色、无味的气体通入______________中,若澄清石灰水__________,则该气体为CO2。反应的化学方程式:CO2+Ca(OH)2===CaCO3↓+H2O。②验满的方法:将一根燃着的木条放在集气瓶口(不要伸入瓶内),如果木条立即熄灭,则CO2气体已集满。
澄清石灰水
变浑浊
类型一 掌握二氧化碳的制取、检验综合题
典例 [2017·苏州]实验室常用块状大理石和稀
盐酸制取CO2气体。
(1)写出实验室制取CO2的化学方程式:
______________________________________。
(2)若用如图所示装置(固定装置省略)制取CO2。连接好装置后,需检查装置的气密性。具体操作方法是:先_____(填字母,下同),后_____,若导管口有气泡,放手后导管内上升一段稳定的水柱,则气密性良好。
CaCO3+2HCl=== CaCl2+H2O+CO2↑
B
A
A.用手捂住试管
B.将导管一端浸入水中
(3)实验室收集CO2可用的方法是_____(填字母)。
A.排水法
B.向下排空气法
C.向上排空气法
(4)实验室常用澄清石灰水检验CO2,写出反应的化学方程式:__________________________________。
C
CO2+Ca(OH)2===CaCO3↓+H2O
(5)某些大理石中含少量硫化物,使制得的CO2中混有H2S气体。欲获取纯净、干燥的CO2,需对发生装置中产生的气体进行除杂,实验装置如下:
查阅资料:Ⅰ.H2S能与NaOH等碱溶液、CuSO4溶液反应。
Ⅱ.CO2中混有的HCl气体可用饱和NaHCO3溶液吸收。
①装置甲中所盛试剂应选用______(填字母)。
A.浓硫酸 B.NaOH溶液
C.澄清石灰水 D.CuSO4溶液
②装置丙的作用是________________________________。
D
除去CO2中的水蒸气(或干燥CO2)
跟踪训练 实验室制取干燥的二氧化碳气体,不会用到的装置是 ( )
A.①③⑤ B.②④⑤
C.①④⑤ D.②④⑥
C
类型二 掌握探究二氧化碳的性质综合题
典例 某同学设计了如图A~F气体制取与性质实验的组合装置。打开活塞K,很快看到F装置中蜡烛由下至上依次熄灭。请根据如图回答问题:
(1)仪器①的名称为________。
试管
(3)打开活塞K后,观察到B装置热水中的白磷燃烧。该现象说明燃烧需要的条件之一是____________。
(4)D装置中发生反应的化学方程式为_______________________ ______________。
(5)E装置中观察到的现象为________________________。
(6)F装置中蜡烛由下至上依次熄灭的原因是_________________ _____________________________。
(7)若用G装置收集二氧化碳,气体应从_____(选填“a”或“b”)端通入。
可使反应随时发生或停止,节
约药品
+O2↑
催化作用
需要氧气
CaCO3+2HCl===CaCl2
+H2O+CO2↑
紫色石蕊试液变成红色
二氧化碳既不燃烧
也不支持燃烧,密度比空气大
a
跟踪训练 [2017·重庆B卷]某同学设计了如图所示的装置,用于实验室制取CO2并对它的部分性质进行探究,按要求答题。
A B C D
(1)仪器m的名称是__________,图A中发生反应的化学方程式为_____________________________________。
锥形瓶
CaCO3+2HCl===CaCl2+H2O+CO2↑
(2)若要图B中的两个气球悬浮在空气中,则气体甲可能是_____(填字母)。
a.空气 b.氧气 c.氢气
(3)往图C中的试管通入CO2,当出现________________现象,表明石灰水的溶质刚好完全沉淀。
(4)向图D中的塑料软瓶中倒入一定量的NaOH溶液,迅速拧紧瓶盖,振荡,可观察到瓶子变瘪。若使塑料软瓶恢复原状,可用注射器向瓶中注入过量的________________(填试剂名称)充分反应即可,反应完成后瓶中溶液的溶质是_____________________ ___________ (填化学式)。
c
红色恰好消失
盐酸(或硫酸)
NaCl和HCl(或Na2SO4
和H2SO4)
类型三 二氧化碳的应用
典例 下列说法正确的是 ( )
A.计算机房失火只能用泡沫灭火器灭火
B.二氧化碳有毒,空气中含量过高,会使人中毒死亡
C.在煤矿的矿井里,通风并严禁烟火,可以有效地防止发 生爆炸事故
D.某物质完全燃烧后生成二氧化碳和水,则该物质一定由 碳、氢、氧三种元素组成
C
跟踪训练 [2018·临沂模拟]农业科技人员向农民建议:在进行温室种植时,可向温室内通入适量CO2,这主要是因为 ( )
A.CO2可使害虫窒息死亡从而防治病虫害
B.CO2有利于植物进行光合作用
C.CO2可产生温室效应从而提高室温
D.CO2能灭火,施用后可以防止火灾
B
因认为二氧化碳不可用排水法收集致错
典例 小张用足量的盐酸和石灰石反应,并尝试直接利用如图所示装置制取和收集一瓶CO2。你认为小张 ( )
A B C
A.不可能收集到一瓶CO2,因为CO2可溶于水
B.选择B、C两种装置,导管b接导管d可收集到一瓶CO2
C.选择B、C两种装置,导管c接导管d可收集到一瓶CO2
D.选择A、B两种装置,导管a接导管c可收集到一瓶CO2
【错解】选A
【析错】因认为二氧化碳易溶于水而不能用排水法收集。实际上,1体积水中能溶解1体积的二氧化碳,二氧化碳水溶液饱和之后,仍然可以用排水法收集到二氧化碳,只是相比于氧气、氢气等微溶于水的气体,二氧化碳用排水法收集得慢。
【正解】选B
跟踪训练 [2016·丽水]质疑与探究是科学课堂永恒的主题。下列是小科同学对气体收集方式本质原因的探究。
(1)有些同学说:“CO2要用向上排空气法收集,不能用向下排空气法收集。”小科同学疑惑:为什么不能用向下排空气法收集?于是,进行了如图对比实验:
用图甲和图乙两种方式收集CO2,通入的气体流速和时间相同,发现甲集气瓶收集到的CO2浓度较大,乙集气瓶的CO2浓度很小。请分析两者浓度相差较大的原因。
(2)有些同学说:“O2可以用排水集气法收集,但CO2不能用排水集气法收集。”对此,小科同学疑惑,于是又进行了如图对比实验:用图丙装置分别以相同流速通入O2和CO2,发现收集满O2比CO2耗时少。请分析原因。
【答案】 (1)当CO2沿导管到达图甲集气瓶底部后,由于CO2密度大于空气,排出集气瓶中原有的空气,最后得到较纯的CO2;当CO2沿导管到达图乙集气瓶底部后,由于CO2密度大于空气,大多数CO2会从瓶口逸出,残留在集气瓶中CO2不多,故CO2纯度不高。
(2)由于CO2能溶于水,O2不易溶于水,CO2溶于水中的量多,故用排水法收集满一集气瓶气体时,O2耗时少。
二氧化碳的制取和性质研究
1.实验原理图
2.实验原理
原理1:CaCO3+2HCl===CaCl2+H2O+CO2↑。
原理2:CO2+Ca(OH)2===CaCO3↓+H2O H2O+CO2===H2CO3。
3.实验结论
结论一:二氧化碳密度大于空气密度;二氧化碳不燃烧也不支持燃烧。
结论二:二氧化碳能使澄清石灰水变浑浊。
结论三:二氧化碳的水溶液会使____________试液变红。
4.实验关键点
(1)实验仪器使用和操作过程的注意事项:长颈漏斗使用的时候需要________。
(2)若选用大理石或石灰石为原料,则不能用稀硫酸。因为生成的硫酸钙是微溶性物质,它包裹在______________,从而使反应中止。
紫色石蕊
液封
大理石表面
(3)收集二氧化碳的时候,集气瓶朝上,用向上排空气法,导管应伸入到集气瓶底部。若未伸入到集气瓶底部则会使收集到的气体________。
5.实验拓展
拓展:二氧化碳与氢氧化钠反应没有沉淀、气
体、颜色变化等明显现象,只有气压减小这一不
易观察的现象。故探究二氧化碳性质时,必须借
助其他现象来反映二氧化碳与氢氧化钠发生了反应。
起式:课本实验:通过瓶内气压变化证明二氧化碳与水发生反应,如图;
不纯
变式:
(1)使用塑料瓶,观察塑料瓶变扁,说明瓶内二氧化碳与氢氧化钠发生了反应,如图甲。
(2)密闭容器中使用气球,观察气球的变化,如图乙。
(3)使用U形管,观察反应体系的气压变化,如图丙。
(4)使用等量的清水做对比,观察对比进入试管内水的量确定二氧化碳与氢氧化钠发生反应,如图丁。
(5)使用澄清石灰水对通过氢氧化钠的二氧化碳进行检测,如图戊。
典例 [2018·金华]某拓展性学习小组在
学校科学实验创新比赛中,做了一
个有趣的实验,装置如图。
实验设计:三颈烧瓶中充满二氧
化碳气体,A颈、B颈分别连接充满氢氧化钠溶液和盐酸的注射器,C颈插有两端开口的玻璃导管(伸入瓶内的一端连有小气球),装置气密性良好。
实验操作:先通过A颈往瓶内注入氢氧化钠溶液,观察到小气球的形状发生了变化;过一段时间后再通过B颈往瓶中注入盐酸,发现小气球的形状又发生了改变。
请描述小气球形状的变化情况,并对此作出合理的解释。
【答案】 实验现象:小气球“先膨胀,后变瘪”(或“先变大,后变小)。2NaOH+CO2===Na2CO3+H2O,NaOH溶液吸收CO2,使瓶内气压减小,导致气球膨胀;注入盐酸,Na2CO3+2HCl===2NaCl+H2O+CO2↑,HCl与Na2CO3反应生成CO2,使瓶内气压增大,导致气球变瘪。
同课章节目录
