浙江省中考科学(化学部分)第二篇主题1第四单元金属(2)(课件 29张ppt)
文档属性
| 名称 | 浙江省中考科学(化学部分)第二篇主题1第四单元金属(2)(课件 29张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-03-10 11:28:03 | ||
图片预览






文档简介
第四单元 金属(2)
1.[2017·丽水]如图为某文化衫图案,你的美(Mg)偷走我的心(Zn)能发生,是由于镁的 ( )
A.延展性好
B.导电性好
C.导热性好
D.金属活动性比锌强
D
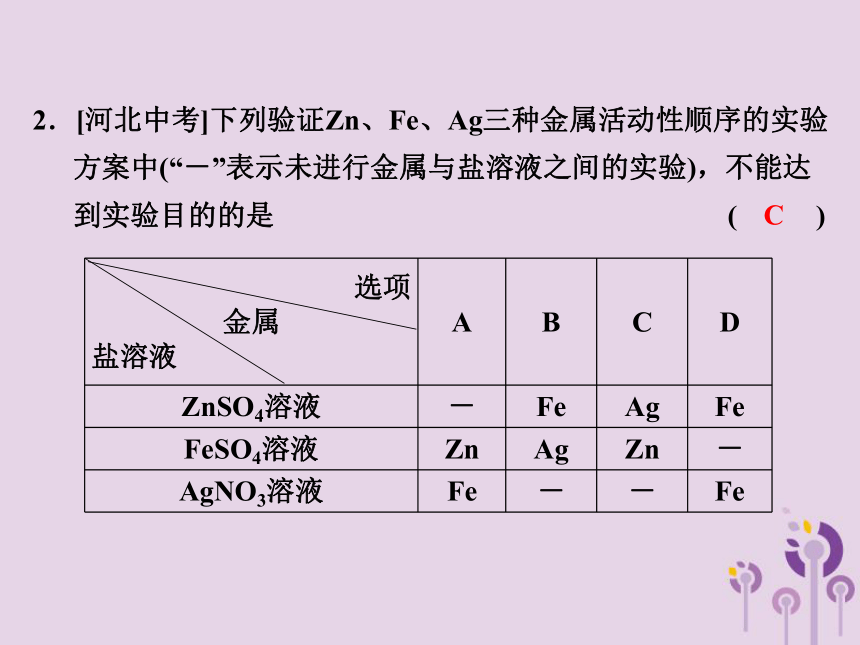
2.[河北中考]下列验证Zn、Fe、Ag三种金属活动性顺序的实验方案中(“-”表示未进行金属与盐溶液之间的实验),不能达到实验目的的是 ( )
C
选项
金属
盐溶液 A B C D
ZnSO4溶液 - Fe Ag Fe
FeSO4溶液 Zn Ag Zn -
AgNO3溶液 Fe - - Fe
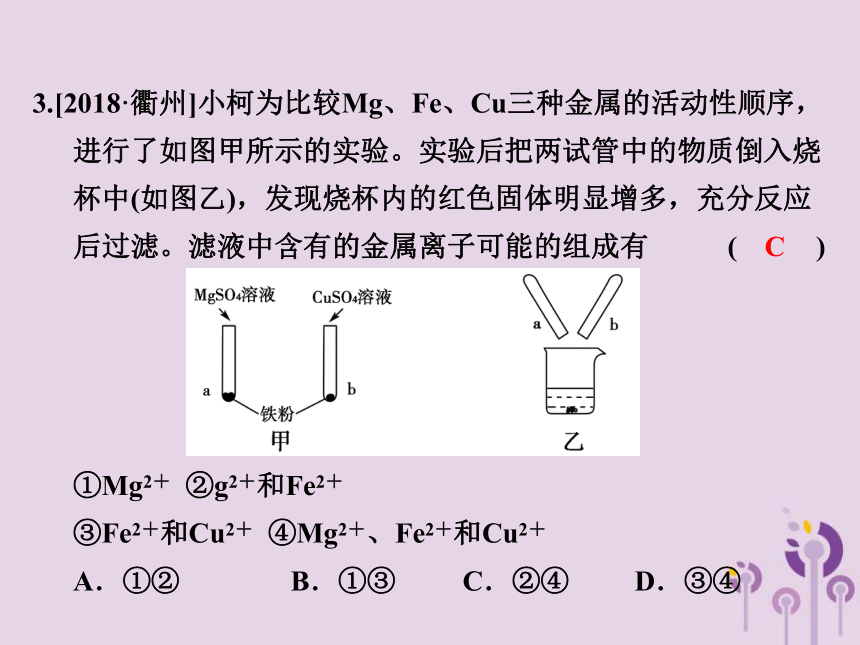
3.[2018·衢州]小柯为比较Mg、Fe、Cu三种金属的活动性顺序,进行了如图甲所示的实验。实验后把两试管中的物质倒入烧杯中(如图乙),发现烧杯内的红色固体明显增多,充分反应后过滤。滤液中含有的金属离子可能的组成有 ( )
①Mg2+ ②g2+和Fe2+
③Fe2+和Cu2+ ④Mg2+、Fe2+和Cu2+
A.①② B.①③ C.②④ D.③④
C
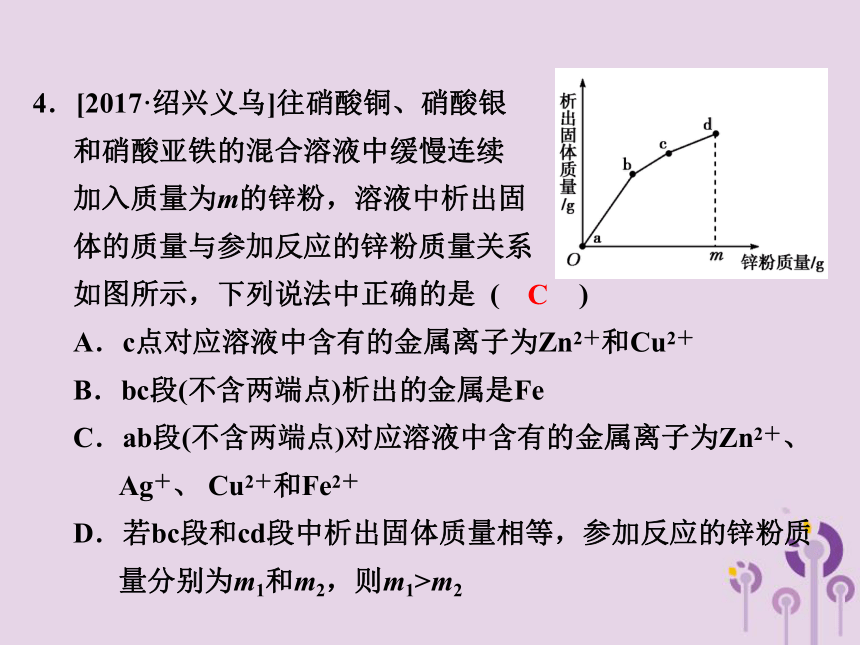
4.[2017·绍兴义乌]往硝酸铜、硝酸银
和硝酸亚铁的混合溶液中缓慢连续
加入质量为m的锌粉,溶液中析出固
体的质量与参加反应的锌粉质量关系
如图所示,下列说法中正确的是 ( )
A.c点对应溶液中含有的金属离子为Zn2+和Cu2+
B.bc段(不含两端点)析出的金属是Fe
C.ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、 Ag+、 Cu2+和Fe2+
D.若bc段和cd段中析出固体质量相等,参加反应的锌粉质 量分别为m1和m2,则m1>m2
C
【解析】 结合金属的活动性顺序,分析图像可知,ab段析出的固体为Ag,bc段析出的固体为Cu,cd段析出的固体为Fe。c点对应的溶液所含的金属离子应为Zn2+和Fe2+,若bc段和cd段析出的固体质量相同,根据化学方程式和Fe、Cu、Zn的相对原子质量可计算出参加反应的锌粉的质量m15.[2017·杭州]在试管中放入一根镁条(已去除氧化膜),往其中加入硝酸银溶液至浸没镁条,观察到如下现象:
①镁条表面迅速覆盖一层疏松的固体物质,经检验发现生成的固体物质中有单质银;
②镁条表面有明显的气泡现象,经检验发现气泡中有氢气。
对于上述实验现象的分析错误的是 ( )
A.镁能从硝酸银溶液中置换出银
B.镁跟硝酸银溶液反应会生成氢气
C.镁投入硝酸银溶液中只发生2AgNO3+Mg===Mg(NO3)2 +2Ag
D.根据该实验可判断镁比银化学活动性强
C
6.[2018·连云港]已知:金属X在常温下能与空气中的氧气反应,而金属Y和Z不能;将Y、Z分别投入稀盐酸中,Y溶解并产生气泡,Z无变化。下列说法正确的是 ( )
A.X氧化物的化学式只能表示为XO
B.Y能将X从它的盐溶液中置换出来
C.Z在自然界中只能以单质形式存在
D.三种金属的活动性顺序:X>Y>Z
D
金属活动性顺序
考点1 描述金属与酸、金属与盐反应的条件(a)
1.金属与酸的反应
(1)镁、铝、锌等可以与盐酸和稀硫酸反应,放出大量的热,同时产生________。反应的化学方程式如下:
Mg+2HCl===MgCl2+H2 ↑
2Al+6HCl===2AlCl3+3H2 ↑
Zn+2HCl===ZnCl2+H2 ↑
Mg+H2SO4===MgSO4+H2 ↑
2Al+3H2SO4===Al2(SO4)3+3H2↑
Zn+H2SO4===ZnSO4+H2 ↑
氢气
(2)因为锌和稀硫酸反应速度适中,所以实验室常用锌和稀硫酸反应来制取氢气。
(3)并不是所有的金属都可以与酸反应,铜一般不与盐酸和稀硫酸反应。
2.金属与盐溶液的反应
(1)不同的金属与盐溶液反应时,____________的金属先与盐反应。
(2)同一金属与溶液中不同的盐反应时,该金属先与活动性较弱的金属的盐溶液反应。
活动性强
(3)K、Ca、Na三种金属活动性太强,在与盐溶液反应时,先与水反应,生成的碱再与盐反应,因此置换反应一般不用K、Ca、Na。如把Na 放入CuSO4溶液中,会发生如下反应:2Na+2H2O===2NaOH+H2↑;2NaOH+CuSO4===Na2SO4+Cu(OH)2↓。
考点2 说出金属活动性顺序表(a)
金属活动性顺序:
考点3 会比较金属的活动性顺序(b)
考点4 能用金属活动性顺序说明某些现象和实际应用(b)
一种活动性较强的金属能把另一种活动性较弱的金属从它的盐的水溶液中置换出来,排在氢前面的金属可以把酸里的氢置换出来。
金属与酸反应
等质量金属跟足量酸反应,放出氢气由多到少的顺序:Al>Mg>Fe>Zn。
记忆卡片
类型一 理解金属活动性顺序
典例 [贺州中考]金属在日常生活中有着广泛的用途,常见金属的活动性顺序如下:
请回答下面问题:
(1)金属活动性顺序表中的X是_______元素。
Hg
(2)把一根用砂纸打磨过的铝丝浸入硫酸铜溶液中,过了一会儿,观察到的现象有_____________________________________ __,该反应的化学方程式为______________________________ __。
(3)向一定质量 的AgNO3和Cu(NO3)2混合溶
液中加入过量的Zn粉,溶液质量随反应时
间的变化情况如图所示,图中B点溶液中含
有的溶质有_______________________。
铝丝上附着红色固体,溶液的蓝色变浅
2Al+3CuSO4===3Cu+Al2(SO4)3
Cu(NO3)2、Zn(NO3)2
【解析】 (3)金属活动性顺序:Zn>Cu>Ag,向一定质量的AgNO3和Cu(NO3)2混合溶液中加入Zn粉,与两种溶质会依次发生反应:
Zn+2AgNO3===Zn(NO3)2+2Ag
65 216
所以析出银的过程是溶液质量减少的过程;
Zn+Cu(NO3)2===Zn(NO3)2+Cu
65 64
所以析出铜的过程是溶液质量增加的过程。B点时AgNO3恰好完全反应,还没有与Cu(NO3)2反应,此时溶液中含有Cu(NO3)2、Zn(NO3)2。
跟踪训练 [2017·吉林模拟]学习了金属活动性顺序后,某同学做了以下实验:
(1)探究Fe、Cu、Ag三种金属的活动性顺序:
①她设计了四个方案,其中你认为不可行的是______。
A.Fe、Ag、CuSO4溶液
B.Fe、Cu、AgNO3溶液、稀盐酸
C.Cu、FeCl2溶液、AgNO3溶液
D.Cu、Ag、Fe、稀盐酸
②写出上述C方案中发生反应的化学方程式:______________ ____________________。
D
Cu+2AgNO3
===Cu(NO3)2+2Ag
(2)将铁粉加入盛有ZnSO4和CuSO4混合溶液的烧杯中,充分反应后过滤,在滤渣中滴入稀盐酸,有气泡产生。据此判断,滤渣中含有__________;滤液中的溶质是________________(写化学式);滴加盐酸时反应的化学方程式为____________________ ______。
【点悟】 验证某三种金属的金属活动性顺序,可以用三种金属中金属活动性最强和最弱的两种金属和金属活动性居于中间的金属的盐溶液反应,也可以用活动性前后金属的盐溶液和中间的金属反应。
铜、铁
ZnSO4、FeSO4
Fe+2HCl===FeCl2+
H2↑
类型二 理解金属的化学性质
典例 [潍坊中考改编]金属在日常生活、工农业生产和科学研究方面应用广泛。某实验小组为了探究影响金属与酸反应快慢的因素,进行如表实验:
实验序号 实验过程 实验现象
1 镁粉和铁粉分别与5%盐酸反应 镁粉参与的反应产生气体快
2 铁粉和铁片分别与15%盐酸反应 铁粉参与的反应产生气体快
3 铁片分别与5%盐酸和15%盐酸反应 15%盐酸参与的反应产生气体快
(1)由此得出影响金属与酸反应快慢的因素有:
①______________________________________。
②______________________________________________。
③____________________________________。
(2)小明将一包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到滤渣和滤液。
①锌和硝酸银溶液反应的化学方程式是__________________ ________________。
②若滤液为蓝色,则滤液中一定含有的金属离子是__________ _______(写离子符号)。
金属的活动性;活动性越强,反应越快
金属与酸的接触面积;接触面积越大,反应越快
酸的浓度;酸的浓度越大,反应越快
Zn+2AgNO3===
Zn(NO3)2+2Ag
Zn2+、
Cu2+
跟踪训练 [2016·金华]有A、B两种金属放入等质量分数的稀硫酸中,生成氢气的质量与反应时间的关系如图所示,下列结论合理的是 ( )
A.金属活动性A>B
B.生成氢气的质量A>B
C.反应的硫酸质量A<B
D.反应的金属质量A<B
【解析】 由图可知,相同时间内B放出氢气的质量大于A,可判断金属活动性顺序是B>A;金属与酸反应生成氢气时,氢气来源于酸中的氢元素,所以消耗硫酸的质量A>B;金属的相对原子质量不确定,所以不能确定参加反应的金属质量。
B
【点悟】 活动性越强的金属与酸反应越剧烈,即反应放出氢气的速度越快;化合价变化相同的等质量金属完全反应放出氢气的质量与金属的相对原子质量成反比。
对验证金属活动性的方法理解不清致错
典例 某同学设计了以下三个实验,要证明Cu、Zn、Ag的活动性顺序,必须要做的实验是 ( )
A.①② B.②③
C.①③ D.①②③
【错解】选D
【析错】没有掌握验证金属的活动性顺序的方法。①铜丝能与硝酸银溶液反应置换出银,说明了金属活动性铜>银;②锌能与硫酸铜溶液反应置换出铜,说明了金属活动性锌>铜;由①②即可证明铜、锌、银的金属活动性顺序为锌>铜>银。
【正解】选A
跟踪训练 [岳阳中考]在已经调平的托盘天平两边各放一只等质量的烧杯,向烧杯中各加入质量相等、溶质质量分数相同的稀硫酸,然后在左边烧杯中放入一定质量的镁,在右边的烧杯中放入与镁等质量的铝。待充分反应后,下列分析错误的是
( )
A.天平保持平衡,左边烧杯中,酸没有剩余,镁可能有剩余
B.天平保持平衡,右边烧杯中,酸没有剩余,铝一定有剩余
C.天平失去平衡,左边烧杯中,酸一定剩余,镁一定没剩余
D.天平失去平衡,右边烧杯中,酸可能剩余,铝一定没剩余
D
【解析】 根据化学方程式可得:
Mg+H2SO4===MgSO4+H2↑
24 98 2
2Al+3H2SO4===Al2(SO4)3+3H2↑
54 294 6
18 98 2
天平保持平衡,则左右两边生成的氢气质量相同,镁可能恰好完全反应,铝一定有剩余;天平失去平衡,则两边生成氢气质量不同,镁一定完全反应,左边烧杯酸有剩余,右边烧杯中情况有3种可能:酸没有剩余,铝有剩余;或铝没有剩余,酸有剩余;或酸与铝恰好完全反应,均没有剩余。
比较铁与铜、铜与银的化学活动性
1.教材实验原理图
2.实验结论
金属活动性:铁>铜>银。
3.实验关键点
(1)在做铁置换反应时要除锈,防止干扰实验。
(2)将铜丝放在硝酸银溶液中,铜丝表面会有黑色固体而不是银白色固体,这种现象和硝酸银溶液的浓度有关,浓度较低,析出的固体呈黑色。
(3)实验设计技巧
中间金属两头盐―→FeSO4溶液、Cu、AgNO3溶液
两头金属中间盐―→Fe、CuSO4溶液、Ag
必要时请酸帮忙―→Fe、HCl、Cu、AgNO3溶液
典例 [2017·宁波鄞州区模拟改编]根据如图三个科学实验,回答问题:
(1)描述实验甲中的实验现象:__________________________ __________________。
(2)乙中发生反应的化学方程式为________________________ _____。
铜丝表面附着一层银白色固
体,溶液变为蓝色
Zn+CuSO4===ZnSO4+
Cu
(3)在实验丙后的剩余溶液中,一定有的溶质是__________,可能有的溶质是__________,为了确定可能有的溶质,可加入______。
A.氯化钡溶液 B.氢氧化铜
C.氯化钠溶液 D.锌粒
ZnSO4
H2SO4
BD
1.[2017·丽水]如图为某文化衫图案,你的美(Mg)偷走我的心(Zn)能发生,是由于镁的 ( )
A.延展性好
B.导电性好
C.导热性好
D.金属活动性比锌强
D
2.[河北中考]下列验证Zn、Fe、Ag三种金属活动性顺序的实验方案中(“-”表示未进行金属与盐溶液之间的实验),不能达到实验目的的是 ( )
C
选项
金属
盐溶液 A B C D
ZnSO4溶液 - Fe Ag Fe
FeSO4溶液 Zn Ag Zn -
AgNO3溶液 Fe - - Fe
3.[2018·衢州]小柯为比较Mg、Fe、Cu三种金属的活动性顺序,进行了如图甲所示的实验。实验后把两试管中的物质倒入烧杯中(如图乙),发现烧杯内的红色固体明显增多,充分反应后过滤。滤液中含有的金属离子可能的组成有 ( )
①Mg2+ ②g2+和Fe2+
③Fe2+和Cu2+ ④Mg2+、Fe2+和Cu2+
A.①② B.①③ C.②④ D.③④
C
4.[2017·绍兴义乌]往硝酸铜、硝酸银
和硝酸亚铁的混合溶液中缓慢连续
加入质量为m的锌粉,溶液中析出固
体的质量与参加反应的锌粉质量关系
如图所示,下列说法中正确的是 ( )
A.c点对应溶液中含有的金属离子为Zn2+和Cu2+
B.bc段(不含两端点)析出的金属是Fe
C.ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、 Ag+、 Cu2+和Fe2+
D.若bc段和cd段中析出固体质量相等,参加反应的锌粉质 量分别为m1和m2,则m1>m2
C
【解析】 结合金属的活动性顺序,分析图像可知,ab段析出的固体为Ag,bc段析出的固体为Cu,cd段析出的固体为Fe。c点对应的溶液所含的金属离子应为Zn2+和Fe2+,若bc段和cd段析出的固体质量相同,根据化学方程式和Fe、Cu、Zn的相对原子质量可计算出参加反应的锌粉的质量m1
①镁条表面迅速覆盖一层疏松的固体物质,经检验发现生成的固体物质中有单质银;
②镁条表面有明显的气泡现象,经检验发现气泡中有氢气。
对于上述实验现象的分析错误的是 ( )
A.镁能从硝酸银溶液中置换出银
B.镁跟硝酸银溶液反应会生成氢气
C.镁投入硝酸银溶液中只发生2AgNO3+Mg===Mg(NO3)2 +2Ag
D.根据该实验可判断镁比银化学活动性强
C
6.[2018·连云港]已知:金属X在常温下能与空气中的氧气反应,而金属Y和Z不能;将Y、Z分别投入稀盐酸中,Y溶解并产生气泡,Z无变化。下列说法正确的是 ( )
A.X氧化物的化学式只能表示为XO
B.Y能将X从它的盐溶液中置换出来
C.Z在自然界中只能以单质形式存在
D.三种金属的活动性顺序:X>Y>Z
D
金属活动性顺序
考点1 描述金属与酸、金属与盐反应的条件(a)
1.金属与酸的反应
(1)镁、铝、锌等可以与盐酸和稀硫酸反应,放出大量的热,同时产生________。反应的化学方程式如下:
Mg+2HCl===MgCl2+H2 ↑
2Al+6HCl===2AlCl3+3H2 ↑
Zn+2HCl===ZnCl2+H2 ↑
Mg+H2SO4===MgSO4+H2 ↑
2Al+3H2SO4===Al2(SO4)3+3H2↑
Zn+H2SO4===ZnSO4+H2 ↑
氢气
(2)因为锌和稀硫酸反应速度适中,所以实验室常用锌和稀硫酸反应来制取氢气。
(3)并不是所有的金属都可以与酸反应,铜一般不与盐酸和稀硫酸反应。
2.金属与盐溶液的反应
(1)不同的金属与盐溶液反应时,____________的金属先与盐反应。
(2)同一金属与溶液中不同的盐反应时,该金属先与活动性较弱的金属的盐溶液反应。
活动性强
(3)K、Ca、Na三种金属活动性太强,在与盐溶液反应时,先与水反应,生成的碱再与盐反应,因此置换反应一般不用K、Ca、Na。如把Na 放入CuSO4溶液中,会发生如下反应:2Na+2H2O===2NaOH+H2↑;2NaOH+CuSO4===Na2SO4+Cu(OH)2↓。
考点2 说出金属活动性顺序表(a)
金属活动性顺序:
考点3 会比较金属的活动性顺序(b)
考点4 能用金属活动性顺序说明某些现象和实际应用(b)
一种活动性较强的金属能把另一种活动性较弱的金属从它的盐的水溶液中置换出来,排在氢前面的金属可以把酸里的氢置换出来。
金属与酸反应
等质量金属跟足量酸反应,放出氢气由多到少的顺序:Al>Mg>Fe>Zn。
记忆卡片
类型一 理解金属活动性顺序
典例 [贺州中考]金属在日常生活中有着广泛的用途,常见金属的活动性顺序如下:
请回答下面问题:
(1)金属活动性顺序表中的X是_______元素。
Hg
(2)把一根用砂纸打磨过的铝丝浸入硫酸铜溶液中,过了一会儿,观察到的现象有_____________________________________ __,该反应的化学方程式为______________________________ __。
(3)向一定质量 的AgNO3和Cu(NO3)2混合溶
液中加入过量的Zn粉,溶液质量随反应时
间的变化情况如图所示,图中B点溶液中含
有的溶质有_______________________。
铝丝上附着红色固体,溶液的蓝色变浅
2Al+3CuSO4===3Cu+Al2(SO4)3
Cu(NO3)2、Zn(NO3)2
【解析】 (3)金属活动性顺序:Zn>Cu>Ag,向一定质量的AgNO3和Cu(NO3)2混合溶液中加入Zn粉,与两种溶质会依次发生反应:
Zn+2AgNO3===Zn(NO3)2+2Ag
65 216
所以析出银的过程是溶液质量减少的过程;
Zn+Cu(NO3)2===Zn(NO3)2+Cu
65 64
所以析出铜的过程是溶液质量增加的过程。B点时AgNO3恰好完全反应,还没有与Cu(NO3)2反应,此时溶液中含有Cu(NO3)2、Zn(NO3)2。
跟踪训练 [2017·吉林模拟]学习了金属活动性顺序后,某同学做了以下实验:
(1)探究Fe、Cu、Ag三种金属的活动性顺序:
①她设计了四个方案,其中你认为不可行的是______。
A.Fe、Ag、CuSO4溶液
B.Fe、Cu、AgNO3溶液、稀盐酸
C.Cu、FeCl2溶液、AgNO3溶液
D.Cu、Ag、Fe、稀盐酸
②写出上述C方案中发生反应的化学方程式:______________ ____________________。
D
Cu+2AgNO3
===Cu(NO3)2+2Ag
(2)将铁粉加入盛有ZnSO4和CuSO4混合溶液的烧杯中,充分反应后过滤,在滤渣中滴入稀盐酸,有气泡产生。据此判断,滤渣中含有__________;滤液中的溶质是________________(写化学式);滴加盐酸时反应的化学方程式为____________________ ______。
【点悟】 验证某三种金属的金属活动性顺序,可以用三种金属中金属活动性最强和最弱的两种金属和金属活动性居于中间的金属的盐溶液反应,也可以用活动性前后金属的盐溶液和中间的金属反应。
铜、铁
ZnSO4、FeSO4
Fe+2HCl===FeCl2+
H2↑
类型二 理解金属的化学性质
典例 [潍坊中考改编]金属在日常生活、工农业生产和科学研究方面应用广泛。某实验小组为了探究影响金属与酸反应快慢的因素,进行如表实验:
实验序号 实验过程 实验现象
1 镁粉和铁粉分别与5%盐酸反应 镁粉参与的反应产生气体快
2 铁粉和铁片分别与15%盐酸反应 铁粉参与的反应产生气体快
3 铁片分别与5%盐酸和15%盐酸反应 15%盐酸参与的反应产生气体快
(1)由此得出影响金属与酸反应快慢的因素有:
①______________________________________。
②______________________________________________。
③____________________________________。
(2)小明将一包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到滤渣和滤液。
①锌和硝酸银溶液反应的化学方程式是__________________ ________________。
②若滤液为蓝色,则滤液中一定含有的金属离子是__________ _______(写离子符号)。
金属的活动性;活动性越强,反应越快
金属与酸的接触面积;接触面积越大,反应越快
酸的浓度;酸的浓度越大,反应越快
Zn+2AgNO3===
Zn(NO3)2+2Ag
Zn2+、
Cu2+
跟踪训练 [2016·金华]有A、B两种金属放入等质量分数的稀硫酸中,生成氢气的质量与反应时间的关系如图所示,下列结论合理的是 ( )
A.金属活动性A>B
B.生成氢气的质量A>B
C.反应的硫酸质量A<B
D.反应的金属质量A<B
【解析】 由图可知,相同时间内B放出氢气的质量大于A,可判断金属活动性顺序是B>A;金属与酸反应生成氢气时,氢气来源于酸中的氢元素,所以消耗硫酸的质量A>B;金属的相对原子质量不确定,所以不能确定参加反应的金属质量。
B
【点悟】 活动性越强的金属与酸反应越剧烈,即反应放出氢气的速度越快;化合价变化相同的等质量金属完全反应放出氢气的质量与金属的相对原子质量成反比。
对验证金属活动性的方法理解不清致错
典例 某同学设计了以下三个实验,要证明Cu、Zn、Ag的活动性顺序,必须要做的实验是 ( )
A.①② B.②③
C.①③ D.①②③
【错解】选D
【析错】没有掌握验证金属的活动性顺序的方法。①铜丝能与硝酸银溶液反应置换出银,说明了金属活动性铜>银;②锌能与硫酸铜溶液反应置换出铜,说明了金属活动性锌>铜;由①②即可证明铜、锌、银的金属活动性顺序为锌>铜>银。
【正解】选A
跟踪训练 [岳阳中考]在已经调平的托盘天平两边各放一只等质量的烧杯,向烧杯中各加入质量相等、溶质质量分数相同的稀硫酸,然后在左边烧杯中放入一定质量的镁,在右边的烧杯中放入与镁等质量的铝。待充分反应后,下列分析错误的是
( )
A.天平保持平衡,左边烧杯中,酸没有剩余,镁可能有剩余
B.天平保持平衡,右边烧杯中,酸没有剩余,铝一定有剩余
C.天平失去平衡,左边烧杯中,酸一定剩余,镁一定没剩余
D.天平失去平衡,右边烧杯中,酸可能剩余,铝一定没剩余
D
【解析】 根据化学方程式可得:
Mg+H2SO4===MgSO4+H2↑
24 98 2
2Al+3H2SO4===Al2(SO4)3+3H2↑
54 294 6
18 98 2
天平保持平衡,则左右两边生成的氢气质量相同,镁可能恰好完全反应,铝一定有剩余;天平失去平衡,则两边生成氢气质量不同,镁一定完全反应,左边烧杯酸有剩余,右边烧杯中情况有3种可能:酸没有剩余,铝有剩余;或铝没有剩余,酸有剩余;或酸与铝恰好完全反应,均没有剩余。
比较铁与铜、铜与银的化学活动性
1.教材实验原理图
2.实验结论
金属活动性:铁>铜>银。
3.实验关键点
(1)在做铁置换反应时要除锈,防止干扰实验。
(2)将铜丝放在硝酸银溶液中,铜丝表面会有黑色固体而不是银白色固体,这种现象和硝酸银溶液的浓度有关,浓度较低,析出的固体呈黑色。
(3)实验设计技巧
中间金属两头盐―→FeSO4溶液、Cu、AgNO3溶液
两头金属中间盐―→Fe、CuSO4溶液、Ag
必要时请酸帮忙―→Fe、HCl、Cu、AgNO3溶液
典例 [2017·宁波鄞州区模拟改编]根据如图三个科学实验,回答问题:
(1)描述实验甲中的实验现象:__________________________ __________________。
(2)乙中发生反应的化学方程式为________________________ _____。
铜丝表面附着一层银白色固
体,溶液变为蓝色
Zn+CuSO4===ZnSO4+
Cu
(3)在实验丙后的剩余溶液中,一定有的溶质是__________,可能有的溶质是__________,为了确定可能有的溶质,可加入______。
A.氯化钡溶液 B.氢氧化铜
C.氯化钠溶液 D.锌粒
ZnSO4
H2SO4
BD
同课章节目录
