浙江省中考科学(化学部分)第二篇主题1第五单元常见的化合物(1)(课件 38张ppt)
文档属性
| 名称 | 浙江省中考科学(化学部分)第二篇主题1第五单元常见的化合物(1)(课件 38张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-03-10 11:29:01 | ||
图片预览










文档简介
第五单元 常见的化合物(1)
1.[2017·衢州]物质分类是重要的学习内容,下列物质属于氧化物的是 ( )
A.O2 B.NaCl
C.Fe2O3 D.C2H5OH
C
2.[2018·杭州]小金在做硫燃烧实验时,进行了如下操作:①在铺有细沙的燃烧匙里放入少量硫;②将燃烧匙在酒精灯火焰上加热,直至硫燃烧;③将燃烧匙伸入盛有氧气的集气瓶中(集气瓶内盛有滴加紫色石蕊试液的少量水)。实验中可观察到的现象与结论不符合的是 ( )
A.对比①和②可说明硫燃烧需要达到一定的温度
B.对比②和③中硫的燃烧现象说明氧气具有助燃性
C.在③中观察到紫色石蕊试液变红,说明硫燃烧是化学变 化
D.在③中观察到紫色石蕊试液变红,说明硫燃烧产物是一 种酸
D
3.[衡阳中考]下列实验现象描述正确的是 ( )
A.点燃一氧化碳气体时,发出蓝色火焰
B.硫在空气中燃烧,发出蓝紫色火焰,生成无色无味的气 体
C.细铁丝在氧气中剧烈燃烧,火星四射,生成四氧化三铁
D.硝酸铵固体溶解过程中,溶液的温度升高
A
A
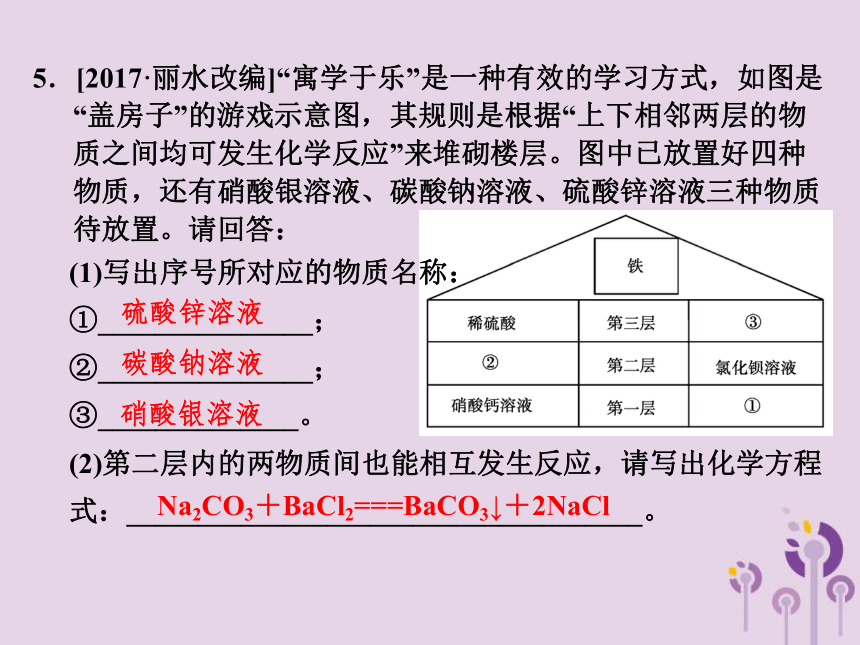
(1)写出序号所对应的物质名称:
①_______________;
②_______________;
③______________。
(2)第二层内的两物质间也能相互发生反应,请写出化学方程式:____________________________________。
5.[2017·丽水改编]“寓学于乐”是一种有效的学习方式,如图是“盖房子”的游戏示意图,其规则是根据“上下相邻两层的物质之间均可发生化学反应”来堆砌楼层。图中已放置好四种物质,还有硝酸银溶液、碳酸钠溶液、硫酸锌溶液三种物质待放置。请回答:
硫酸锌溶液
碳酸钠溶液
硝酸银溶液
Na2CO3+BaCl2===BaCO3↓+2NaCl
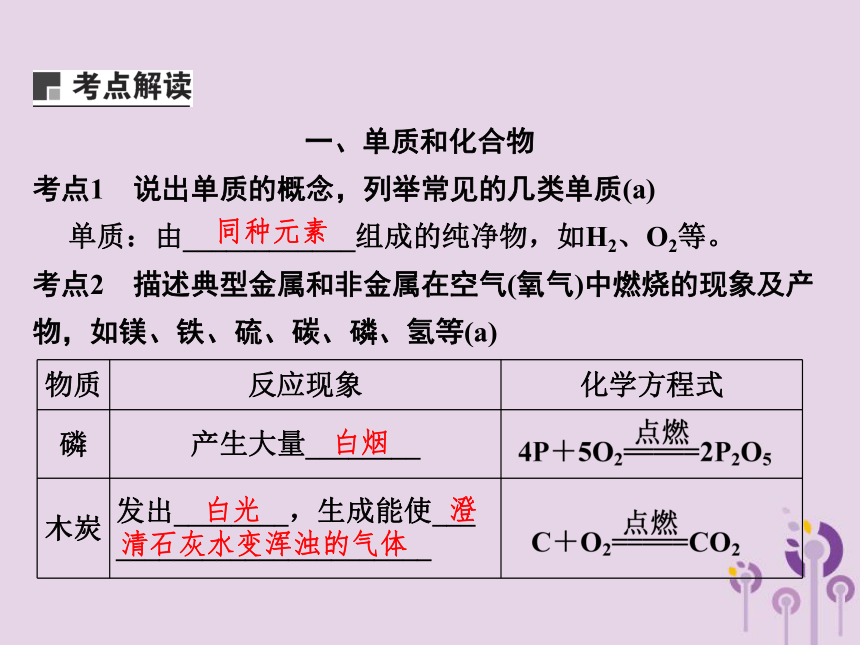
一、单质和化合物
考点1 说出单质的概念,列举常见的几类单质(a)
单质:由____________组成的纯净物,如H2、O2等。
考点2 描述典型金属和非金属在空气(氧气)中燃烧的现象及产
物,如镁、铁、硫、碳、磷、氢等(a)
同种元素
白烟
白光
澄
清石灰水变浑浊的气体
物质 反应现象 化学方程式
磷 产生大量________
木炭 发出________,生成能使___ ______________________
淡蓝色
蓝紫色
刺激
性
淡蓝色
火星四射
黑色
耀眼的白光
考点3 说出化合物的概念,列举常见的几类化合物(a)
1.化合物:由______________组成的纯净物,如CO2、KMnO4等。
2.化合物根据组成元素的不同可分为无机化合物和有机化合物。无机化合物包括酸、碱、盐和氧化物,如HCl、NaOH、NaCl、CO2等。
氧化物:由两种元素组成,其中一种是__________的化合物,如H2O、CO2等。
不同种元素
氧元素
考点5 说出常见的氧化物的主要性质,如二氧化碳、一氧化
碳、氧化钙、氧化铁、水、二氧化硅、二氧化硫等(a)
常见氧化物 主要性质
二氧化碳 常温下是一种无色无味的气体且无毒;密度比空气大,能溶于水并生成碳酸
一氧化碳 常温下是一种无色无味的气体但有毒;不易溶于水
氧化钙 白色粉末状固体,易从空气中吸收二氧化碳及水分,反应放出大量的热
氧化铁 红棕色固体,能溶于盐酸
水 常温常压下为无色无味的透明液体,常作溶剂
二氧化硅 化学性质较稳定,不溶于水也不与水反应;是酸性氧化物,一般不跟酸反应
二氧化硫 常温下是一种无色气体,有强烈刺激性气味;大气主要污染物之一;溶于水形成亚硫酸
二、重要的盐
考点1 说出盐的含义及主要化学性质(a)
2.盐的性质
(1)金属与盐溶液反应生成另一种金属和另一种盐。例:Fe+CuSO4===Cu+FeSO4
反应条件:参加反应的金属比盐中金属________(除钾、钙、钠外)。
(2)酸和盐反应生成另一种______和另一种______。
例:BaCl2+H2SO4===BaSO4↓+2HCl
酸根离子
化合物
中和
活泼
酸
盐
(3)盐和另一种盐反应生成另外____________。
例:Na2SO4+BaCl2===BaSO4↓+2NaCl
(4)碱和盐反应生成另一种______和另一种______。
例:2NaOH+CuSO4===Na2SO4+Cu(OH)2↓
【注意】 (3)(4)的反应要求:反应物都必须可溶,生成物中至少有一种是沉淀。
【考点延伸】
一般来说,钾盐、钠盐、铵盐、硝酸盐都________;而大多数碳酸盐都________,盐酸盐除AgCl不溶,硫酸盐除BaSO4不溶,其余均可溶。(注:Ag2SO4、CaSO4微溶)
两种新盐
碱
盐
可溶
不溶
考点2 概说食盐、纯碱、碳酸钙的主要性质及用途(b)
食盐
AgCl↓+NaNO3
碱性
2NaCl+ CO2↑
+H2O
概述 化学性质 用途
氯化钠 无色透明的晶体,俗称______ __,溶解度受温度影响不大 AgNO3+NaCl=== _________________ 供食用和腌制食品,制取盐酸和氯气、烧碱等的原料
碳酸钠 白色粉末,水溶液呈________,因而俗名纯碱,又称苏打。碳酸钠晶体的化学式为Na2CO3·10H2O Na2CO3+2HCl ===______________________ 玻璃、造纸、纺织品、洗涤剂等工业生产
CaO+CO2↑
碳酸钙 难溶的白色固体,是大理石、石灰石的主要成分
CaCO3+H2O+CO2===
Ca(HCO3)2 制石灰、水泥,作建筑材料或白色涂料等
考点3 知道一些常见盐的检验方法(a)
1. Cl-的检验:加入_______________,有白色沉淀生成,再加___________沉淀不溶解,证明样品中含Cl-。
例:AgNO3+HCl===AgCl↓+HNO3
AgNO3溶液
稀HNO3
Ba(NO3)2溶液
稀HNO3
稀盐酸
澄清石灰水中,澄清石灰水变浑浊
类型一 单质燃烧的现象
典例 [2016·嘉兴舟山]如图所示是铁丝在氧气中燃烧的改进实验,用适量双氧水和二氧化锰代替原实验中集气瓶里的水。
(1)用双氧水和二氧化锰代替原集气瓶里的水,其优点除了使实验更简便外,还有__________________________________ ____________。
双氧水可以提供充足的氧气,让铁丝
燃烧更持久
(2)实验中可观察到铁丝燃烧的现象是________ ______________,并放出大量热,生成一种黑色固体,请写出该反应的化学方程式:_______________________。
剧烈燃
烧,火星四射
跟踪训练 [2017·湘潭改编]下列对实验现象的描述,错误的是 ( )
A.镁条在空气中剧烈燃烧,发出耀眼白光,生成一种白色固体
B.硫在氧气中燃烧产生明亮的蓝紫色火焰,生成无色有刺激性气味的气体
C.纯净的氢气在空气中燃烧时,将涂有澄清石灰水的小烧杯罩在火焰上方,澄清石灰水变浑浊
D.红磷在氧气中剧烈燃烧,发出白光,生成大量的白烟
C
类型二 盐的化学性质
典例 [2017·河南] 如图表示向一定量CaCl2和盐酸
的混合溶液中滴加Na2CO3溶液的变化过程,
x表示Na2CO3溶液的质量,则y可能表示( )
A.气体的体积 B.沉淀的质量
C.NaCl的质量 D.混合溶液的pH
D
CaCO3+
2HCl
===CaCl2+CO2↑+H2O
【进行实验】小明和小红在各自的实验中均看到广口瓶中产生气泡,小明还看到玻璃片上澄清石灰水变浑浊,而小红却未看到,他们很是好奇,于是进一步进行探究。
【提出问题】小红的实验中,玻璃片上澄清石灰水为什么不变浑浊呢?
【作出猜想】小红猜想:可能鸡蛋壳中含有铁等较活泼金属,而不含CO;
小明猜想:可能小红实验所用盐酸中溶质质量分数过大,挥发出HCl气体。
依据所学科学知识和生活常识,你认为________的猜想是不合理的。
小红
【实验验证】小红分别取适量等体积的自己实验中所用的盐酸a和小明实验中所用的盐酸b于两支试管中,试管内各盛有同一鸡蛋壳的碎片,塞上带导管的橡胶塞,并分别将导管伸入AgNO3溶液中,实验过程如图乙所示:
实验中,①、②试管内均有气泡产生,同时①试管中有白色沉淀生成而②中没有,白色沉淀的化学式是_________。
AgCl
大于
【反思应用】(1)实验室制备CO2时,最好选择______(选填“浓”或“稀”)盐酸。
(2)实验中发现,与相同溶质质量分数的盐酸反应时,鸡蛋壳碎片比大块鸡蛋壳更剧烈,说明增大反应物_____________可以加快反应速率。
稀
接触面积
类型三 粒子或物质的共存问题
典例 [2017·肥城三模]如图所示,某河旁
甲、乙、丙、丁四座化工厂排放的工
业废水中分别含有碳酸钠、氯化铜、
氢氧化钠、盐酸中的一种。某同学对
①、②、③、④处水质监测时记录了
以下现象。根据现象推断甲、乙、丙、
丁四座化工厂排放工业废水的成分,
错误的是 ( )
A
A.甲:碳酸钠 B.乙:氯化铜 C.丙:盐酸 D.丁:碳酸钠
① ② ③ ④
记录现象 无色溶液 蓝色浑浊 浑浊消失 产生气泡
跟踪训练 某物质的溶液中加入氯化钡溶液,产生了不溶于稀硝酸的白色沉淀,下列说法中正确的是 ( )
A.原溶液中一定含有Ag+
D
类型四 物质的推断与鉴别
典例 [郴州中考]有一包白色的粉末,可能含有(NH4)2SO4、NaCl、BaCl2、Na2CO3、Na2SO4中的一种或几种,为确定该白色粉末的成分,进行如下探究:
(1)取适量白色粉末与熟石灰混匀、共热,没有任何异味产生,说明原白色粉末一定不存在____________,其理由是__________________________________________________ __。
(2)另取适量白色粉末加入足量的水,搅拌,得到白色沉淀和无色溶液,可推测原白色粉末中一定含有_________。
(NH4)2SO4
(NH4)2SO4会与熟石灰反应,生成有刺激性气味的气体
BaCl2
(3)取(2)中的白色沉淀,往其中加入过量的稀盐酸,产生大量的气泡,白色沉淀全部消失,说明原白色粉末中一定还含有___________,一定不含有___________,写出产生白色沉淀的化学方程式:_____________________________________。
(4)取(2)中的无色溶液蒸干,得固体物质,此固体物质的成分可能有_____种组成情况。
Na2CO3
Na2SO4
BaCl2+Na2CO3===BaCO3↓+2NaCl
3
跟踪训练 [2017·绍兴义乌]有某白色粉末,可能含有硫酸钠、硫酸铜、氯化钠、硝酸钡、碳酸钙中的一种或几种。某科学兴趣小组为探究其成分,设计了如下实验流程(所加试剂均足量)。
(1)操作Ⅰ、Ⅱ的名称是________。
(2)无色气体的质量是_______g。
(3)固体甲的成分是__________________。
(4)这种白色粉末中一定不含有___________。
(5)求白色粉末中肯定含有的物质总质量。
过滤
2.2
碳酸钙与硫酸钡
硫酸铜
设参加操作Ⅱ反应的硫酸钠质量为y,则
Na2SO4+Ba(NO3)2===BaSO4↓+2NaNO3
142 233
y 4.66g
盐溶液中实质反应离子分析有误致错
典例 [杭州中考] 一定质量的氢氧化钡溶液
中逐渐加入碳酸钠粉末(不考虑溶液体
积变化),直至过量。如图横坐标表示
加入碳酸钠粉末的质量,根据图像判断,
纵坐标可能表示 ( )
A.生成沉淀的质量 B.溶液中溶剂的质量
C.溶液中溶质的质量 D.溶液的pH
【错解】选D
【析错】受酸碱反应时pH变化图像的影响,同时对于反应的实质没有真正的理解,不清楚pH变化的真正原因。pH的变化是因为溶液中的氢离子或氢氧根离子发生变化,而在这个反应中,实质是钡离子与碳酸根离子生成碳酸钡沉淀,而氢氧根离子并没有参加反应。
【正解】选C 一定质量的氢氧化钡溶液中逐渐加入碳酸钠粉末直至过量,根据化学反应物质之间的质量比可以知道,生成的氢氧化钠的质量小于溶液中氢氧化钡的质量,所以溶液中的溶质质量先减小;当一定质量的氢氧化钡溶液反应完全,碳酸钠粉末过量,所以溶质质量变大。
跟踪训练 [2016·杭州余杭区模拟]有一包
白色固体,可能含有Na2SO4、Na2CO3、
Ba(NO3)2、NaCl中的一种或几种。现进行
如下实验:
(1)取样溶于水,有白色沉淀产生(假设该
步骤中的反应均恰好完全反应)。
(2)振荡后,在悬浊液中逐滴滴加盐酸,产生的沉淀质量与加入盐酸体积的关系如图所示。分析白色固体肯定存在的物质:_____________________________,可能含有的物质:_________。为了证明原混合物中可能存在的物质是否存在,可进行如下实验:
Na2SO4、Na2CO3、Ba(NO3)2
NaCl
①取原白色固体溶于足量水,搅拌,使其充分反应(假设该步骤中的反应恰好完全反应);
②________(填写一种混合物分离的物理方法);
③取第②步所得的溶液,滴加_______________;
④根据现象得出结论:若有_____________现象产生,就可确定该物质存在。
过滤
硝酸银溶液
白色沉淀
盐的性质
1.实验原理
复分解反应的原理
2.实验结论
盐可以和酸、盐发生反应。
3.实验关键点
他们发生反应的实质是___________________________及______ ___________________。
(2)混合离子的检验
物质鉴别的原则
①操作简便:能用物理方法鉴别的不用化学方法;能用一种试剂鉴别的不用多种试剂。
②现象明显:使待检物质的现象对比度较大。
钡离子和硫酸根离子反应
银离
子和氯离子的反应
特征离子关系图:
典例 [2017·天津和平区一模]从盐酸、CuSO4溶液、NaOH溶液、Na2CO3溶液、Na2SO4溶液和Ca(NO3)2溶液六种溶液中任取出两种(分别编号为a和b)混合,得到无色澄清溶液,无其他明显现象,测得混合溶液pH=1。仅根据上述现象和数据,对a、b作出以下推断,其中不正确的是 ( )
A.肯定有一种是盐酸,另一种可能是NaOH溶液
B.符合上述实验现象的a、b组合可能不止一种
C.a、b都不可能是CuSO4溶液、Na2CO3溶液
D.a、b都不可能是CuSO4溶液、Na2CO3溶液、NaOH溶液
D
【解析】 a、b混合,得到无色澄清溶液,说明不可能含有CuSO4;测得混合后溶液pH=1,说明显强酸性,即一定含有盐酸,并且盐酸有剩余;无其他明显现象,说明不出现沉淀或产生气体,所以一定不存在碳酸钠。因此只能得出如下结论:一定含有盐酸,一定不含有CuSO4和Na2CO3。
1.[2017·衢州]物质分类是重要的学习内容,下列物质属于氧化物的是 ( )
A.O2 B.NaCl
C.Fe2O3 D.C2H5OH
C
2.[2018·杭州]小金在做硫燃烧实验时,进行了如下操作:①在铺有细沙的燃烧匙里放入少量硫;②将燃烧匙在酒精灯火焰上加热,直至硫燃烧;③将燃烧匙伸入盛有氧气的集气瓶中(集气瓶内盛有滴加紫色石蕊试液的少量水)。实验中可观察到的现象与结论不符合的是 ( )
A.对比①和②可说明硫燃烧需要达到一定的温度
B.对比②和③中硫的燃烧现象说明氧气具有助燃性
C.在③中观察到紫色石蕊试液变红,说明硫燃烧是化学变 化
D.在③中观察到紫色石蕊试液变红,说明硫燃烧产物是一 种酸
D
3.[衡阳中考]下列实验现象描述正确的是 ( )
A.点燃一氧化碳气体时,发出蓝色火焰
B.硫在空气中燃烧,发出蓝紫色火焰,生成无色无味的气 体
C.细铁丝在氧气中剧烈燃烧,火星四射,生成四氧化三铁
D.硝酸铵固体溶解过程中,溶液的温度升高
A
A
(1)写出序号所对应的物质名称:
①_______________;
②_______________;
③______________。
(2)第二层内的两物质间也能相互发生反应,请写出化学方程式:____________________________________。
5.[2017·丽水改编]“寓学于乐”是一种有效的学习方式,如图是“盖房子”的游戏示意图,其规则是根据“上下相邻两层的物质之间均可发生化学反应”来堆砌楼层。图中已放置好四种物质,还有硝酸银溶液、碳酸钠溶液、硫酸锌溶液三种物质待放置。请回答:
硫酸锌溶液
碳酸钠溶液
硝酸银溶液
Na2CO3+BaCl2===BaCO3↓+2NaCl
一、单质和化合物
考点1 说出单质的概念,列举常见的几类单质(a)
单质:由____________组成的纯净物,如H2、O2等。
考点2 描述典型金属和非金属在空气(氧气)中燃烧的现象及产
物,如镁、铁、硫、碳、磷、氢等(a)
同种元素
白烟
白光
澄
清石灰水变浑浊的气体
物质 反应现象 化学方程式
磷 产生大量________
木炭 发出________,生成能使___ ______________________
淡蓝色
蓝紫色
刺激
性
淡蓝色
火星四射
黑色
耀眼的白光
考点3 说出化合物的概念,列举常见的几类化合物(a)
1.化合物:由______________组成的纯净物,如CO2、KMnO4等。
2.化合物根据组成元素的不同可分为无机化合物和有机化合物。无机化合物包括酸、碱、盐和氧化物,如HCl、NaOH、NaCl、CO2等。
氧化物:由两种元素组成,其中一种是__________的化合物,如H2O、CO2等。
不同种元素
氧元素
考点5 说出常见的氧化物的主要性质,如二氧化碳、一氧化
碳、氧化钙、氧化铁、水、二氧化硅、二氧化硫等(a)
常见氧化物 主要性质
二氧化碳 常温下是一种无色无味的气体且无毒;密度比空气大,能溶于水并生成碳酸
一氧化碳 常温下是一种无色无味的气体但有毒;不易溶于水
氧化钙 白色粉末状固体,易从空气中吸收二氧化碳及水分,反应放出大量的热
氧化铁 红棕色固体,能溶于盐酸
水 常温常压下为无色无味的透明液体,常作溶剂
二氧化硅 化学性质较稳定,不溶于水也不与水反应;是酸性氧化物,一般不跟酸反应
二氧化硫 常温下是一种无色气体,有强烈刺激性气味;大气主要污染物之一;溶于水形成亚硫酸
二、重要的盐
考点1 说出盐的含义及主要化学性质(a)
2.盐的性质
(1)金属与盐溶液反应生成另一种金属和另一种盐。例:Fe+CuSO4===Cu+FeSO4
反应条件:参加反应的金属比盐中金属________(除钾、钙、钠外)。
(2)酸和盐反应生成另一种______和另一种______。
例:BaCl2+H2SO4===BaSO4↓+2HCl
酸根离子
化合物
中和
活泼
酸
盐
(3)盐和另一种盐反应生成另外____________。
例:Na2SO4+BaCl2===BaSO4↓+2NaCl
(4)碱和盐反应生成另一种______和另一种______。
例:2NaOH+CuSO4===Na2SO4+Cu(OH)2↓
【注意】 (3)(4)的反应要求:反应物都必须可溶,生成物中至少有一种是沉淀。
【考点延伸】
一般来说,钾盐、钠盐、铵盐、硝酸盐都________;而大多数碳酸盐都________,盐酸盐除AgCl不溶,硫酸盐除BaSO4不溶,其余均可溶。(注:Ag2SO4、CaSO4微溶)
两种新盐
碱
盐
可溶
不溶
考点2 概说食盐、纯碱、碳酸钙的主要性质及用途(b)
食盐
AgCl↓+NaNO3
碱性
2NaCl+ CO2↑
+H2O
概述 化学性质 用途
氯化钠 无色透明的晶体,俗称______ __,溶解度受温度影响不大 AgNO3+NaCl=== _________________ 供食用和腌制食品,制取盐酸和氯气、烧碱等的原料
碳酸钠 白色粉末,水溶液呈________,因而俗名纯碱,又称苏打。碳酸钠晶体的化学式为Na2CO3·10H2O Na2CO3+2HCl ===______________________ 玻璃、造纸、纺织品、洗涤剂等工业生产
CaO+CO2↑
碳酸钙 难溶的白色固体,是大理石、石灰石的主要成分
CaCO3+H2O+CO2===
Ca(HCO3)2 制石灰、水泥,作建筑材料或白色涂料等
考点3 知道一些常见盐的检验方法(a)
1. Cl-的检验:加入_______________,有白色沉淀生成,再加___________沉淀不溶解,证明样品中含Cl-。
例:AgNO3+HCl===AgCl↓+HNO3
AgNO3溶液
稀HNO3
Ba(NO3)2溶液
稀HNO3
稀盐酸
澄清石灰水中,澄清石灰水变浑浊
类型一 单质燃烧的现象
典例 [2016·嘉兴舟山]如图所示是铁丝在氧气中燃烧的改进实验,用适量双氧水和二氧化锰代替原实验中集气瓶里的水。
(1)用双氧水和二氧化锰代替原集气瓶里的水,其优点除了使实验更简便外,还有__________________________________ ____________。
双氧水可以提供充足的氧气,让铁丝
燃烧更持久
(2)实验中可观察到铁丝燃烧的现象是________ ______________,并放出大量热,生成一种黑色固体,请写出该反应的化学方程式:_______________________。
剧烈燃
烧,火星四射
跟踪训练 [2017·湘潭改编]下列对实验现象的描述,错误的是 ( )
A.镁条在空气中剧烈燃烧,发出耀眼白光,生成一种白色固体
B.硫在氧气中燃烧产生明亮的蓝紫色火焰,生成无色有刺激性气味的气体
C.纯净的氢气在空气中燃烧时,将涂有澄清石灰水的小烧杯罩在火焰上方,澄清石灰水变浑浊
D.红磷在氧气中剧烈燃烧,发出白光,生成大量的白烟
C
类型二 盐的化学性质
典例 [2017·河南] 如图表示向一定量CaCl2和盐酸
的混合溶液中滴加Na2CO3溶液的变化过程,
x表示Na2CO3溶液的质量,则y可能表示( )
A.气体的体积 B.沉淀的质量
C.NaCl的质量 D.混合溶液的pH
D
CaCO3+
2HCl
===CaCl2+CO2↑+H2O
【进行实验】小明和小红在各自的实验中均看到广口瓶中产生气泡,小明还看到玻璃片上澄清石灰水变浑浊,而小红却未看到,他们很是好奇,于是进一步进行探究。
【提出问题】小红的实验中,玻璃片上澄清石灰水为什么不变浑浊呢?
【作出猜想】小红猜想:可能鸡蛋壳中含有铁等较活泼金属,而不含CO;
小明猜想:可能小红实验所用盐酸中溶质质量分数过大,挥发出HCl气体。
依据所学科学知识和生活常识,你认为________的猜想是不合理的。
小红
【实验验证】小红分别取适量等体积的自己实验中所用的盐酸a和小明实验中所用的盐酸b于两支试管中,试管内各盛有同一鸡蛋壳的碎片,塞上带导管的橡胶塞,并分别将导管伸入AgNO3溶液中,实验过程如图乙所示:
实验中,①、②试管内均有气泡产生,同时①试管中有白色沉淀生成而②中没有,白色沉淀的化学式是_________。
AgCl
大于
【反思应用】(1)实验室制备CO2时,最好选择______(选填“浓”或“稀”)盐酸。
(2)实验中发现,与相同溶质质量分数的盐酸反应时,鸡蛋壳碎片比大块鸡蛋壳更剧烈,说明增大反应物_____________可以加快反应速率。
稀
接触面积
类型三 粒子或物质的共存问题
典例 [2017·肥城三模]如图所示,某河旁
甲、乙、丙、丁四座化工厂排放的工
业废水中分别含有碳酸钠、氯化铜、
氢氧化钠、盐酸中的一种。某同学对
①、②、③、④处水质监测时记录了
以下现象。根据现象推断甲、乙、丙、
丁四座化工厂排放工业废水的成分,
错误的是 ( )
A
A.甲:碳酸钠 B.乙:氯化铜 C.丙:盐酸 D.丁:碳酸钠
① ② ③ ④
记录现象 无色溶液 蓝色浑浊 浑浊消失 产生气泡
跟踪训练 某物质的溶液中加入氯化钡溶液,产生了不溶于稀硝酸的白色沉淀,下列说法中正确的是 ( )
A.原溶液中一定含有Ag+
D
类型四 物质的推断与鉴别
典例 [郴州中考]有一包白色的粉末,可能含有(NH4)2SO4、NaCl、BaCl2、Na2CO3、Na2SO4中的一种或几种,为确定该白色粉末的成分,进行如下探究:
(1)取适量白色粉末与熟石灰混匀、共热,没有任何异味产生,说明原白色粉末一定不存在____________,其理由是__________________________________________________ __。
(2)另取适量白色粉末加入足量的水,搅拌,得到白色沉淀和无色溶液,可推测原白色粉末中一定含有_________。
(NH4)2SO4
(NH4)2SO4会与熟石灰反应,生成有刺激性气味的气体
BaCl2
(3)取(2)中的白色沉淀,往其中加入过量的稀盐酸,产生大量的气泡,白色沉淀全部消失,说明原白色粉末中一定还含有___________,一定不含有___________,写出产生白色沉淀的化学方程式:_____________________________________。
(4)取(2)中的无色溶液蒸干,得固体物质,此固体物质的成分可能有_____种组成情况。
Na2CO3
Na2SO4
BaCl2+Na2CO3===BaCO3↓+2NaCl
3
跟踪训练 [2017·绍兴义乌]有某白色粉末,可能含有硫酸钠、硫酸铜、氯化钠、硝酸钡、碳酸钙中的一种或几种。某科学兴趣小组为探究其成分,设计了如下实验流程(所加试剂均足量)。
(1)操作Ⅰ、Ⅱ的名称是________。
(2)无色气体的质量是_______g。
(3)固体甲的成分是__________________。
(4)这种白色粉末中一定不含有___________。
(5)求白色粉末中肯定含有的物质总质量。
过滤
2.2
碳酸钙与硫酸钡
硫酸铜
设参加操作Ⅱ反应的硫酸钠质量为y,则
Na2SO4+Ba(NO3)2===BaSO4↓+2NaNO3
142 233
y 4.66g
盐溶液中实质反应离子分析有误致错
典例 [杭州中考] 一定质量的氢氧化钡溶液
中逐渐加入碳酸钠粉末(不考虑溶液体
积变化),直至过量。如图横坐标表示
加入碳酸钠粉末的质量,根据图像判断,
纵坐标可能表示 ( )
A.生成沉淀的质量 B.溶液中溶剂的质量
C.溶液中溶质的质量 D.溶液的pH
【错解】选D
【析错】受酸碱反应时pH变化图像的影响,同时对于反应的实质没有真正的理解,不清楚pH变化的真正原因。pH的变化是因为溶液中的氢离子或氢氧根离子发生变化,而在这个反应中,实质是钡离子与碳酸根离子生成碳酸钡沉淀,而氢氧根离子并没有参加反应。
【正解】选C 一定质量的氢氧化钡溶液中逐渐加入碳酸钠粉末直至过量,根据化学反应物质之间的质量比可以知道,生成的氢氧化钠的质量小于溶液中氢氧化钡的质量,所以溶液中的溶质质量先减小;当一定质量的氢氧化钡溶液反应完全,碳酸钠粉末过量,所以溶质质量变大。
跟踪训练 [2016·杭州余杭区模拟]有一包
白色固体,可能含有Na2SO4、Na2CO3、
Ba(NO3)2、NaCl中的一种或几种。现进行
如下实验:
(1)取样溶于水,有白色沉淀产生(假设该
步骤中的反应均恰好完全反应)。
(2)振荡后,在悬浊液中逐滴滴加盐酸,产生的沉淀质量与加入盐酸体积的关系如图所示。分析白色固体肯定存在的物质:_____________________________,可能含有的物质:_________。为了证明原混合物中可能存在的物质是否存在,可进行如下实验:
Na2SO4、Na2CO3、Ba(NO3)2
NaCl
①取原白色固体溶于足量水,搅拌,使其充分反应(假设该步骤中的反应恰好完全反应);
②________(填写一种混合物分离的物理方法);
③取第②步所得的溶液,滴加_______________;
④根据现象得出结论:若有_____________现象产生,就可确定该物质存在。
过滤
硝酸银溶液
白色沉淀
盐的性质
1.实验原理
复分解反应的原理
2.实验结论
盐可以和酸、盐发生反应。
3.实验关键点
他们发生反应的实质是___________________________及______ ___________________。
(2)混合离子的检验
物质鉴别的原则
①操作简便:能用物理方法鉴别的不用化学方法;能用一种试剂鉴别的不用多种试剂。
②现象明显:使待检物质的现象对比度较大。
钡离子和硫酸根离子反应
银离
子和氯离子的反应
特征离子关系图:
典例 [2017·天津和平区一模]从盐酸、CuSO4溶液、NaOH溶液、Na2CO3溶液、Na2SO4溶液和Ca(NO3)2溶液六种溶液中任取出两种(分别编号为a和b)混合,得到无色澄清溶液,无其他明显现象,测得混合溶液pH=1。仅根据上述现象和数据,对a、b作出以下推断,其中不正确的是 ( )
A.肯定有一种是盐酸,另一种可能是NaOH溶液
B.符合上述实验现象的a、b组合可能不止一种
C.a、b都不可能是CuSO4溶液、Na2CO3溶液
D.a、b都不可能是CuSO4溶液、Na2CO3溶液、NaOH溶液
D
【解析】 a、b混合,得到无色澄清溶液,说明不可能含有CuSO4;测得混合后溶液pH=1,说明显强酸性,即一定含有盐酸,并且盐酸有剩余;无其他明显现象,说明不出现沉淀或产生气体,所以一定不存在碳酸钠。因此只能得出如下结论:一定含有盐酸,一定不含有CuSO4和Na2CO3。
同课章节目录
