浙江省中考科学(化学部分)第二篇主题3第一单元常见的化学反应(2)(课件 31张ppt)
文档属性
| 名称 | 浙江省中考科学(化学部分)第二篇主题3第一单元常见的化学反应(2)(课件 31张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-03-10 11:32:21 | ||
图片预览











文档简介
第一单元 常见的化学反应(2)
1.[黄石中考]下列关于催化剂的说法正确的是 ( )
A.催化剂必定加快反应速率
B.反应前后催化剂的化学性质通常会发生改变
C.在酿造工业和制药工业,一般都要用酶作催化剂
D.用氯酸钾制取氧气时,加入催化剂可使生成氧气的质量 增加
C
A.O2 B.NaClO
C.HCl D.NaClO3
3.[2017·广安]下列变化,遵循质量守恒定律的是 ( )
A.石墨制成金刚石
B.2g H2完全燃烧生成36g H2O
C.水变成汽油
D.冰转化成干冰
D
A
A.该反应属于分解反应
B.固体减少的质量等于生成O2的质量
C.MnO2加快了反应速率
D.反应前后氧元素的化合价有变化
A.淀粉中一定含C、H两种元素
B.淀粉中一定只含C、H两种元素
C.淀粉中可能含有三种以上的元素
D.淀粉可能是一种单质或一种化合物
C
A
6.[2018·黄冈]一定质量的甲烷在不充足的氧气中燃烧,甲烷完全反应,生成物只有CO、CO2和H2O,且总质量为20.8g,其中H2O的质量为10.8g,则CO2的质量为 ( )
A.5.6g B.8.8g
C.4.4g D.4.8g
C
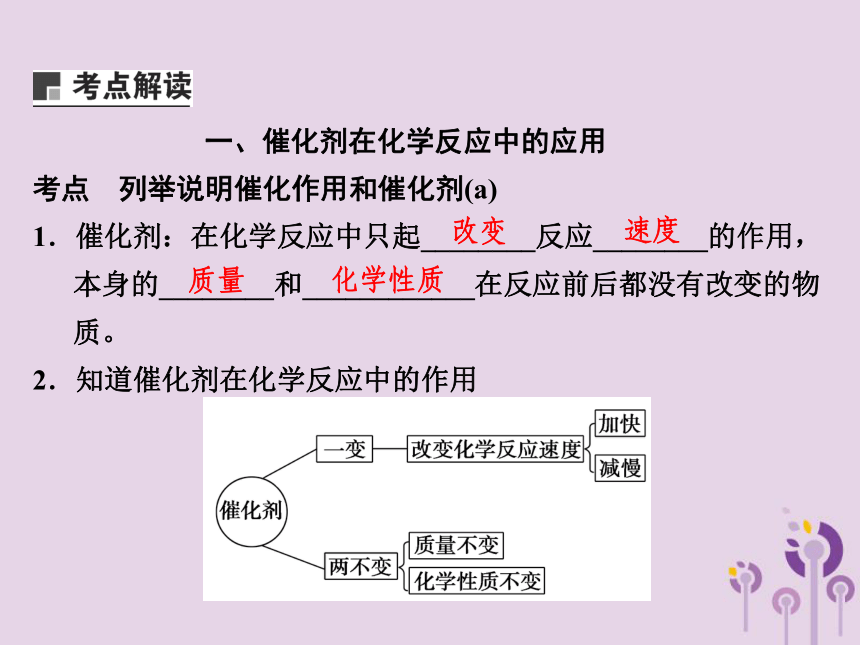
一、催化剂在化学反应中的应用
考点 列举说明催化作用和催化剂(a)
1.催化剂:在化学反应中只起________反应________的作用,本身的________和____________在反应前后都没有改变的物质。
2.知道催化剂在化学反应中的作用
改变
速度
质量
化学性质
二、质量守恒定律
内容:参加____________的各物质的________总和等于反应后生成的各物质的质量总和。
考点2 会从分子、原子的角度解释质量守恒定律(b)
实质:化学反应是反应物分子里的原子重新组合形成新物质的过程。即化学反应前后______________没有改变、______ ________没有增减、______________也没有改变,因此,化学反应前后物质的总质量守恒。
化学反应
质量
原子的种类
原子
的数目
原子的质量
考点3 用质量守恒定律分析、解释常见的现象(c)
理解质量守恒定律应抓住“五个一定不变”、“两个一定改变”及“一个可能改变”。
【注意】 ①“化学反应”是前提。质量守恒定律的适用范围是化学变化,不适用于物理变化,任何化学变化都遵循质量守恒定律。
②“参加反应”是基础。概念中明确指出是“参加反应”的各物质的质量总和,不参加反应的物质质量不能计算在内。
③“质量总和”是核心。无论是参加反应的物质,还是反应后生成的物质,计算时不能漏掉任何一项。
类型一 质量守恒定律的应用
典例 [衢州中考]以下是俄国化学家罗蒙诺索夫曾开展的实验:
①先用天平称取质量为m1的金属锡粉;
②将这些锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质,称量容器的总质量为m2;
③打开容器,听到了空气进入容器发出的“咝咝的声响”,称量所得白色物质的质量为m3;
④把白色物质放回原容器里(容器中空气的组成恢复到初始状态),重新称量容器的总质量为m4。
(1)根据所学知识判断,锡的燃烧是________变化。
(2)罗蒙诺索夫分析数据后发现,生成白色物质的质量m3=_____ ___________,于是提出了“参加反应的物质的总质量,等于反应后产物的总质量”的观点。
(3)后经多位科学家的共同努力,最终确立了质量守恒定律。请从微观角度解释该定律:_________________________________ __________________________________________________________________________________________________。
化学
m4
-m2+m1
因为化学反应的过程是原子的重新
组合过程,反应前后原子的种类不变,总个数不变,原子质量不变,所以化学反应前后物质的总质量相等
【解析】 将这些锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质,称量容器的总质量为m2,把白色物质放回原容器里(容器中空气的组成恢复到初始状态),重新称量容器的总质量为m4,则参加反应的气体的质量为m4-m2,而参与反应的锡粉的质量为m1,所以生成白色物质的质量m3=m4-m2+m1。
跟踪训练 [2018·天津]在反应A+3B===2C+2D中,已知A和B的相对分子质量之比为7∶8,当2.8g A与一定量B恰好完全反应后,生成3.6g D,则生成C的质量为 ( )
A.9.6g B.8.8g C.6.8g D.4.4g
【解析】 设生成B的质量为x。
A+3B===2C+2D
7 24
2.8g x
B
【点悟】 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
类型二 催化剂及催化作用
典例 [2018·南京模拟]质量相等的两份过氧化氢,其中一份加入少量的二氧化锰,另一份直接加热,当没有气泡产生时,停止加热。下面放出氧气的质量(纵坐标)与反应时间(横坐标)关系的图像正确的是(a线是直接加热的曲线,b线是混有二氧化锰的曲线) ( )
A B C D
D
【解析】 在过氧化氢分解的反应中,二氧化锰作催化剂,只能改变反应速度,而本实验中两份过氧化氢溶液质量和浓度相同,所以最后产生氧气的质量相等,但加入二氧化锰会加快过氧化氢分解速度,起始时间相同,故D正确。
跟踪训练 [2017·随州改编]学习了“氧气的制取”后,老师留下“寻找新的催化剂”的探究内容。某探究小组设计了如下探究方案。
【提出问题】红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
【实验探究】
氧气
实验步骤 实验现象 实验结论及解释
Ⅰ. A中无明显现象,B中产生大量能使带火星木条复燃的气体 ①产生的气体是________
②红砖粉末能改变过氧化氢分解速度
质
量和化学性质
加入二
氧化锰的试管中产生气泡的速度比加入红砖粉末的快
Ⅱ.向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣 ①又产生大量能使带火星木条复燃的气体
②滤渣质量等于a g 红砖粉末的____ ______________在反应前后均没有发生变化,能作过氧化氢分解的催化剂
Ⅲ. 两试管中均产生气泡且________ _______________________________________________ 红砖粉末的催化效果没有二氧化锰粉末好
【拓展应用】
已知CuSO4也可作为过氧化氢分解的催化剂。向101.2g一定溶质质量分数的过氧化氢溶液中加入2g CuSO4粉末,充分反应后得到溶质质量分数为2%的溶液,则生成氧气______g。
【点悟】 判断某物质是否是催化剂把握“一变二不变”,即能改变化学反应速度,但反应前后物质的质量和化学性质不变。不能只凭质量不变就认为是催化剂。催化剂具有“针对性”,即对某个反应才有意义;催化剂还具有“多样性”,即某个反应的催化剂可以有多种。
3.2
对质量守恒定律的应用不熟练致错
A.64 B.56 C.39 D.23
【错解】选B
【析错】没有利用质量守恒定律来判断物质是否完全反应。
M的质量(g) S的质量(g) M2S的质量(g)
甲 6.0 2.5 7.5
乙 7.0 1.5 7.5
【正解】选A 通过观察甲、乙两同学的生成物与反应物的质量,发现生成物相等,反应物不相等,说明有物质没反应完全。同样生成7.5g M2S,甲实验S的用量为2.5g、乙实验S的用量为1.5g,则可得反应生成7.5g M2S时需要消耗S的质量为1.5g;利用质量守恒定律,则两物质恰好完全反应时,可判断生成7.5g M2S时消耗M的质量为6.0g。
设元素M的相对原子质量是x,
跟踪训练 [2018·南京]在密闭容器中有甲、乙、丙、丁四种物质、在一定条件下反应,测得反应前及反应过程中的两个时刻各物质的质量分数如图所示。图中a、b、c、d分别表示相应物质的质量分数。下列数据正确的是 ( )
A.a=56% B.b=6%
C.c=17% D.d=8%
A
【解析】 首先由题中信息可知,该反应为甲和乙化合生成丙,丁可能作催化剂或不参加反应。利用质量守恒定律进一步分析乙含量的变化是14%→11%→8%,分析数据可知,从反应前到反应过程中第一个时刻乙含量的变化量,与第一个时刻到第二个时刻乙含量的变化量相同,由此可推出甲含量的变化是70%→56%→42%,丙含量的变化是6%→23%→40%。故a=56%,b=8%,c=23%,d=10%。
利用质量守恒定律解有机物燃烧问题
利用质量守恒定律解有机物燃烧问题的答题技巧
(1)判断有机物的元素种类
①定性判断:若某有机物燃烧后所得产物有水和二氧化碳,则该有机物一定含有__________两种元素,可能有______元素。
②定量判断:若某有机物燃烧后所得产物有水和二氧化碳,则该有机物一定含有碳、氢两种元素。若要判断该有机物是否含有氧元素,则需要计算燃烧产物二氧化碳中碳元素的质量m(C)以及水中的氢元素质量m(H)(见下式)。
碳、氢
氧
CO2~~~C
12
将m(C)与m(H)相加,并与有机物的质量m(有机物)进行比较。
若m(C)+m(H)=m(有机物),则该有机物只含碳、氢两种元素;
若m(C)+m(H)(2)求有机物的化学式
已知某有机物的相对分子质量,求该有机物的化学式通常有两种方法。
①最简式法
已知某有机物所含元素种类及质量或质量分数,求出元素原子个数的最简整数比,得到的式子就是最简式(见下式)。
再将最简式的相对分子质量与有机物的相对分子质量进行比较,确定有机物的化学式。
②直接法
已知有机物的相对分子质量及各种元素所占的质量分数,则可以用下面的式子直接求出该有机物的化学式[M(有机物)表示该有机物的相对分子质量,C%、H%、O%表示碳、氢、氧元素的质量分数]。
典例 [2018·苏州]一定质量的某有机化合物完全燃烧,生成2.2g CO2和1.8g H2O,另取3.2g该有机化合物在O2中完全燃烧,消耗4.8g O2,该有机化合物的化学式可能是 ( )
A.C2H4 B.CH4O
C.CH4 D.C2H4O
B
小金取54.7g碱式碳酸锌样品(不含杂质),放置于热分解装置内,完全反应后测得装置A增重5.4g,装置B增重8.8g。则x∶y∶z的最简整数比为___________。
5∶6∶2
【点悟】 利用质量守恒定律计算无机物的化学式的过程与计算有机物的化学式类似。
1.[黄石中考]下列关于催化剂的说法正确的是 ( )
A.催化剂必定加快反应速率
B.反应前后催化剂的化学性质通常会发生改变
C.在酿造工业和制药工业,一般都要用酶作催化剂
D.用氯酸钾制取氧气时,加入催化剂可使生成氧气的质量 增加
C
A.O2 B.NaClO
C.HCl D.NaClO3
3.[2017·广安]下列变化,遵循质量守恒定律的是 ( )
A.石墨制成金刚石
B.2g H2完全燃烧生成36g H2O
C.水变成汽油
D.冰转化成干冰
D
A
A.该反应属于分解反应
B.固体减少的质量等于生成O2的质量
C.MnO2加快了反应速率
D.反应前后氧元素的化合价有变化
A.淀粉中一定含C、H两种元素
B.淀粉中一定只含C、H两种元素
C.淀粉中可能含有三种以上的元素
D.淀粉可能是一种单质或一种化合物
C
A
6.[2018·黄冈]一定质量的甲烷在不充足的氧气中燃烧,甲烷完全反应,生成物只有CO、CO2和H2O,且总质量为20.8g,其中H2O的质量为10.8g,则CO2的质量为 ( )
A.5.6g B.8.8g
C.4.4g D.4.8g
C
一、催化剂在化学反应中的应用
考点 列举说明催化作用和催化剂(a)
1.催化剂:在化学反应中只起________反应________的作用,本身的________和____________在反应前后都没有改变的物质。
2.知道催化剂在化学反应中的作用
改变
速度
质量
化学性质
二、质量守恒定律
内容:参加____________的各物质的________总和等于反应后生成的各物质的质量总和。
考点2 会从分子、原子的角度解释质量守恒定律(b)
实质:化学反应是反应物分子里的原子重新组合形成新物质的过程。即化学反应前后______________没有改变、______ ________没有增减、______________也没有改变,因此,化学反应前后物质的总质量守恒。
化学反应
质量
原子的种类
原子
的数目
原子的质量
考点3 用质量守恒定律分析、解释常见的现象(c)
理解质量守恒定律应抓住“五个一定不变”、“两个一定改变”及“一个可能改变”。
【注意】 ①“化学反应”是前提。质量守恒定律的适用范围是化学变化,不适用于物理变化,任何化学变化都遵循质量守恒定律。
②“参加反应”是基础。概念中明确指出是“参加反应”的各物质的质量总和,不参加反应的物质质量不能计算在内。
③“质量总和”是核心。无论是参加反应的物质,还是反应后生成的物质,计算时不能漏掉任何一项。
类型一 质量守恒定律的应用
典例 [衢州中考]以下是俄国化学家罗蒙诺索夫曾开展的实验:
①先用天平称取质量为m1的金属锡粉;
②将这些锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质,称量容器的总质量为m2;
③打开容器,听到了空气进入容器发出的“咝咝的声响”,称量所得白色物质的质量为m3;
④把白色物质放回原容器里(容器中空气的组成恢复到初始状态),重新称量容器的总质量为m4。
(1)根据所学知识判断,锡的燃烧是________变化。
(2)罗蒙诺索夫分析数据后发现,生成白色物质的质量m3=_____ ___________,于是提出了“参加反应的物质的总质量,等于反应后产物的总质量”的观点。
(3)后经多位科学家的共同努力,最终确立了质量守恒定律。请从微观角度解释该定律:_________________________________ __________________________________________________________________________________________________。
化学
m4
-m2+m1
因为化学反应的过程是原子的重新
组合过程,反应前后原子的种类不变,总个数不变,原子质量不变,所以化学反应前后物质的总质量相等
【解析】 将这些锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质,称量容器的总质量为m2,把白色物质放回原容器里(容器中空气的组成恢复到初始状态),重新称量容器的总质量为m4,则参加反应的气体的质量为m4-m2,而参与反应的锡粉的质量为m1,所以生成白色物质的质量m3=m4-m2+m1。
跟踪训练 [2018·天津]在反应A+3B===2C+2D中,已知A和B的相对分子质量之比为7∶8,当2.8g A与一定量B恰好完全反应后,生成3.6g D,则生成C的质量为 ( )
A.9.6g B.8.8g C.6.8g D.4.4g
【解析】 设生成B的质量为x。
A+3B===2C+2D
7 24
2.8g x
B
【点悟】 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
类型二 催化剂及催化作用
典例 [2018·南京模拟]质量相等的两份过氧化氢,其中一份加入少量的二氧化锰,另一份直接加热,当没有气泡产生时,停止加热。下面放出氧气的质量(纵坐标)与反应时间(横坐标)关系的图像正确的是(a线是直接加热的曲线,b线是混有二氧化锰的曲线) ( )
A B C D
D
【解析】 在过氧化氢分解的反应中,二氧化锰作催化剂,只能改变反应速度,而本实验中两份过氧化氢溶液质量和浓度相同,所以最后产生氧气的质量相等,但加入二氧化锰会加快过氧化氢分解速度,起始时间相同,故D正确。
跟踪训练 [2017·随州改编]学习了“氧气的制取”后,老师留下“寻找新的催化剂”的探究内容。某探究小组设计了如下探究方案。
【提出问题】红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
【实验探究】
氧气
实验步骤 实验现象 实验结论及解释
Ⅰ. A中无明显现象,B中产生大量能使带火星木条复燃的气体 ①产生的气体是________
②红砖粉末能改变过氧化氢分解速度
质
量和化学性质
加入二
氧化锰的试管中产生气泡的速度比加入红砖粉末的快
Ⅱ.向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣 ①又产生大量能使带火星木条复燃的气体
②滤渣质量等于a g 红砖粉末的____ ______________在反应前后均没有发生变化,能作过氧化氢分解的催化剂
Ⅲ. 两试管中均产生气泡且________ _______________________________________________ 红砖粉末的催化效果没有二氧化锰粉末好
【拓展应用】
已知CuSO4也可作为过氧化氢分解的催化剂。向101.2g一定溶质质量分数的过氧化氢溶液中加入2g CuSO4粉末,充分反应后得到溶质质量分数为2%的溶液,则生成氧气______g。
【点悟】 判断某物质是否是催化剂把握“一变二不变”,即能改变化学反应速度,但反应前后物质的质量和化学性质不变。不能只凭质量不变就认为是催化剂。催化剂具有“针对性”,即对某个反应才有意义;催化剂还具有“多样性”,即某个反应的催化剂可以有多种。
3.2
对质量守恒定律的应用不熟练致错
A.64 B.56 C.39 D.23
【错解】选B
【析错】没有利用质量守恒定律来判断物质是否完全反应。
M的质量(g) S的质量(g) M2S的质量(g)
甲 6.0 2.5 7.5
乙 7.0 1.5 7.5
【正解】选A 通过观察甲、乙两同学的生成物与反应物的质量,发现生成物相等,反应物不相等,说明有物质没反应完全。同样生成7.5g M2S,甲实验S的用量为2.5g、乙实验S的用量为1.5g,则可得反应生成7.5g M2S时需要消耗S的质量为1.5g;利用质量守恒定律,则两物质恰好完全反应时,可判断生成7.5g M2S时消耗M的质量为6.0g。
设元素M的相对原子质量是x,
跟踪训练 [2018·南京]在密闭容器中有甲、乙、丙、丁四种物质、在一定条件下反应,测得反应前及反应过程中的两个时刻各物质的质量分数如图所示。图中a、b、c、d分别表示相应物质的质量分数。下列数据正确的是 ( )
A.a=56% B.b=6%
C.c=17% D.d=8%
A
【解析】 首先由题中信息可知,该反应为甲和乙化合生成丙,丁可能作催化剂或不参加反应。利用质量守恒定律进一步分析乙含量的变化是14%→11%→8%,分析数据可知,从反应前到反应过程中第一个时刻乙含量的变化量,与第一个时刻到第二个时刻乙含量的变化量相同,由此可推出甲含量的变化是70%→56%→42%,丙含量的变化是6%→23%→40%。故a=56%,b=8%,c=23%,d=10%。
利用质量守恒定律解有机物燃烧问题
利用质量守恒定律解有机物燃烧问题的答题技巧
(1)判断有机物的元素种类
①定性判断:若某有机物燃烧后所得产物有水和二氧化碳,则该有机物一定含有__________两种元素,可能有______元素。
②定量判断:若某有机物燃烧后所得产物有水和二氧化碳,则该有机物一定含有碳、氢两种元素。若要判断该有机物是否含有氧元素,则需要计算燃烧产物二氧化碳中碳元素的质量m(C)以及水中的氢元素质量m(H)(见下式)。
碳、氢
氧
CO2~~~C
12
将m(C)与m(H)相加,并与有机物的质量m(有机物)进行比较。
若m(C)+m(H)=m(有机物),则该有机物只含碳、氢两种元素;
若m(C)+m(H)
已知某有机物的相对分子质量,求该有机物的化学式通常有两种方法。
①最简式法
已知某有机物所含元素种类及质量或质量分数,求出元素原子个数的最简整数比,得到的式子就是最简式(见下式)。
再将最简式的相对分子质量与有机物的相对分子质量进行比较,确定有机物的化学式。
②直接法
已知有机物的相对分子质量及各种元素所占的质量分数,则可以用下面的式子直接求出该有机物的化学式[M(有机物)表示该有机物的相对分子质量,C%、H%、O%表示碳、氢、氧元素的质量分数]。
典例 [2018·苏州]一定质量的某有机化合物完全燃烧,生成2.2g CO2和1.8g H2O,另取3.2g该有机化合物在O2中完全燃烧,消耗4.8g O2,该有机化合物的化学式可能是 ( )
A.C2H4 B.CH4O
C.CH4 D.C2H4O
B
小金取54.7g碱式碳酸锌样品(不含杂质),放置于热分解装置内,完全反应后测得装置A增重5.4g,装置B增重8.8g。则x∶y∶z的最简整数比为___________。
5∶6∶2
【点悟】 利用质量守恒定律计算无机物的化学式的过程与计算有机物的化学式类似。
同课章节目录
