浙江省中考科学(化学部分)第二篇主题3第一单元常见的化学反应(3)(课件 46张ppt)
文档属性
| 名称 | 浙江省中考科学(化学部分)第二篇主题3第一单元常见的化学反应(3)(课件 46张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-03-10 00:00:00 | ||
图片预览









文档简介
第一单元 常见的化学反应(3)
1.[2018·济宁]下列化学方程式书写和对反应类型的判断,都正确的是 ( )
D
A.反应前后分子总数保持不变
B.该反应的反应物是五氧化二磷
C.每四份质量的磷和五份质量的氧气完全反应
D.在点燃的条件下,磷和氧气反应生成五氧化二磷
D
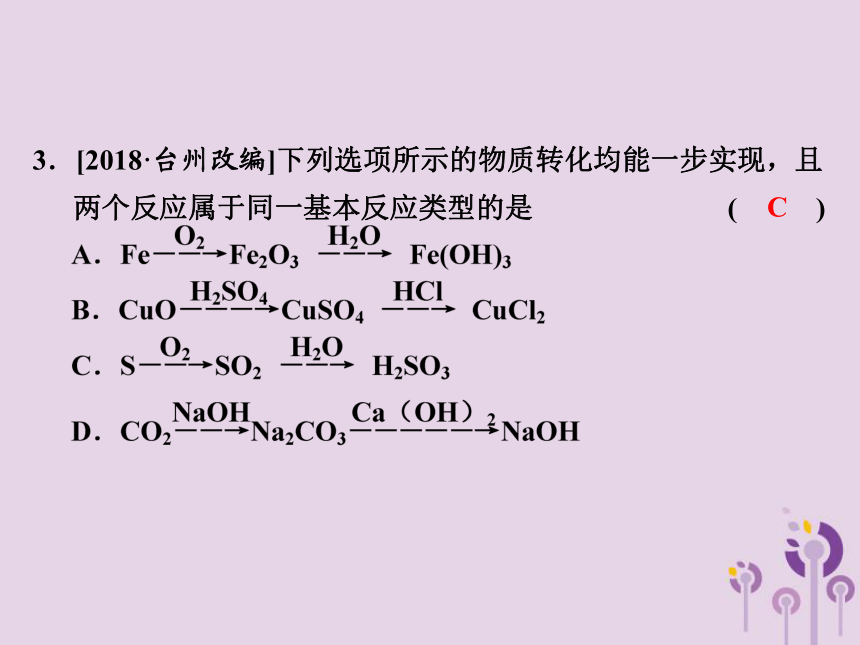
3.[2018·台州改编]下列选项所示的物质转化均能一步实现,且两个反应属于同一基本反应类型的是 ( )
C
4.[2018·江西]如图,物质王国中的A~F及X玩“独木桥”游戏,其中A~F分别是盐酸、氢气、氧化铜、氢氧化钙、碳酸钠、二氧化碳六种物质中的一种。
(1)搭桥:规则是A~F搭桥后相邻的物质之间能发生化学反应(所涉及反应均为初中常见化学反应)。
已知E的俗名叫熟石灰
①E的化学式是___________;
②A与B反应的基本类型是____________;
Ca(OH)2
置换反应
③C与D反应的化学方程式是___________________________ _____________。
(2)过桥:若A~F分别通过一步反应能直接转化为X,则X可成功过桥,物质X是________。
【解析】 (1)题中所给六种物质中,氢气只能和氧化铜反应,二氧化碳只能和氢氧化钙反应,则氢气和二氧化碳只能位于两端,因为E为氢氧化钙,所以F只能为二氧化碳,由此可推出A~F分别是氢气、氧化铜、盐酸、碳酸钠、氢氧化钙、二氧化碳;氢气与氧化铜加热反应生成水和铜,属于置换反应;盐酸与碳酸钠反应生成水、二氧化碳和氯化钠。(2)氢气、氧化铜、盐酸、碳酸钠、氢氧化钙、二氧化碳分别与相应物质反应均能生成水,所以X物质为水。
2HCl+Na2CO3===2NaCl+
CO2↑+H2O
H2O
(1)每升“人造树叶”工作一天可得到乙醇的质量是多少?
(2)若每天一棵树平均可吸收48.4g CO2,则每升“人造树叶”吸收的CO2相当于______棵树吸收的CO2。
20
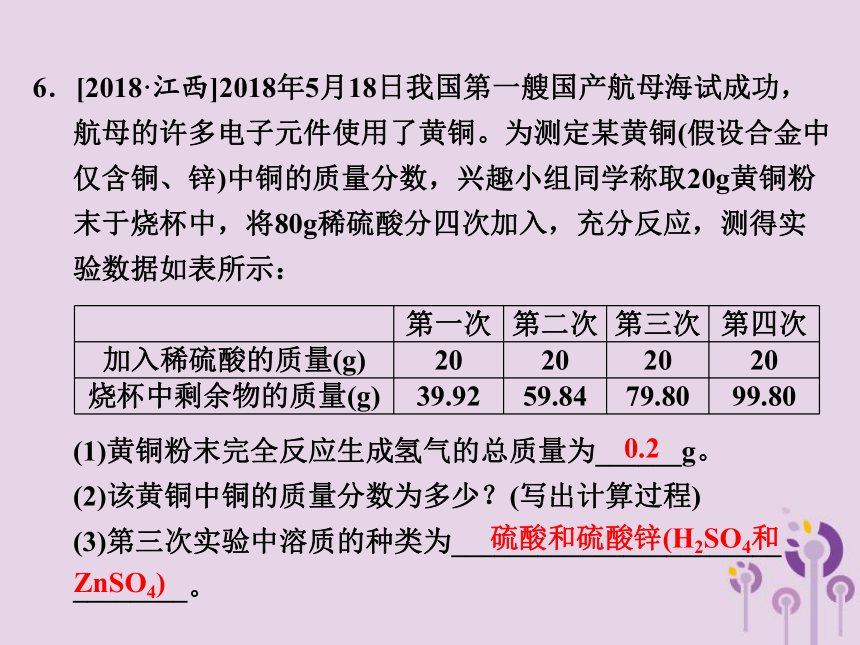
6.[2018·江西]2018年5月18日我国第一艘国产航母海试成功,航母的许多电子元件使用了黄铜。为测定某黄铜(假设合金中仅含铜、锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如表所示:
(1)黄铜粉末完全反应生成氢气的总质量为______g。
(2)该黄铜中铜的质量分数为多少?(写出计算过程)
(3)第三次实验中溶质的种类为_______________________ ________。
0.2
硫酸和硫酸锌(H2SO4和
ZnSO4)
第一次 第二次 第三次 第四次
加入稀硫酸的质量(g) 20 20 20 20
烧杯中剩余物的质量(g) 39.92 59.84 79.80 99.80
【答案】 (2)设20g黄铜中锌的质量为x。
Zn+H2SO4===ZnSO4+H2↑
65 2
x 0.2g
【解析】 (1)根据实验数据,第三次实验中黄铜粉末完全反应,由质量守恒定律可知,黄铜粉末完全反应生成氢气总质量为20g+60g-79.8g=0.2g。(3)由于硫酸过量,第三次实验的溶质为硫酸和硫酸锌(H2SO4和ZnSO4)。
一、化合反应、分解反应、置换反应和复分解反应的特点
考点1 说明化合反应、分解反应、置换反应和复分解反应的特点(b)
考点2 辨认具体化学反应的基本类型(a)
两种或两种以上
一种
两种
或两种以上
化合物
另一种单质
相互交换成分
反应类型 概念 表达式
化合反应 由_________________的物质生成另________物质的反应 A+B==AB
(多变一)
分解反应 由一种物质生成______ ____________其他物质的反应 AB==A+B
(一变多)
置换反应 由一种单质跟一种__________反应,生成______________和另一种化合物的反应 A+BC==B+AC(一换一)
复分解反应 由两种化合物_____________,生成另外两种化合物的反应 AB+CD==AD+CB(相互交换)
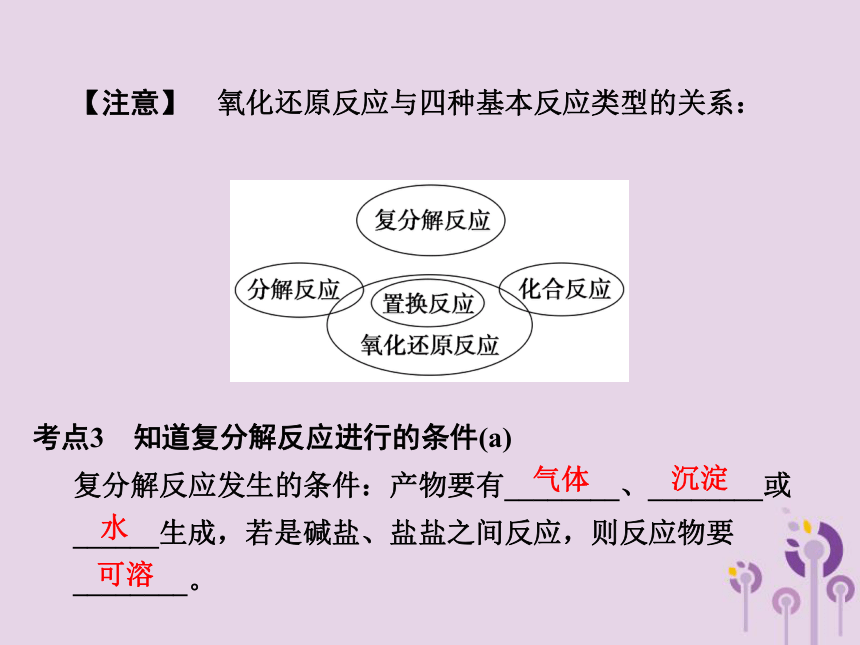
【注意】 氧化还原反应与四种基本反应类型的关系:
考点3 知道复分解反应进行的条件(a)
复分解反应发生的条件:产物要有________、________或______生成,若是碱盐、盐盐之间反应,则反应物要________。
气体
沉淀
水
可溶
二、化学方程式,根据化学方程式进行生成
物和反应物之间的计算
考点1 说出化学方程式表示的意义(a)
1.定义:用__________来表示化学反应的方程式。
2.表示的意义:
考点2 正确书写常见的化学反应方程式(b)
1.书写原则:一是必须以____________为基础;二是要______ __质量守恒定律。
化学式
客观事实
遵守
2.书写步骤:
考点3 根据化学方程式进行生成物和反应物之间的计算(c)
1.根据化学方程式计算的依据是________________。
2.根据化学方程式计算的解题步骤:
设未知数→________________________→写出相关物质的相对分子质量和已知量、未知量→____________________→ __________________。
质量守恒定律
写出并配平化学方程式
列出比例式、求解
简明地写出答案
计算步骤简记为:设、写、找、列、求、答。即:
3.对计算步骤和方法的理解要注意以下几点:
(1)各代入量均指纯净物的质量。若物质不纯必须换算成纯净物的质量才能代入化学方程式进行计算。
(2)计算中所用的质量必须是实际参加反应的物质的质量。
(3)计算过程中各物理量单位必须对应统一,单位要代入计算过程。
类型一 化合反应与分解反应
典例 [2018·嘉兴]化学反应的实质是构成物质分子的原子重新进行组合,形成新分子的过程。如图是在密闭容器中某化学反应过程的微观示意图。据图回答:
(1)参加反应的“ ”与“ ”的分子个数比为________。
(2)该反应的基本反应类型是____________。
【解析】 由反应的微观示意图可知有2个 分子与1个 分子反应生成2个 分子,有2个 分子没有参与反应,参加反应的“ ”与“ ”的分子个数比为2∶1;该反应的反应物是两种,生成物是一种,属于化合反应。
跟踪训练 [2018·黄冈]金属钨(W)可做白炽灯泡的灯丝。用黑钨矿[主要含有FeWO4(钨酸亚铁)]制得金属钨(W)的工艺流程如图所示:
下列说法不正确的是 ( )
A.反应③属于分解反应
B.反应①②③④的产物都有氧化物
C.反应①④中有元素的化合价发生改变
D.为加快反应的速率,可将黑钨矿石碾成粉末
B
类型二 置换反应
典例 [2018·天津]芯片是电脑、智能家电的核心部件,它是以高纯度的单质硅(Si)为材料制成的。硅及其氧化物能发生如下反应:
下列说法不正确的是 ( )
A.反应③属于置换反应
B.上述反应中共生成三种可燃性气体
C.Na2SiO3中Si为+4价
D.Si和SiO2在一定条件下可以相互转化
B
跟踪训练 [2019·预测]下列有关置换反应说法正确的是 ( )
A.将氧化铁转变成单质铁的反应类型只能是置换反应
B.铜的金属活动性比银强,用铜与任何一种银盐反应就都能得到银
C.用铁作反应物发生置换反应得到的产物之一是亚铁盐
D.金属与可溶性盐发生置换反应后,所得溶液中溶质的质量都会比反应前减少
【解析】 一氧化碳与氧化铁在高温下生成二氧化碳和铁的反应
就不属于置换反应;氯化银等难溶于水的盐不能与铜发生置换
反应得到银;锌与硫酸铜反应后,所得溶液中溶质的质量比反
应前增加。
C
【点悟】 在溶液中,金属与盐发生置换反应需要盐能溶于水;金属与盐溶液发生置换反应所得溶液或固体质量的变化需要根据化学方程式中金属与盐的化学计量系数及相对原子质量、相对分子质量进行分析。
类型三 复分解反应
典例 [2017·湖州]科学课上,老师告诉学生“能发生复分解反应的两种盐通常是可溶的”。有“通常”就有“例外”,能否找到某些可溶性盐和难溶性盐发生复分解反应的证据呢?科学兴趣小组进行了探究。
【查阅资料】①水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减少的方向进行。
②了解到某些难溶性盐的溶解能力和颜色。
【实验取证】取一支试管,加入少量AgNO3溶液,再加入过量NaCl溶液,有白色沉淀生成。
再往该试管中加入少量KI溶液,白色沉淀转化为黄色沉淀。
【分析讨论】(1)为什么要加入过量的NaCl溶液?请说明理由:_____________________________________________________ _____________________________。
(2)写出加入少量KI溶液后发生反应的化学方程式:__________ _______________。
(3)该反应能发生的原因是AgI在水中的溶解能力________(选填“大于”“等于”或“小于”)AgCl。
【得出结论】某些可溶性盐和难溶性盐之间能发生复分解反应。
若AgNO3过量,AgI沉淀可能是过量AgNO3与KI反应生成的,无法说明该反应一定发生
KI+AgCl
===AgI+KCl
小于
跟踪训练 [泰安中考]初中化学中,我们学习了酸和碱发生中和反应的实质是H++OH-===H2O,如图。像这种用实际参加反应的离子符号来表示反应的式子叫离子方程式。离子方程式的书写一般按以下步骤:(以Na2SO4与BaCl2反应为例)
①写出Na2SO4与BaCl2反应的化学方程式:_________________ ____________________;
Na2SO4+BaCl2
===BaSO4↓+2NaCl
AC
(2)写出稀盐酸滴在石灰石上所发生反应的离子方程式:____________________________________。
(3)写出一个与离子方程式Mg+2H+===Mg2++H2↑相对应的化学方程式:___________________________________________ ______________。
(4)酸、碱、盐在水溶液中发生的复分解反应实质上就是两种化合物在溶液中相互交换离子的反应,只要具备生成物中有气体或沉淀或______生成,反应就能发生。
【点悟】 酸与碱发生的中和反应属于复分解反应。复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减少的方向进行。
CaCO3+2H+===Ca2++H2O+CO2↑
Mg+H2SO4===MgSO4+H2↑(或Mg+2HCl===
MgCl2+H2↑)
水
类型四 根据化学方程式进行计算
(1)电解过程中消耗氯化钠的质量。
(2)所加盐酸中溶质的质量分数(用化学方程式计算)。
【点悟】 根据化学方程式计算的依据是质量守恒定律,进行计算的过程应规范合理。
请计算:
(1)尿素中氮元素的质量分数。
(2)生产6t尿素理论上需要氨气的质量是多少?
不了解各类化学反应的特点致错
典例 下列关于四种基本反应类型的叙述中,不正确的是( )
A.有单质生成的反应不一定是置换反应
B.复分解反应一定没有单质参加
C.分解反应的反应物一定不是单质
D.由两种物质作用生成盐和水的反应都是中和反应
【错解】选A
【析错】有单质生成的反应不一定是置换反应,如一氧化碳和氧化铁反应、电解水等。
【正解】选D 由两种物质作用生成盐和水的反应不一定是酸碱反应,例如二氧化碳和氢氧化钙反应能生成盐(碳酸钙)和水,不属于中和反应。
跟踪训练 [2018·深圳改编]如图为A~G(初中常见物质)的转化关系,其中A是天然气的主要成分,通常情况下D是一种无色无味有毒的气体。
根据以上信息回答下列问题:
(1)反应①的现象为_______________________。
(2)写出反应②的化学方程式_________________________,该反应属于________反应(填基本反应类型)。
固体溶解,溶液变蓝色
化合
Na2O+H2O=== 2NaOH
(3)写出反应③的化学方程式______________________________ _________。
CuSO4+2NaOH===Cu(OH)2↓+
Na2SO4
过量计算
过量计算的答题技巧
(1)概念:过量计算是在有多种反应物参加的化学反应中,两种或两种以上反应物的用量均已给出的化学计算。
(2)解题原则:过量计算的原则是用__________(即完全反应)的反应物的质量来进行计算,不能用过量的反应物的质量计算。
(3)解题流程:过量计算的基本步骤是先进行过量判断,即判断出不足量的反应物,再把不足量的反应物的质量代入进行计算。
不足量
典例 [2018·嘉兴]洁厕灵是常用的陶瓷清洗液,小彭同学对某品牌洁厕灵的有效成分及其含量进行研究。
(1)查阅资料得知:洁厕灵有效成分是HCl。HCl的含量可通过已知溶质质量分数的NaHCO3溶液来测定,其他成分均不参与反应。请完成HCl与NaHCO3反应的化学方程式:HCl+NaHCO3===NaCl+________+CO2↑。
(2)向一锥形瓶中加入100g该品牌的洁厕灵,再逐次加入相同质量分数的NaHCO3溶液,测出每次锥形瓶中反应后溶液的总质量,数据记录如下:
H2O
试分析计算下列问题:
该品牌洁厕灵中HCl的质量分数是多少?
第一次 第二次 第三次 第四次 第五次
加入NaHCO3溶液的质量(g) 40 40 40 40 40
反应后溶液的总质量(g) 138.9 177.8 216.7 255.6 295.6
【解析】 第一次加入40g NaHCO3溶液后,溶液总质量减少1.1g(即CO2的质量)。第二次加入40g NaHCO3溶液后,溶液总质量减少2.2g(即CO2的质量),说明第一次加入40g NaHCO3溶液后,盐酸过量,不能用第一次的数据计算。第三次加入40g NaHCO3溶液后,溶液总质量减少3.3g(即CO2的质量),说明第二次加入40g NaHCO3溶液后,盐酸仍然过量。第四次加入40g NaHCO3溶液后,溶液总质量减少4.4g(即CO2的质量),说明第三次加入40g NaHCO3溶液后,盐酸依旧过量。第五次加入40g NaHCO3溶液后,溶液总质量减少4.4g(即CO2的质量),说明第四次加入40g NaHCO3溶液后,盐酸已经反应完。可以用第四次或第五次的数据进行计算。
【点悟】 向反应物A中连续加入反应物B时,可以通过分析生成物的质量的变化来判断反应物是否过量。若生成物的质量增加说明加入的反应物B不足量,反应物A过量。若生成物的质量不再变化说明加入的反应物B恰好反应或过量,反应物A恰好反应或不足量。
跟踪训练 [2018·达州]实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有100g碳酸钠溶液,将150g氯化钙溶液分四次加入,充分反应,四次测量所得数据如表所示:
次数 累计加入氯化钙溶液的质量(g) 烧杯中溶液的总质量(g)
一 40 134
二 80 168
三 120 202
四 150 232
(1)恰好完全反应时,生成沉淀的总质量为______g。
(2)第四次测量时,所得溶液中的溶质有________________(填化学式)。
(3)计算氯化钙溶液的溶质质量分数(写出计算过程)。
18
NaCl和CaCl2
【解析】 根据第一次总质量减少100g+40g-134g=6g。第二次总质量减少100g+80g-168g=12g,第三次总质量减少100g+120g-202g=18g,第四次总质量减少100g+150g-232g=18g,即第三次恰好完全反应,恰好完全反应生成沉淀的质量为18g。据此可知,第四次时氯化钙过量,所以可知此时的溶质为NaCl和CaCl2。根据前三次都可以计算氯化钙溶液的溶质质量分数。
1.[2018·济宁]下列化学方程式书写和对反应类型的判断,都正确的是 ( )
D
A.反应前后分子总数保持不变
B.该反应的反应物是五氧化二磷
C.每四份质量的磷和五份质量的氧气完全反应
D.在点燃的条件下,磷和氧气反应生成五氧化二磷
D
3.[2018·台州改编]下列选项所示的物质转化均能一步实现,且两个反应属于同一基本反应类型的是 ( )
C
4.[2018·江西]如图,物质王国中的A~F及X玩“独木桥”游戏,其中A~F分别是盐酸、氢气、氧化铜、氢氧化钙、碳酸钠、二氧化碳六种物质中的一种。
(1)搭桥:规则是A~F搭桥后相邻的物质之间能发生化学反应(所涉及反应均为初中常见化学反应)。
已知E的俗名叫熟石灰
①E的化学式是___________;
②A与B反应的基本类型是____________;
Ca(OH)2
置换反应
③C与D反应的化学方程式是___________________________ _____________。
(2)过桥:若A~F分别通过一步反应能直接转化为X,则X可成功过桥,物质X是________。
【解析】 (1)题中所给六种物质中,氢气只能和氧化铜反应,二氧化碳只能和氢氧化钙反应,则氢气和二氧化碳只能位于两端,因为E为氢氧化钙,所以F只能为二氧化碳,由此可推出A~F分别是氢气、氧化铜、盐酸、碳酸钠、氢氧化钙、二氧化碳;氢气与氧化铜加热反应生成水和铜,属于置换反应;盐酸与碳酸钠反应生成水、二氧化碳和氯化钠。(2)氢气、氧化铜、盐酸、碳酸钠、氢氧化钙、二氧化碳分别与相应物质反应均能生成水,所以X物质为水。
2HCl+Na2CO3===2NaCl+
CO2↑+H2O
H2O
(1)每升“人造树叶”工作一天可得到乙醇的质量是多少?
(2)若每天一棵树平均可吸收48.4g CO2,则每升“人造树叶”吸收的CO2相当于______棵树吸收的CO2。
20
6.[2018·江西]2018年5月18日我国第一艘国产航母海试成功,航母的许多电子元件使用了黄铜。为测定某黄铜(假设合金中仅含铜、锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如表所示:
(1)黄铜粉末完全反应生成氢气的总质量为______g。
(2)该黄铜中铜的质量分数为多少?(写出计算过程)
(3)第三次实验中溶质的种类为_______________________ ________。
0.2
硫酸和硫酸锌(H2SO4和
ZnSO4)
第一次 第二次 第三次 第四次
加入稀硫酸的质量(g) 20 20 20 20
烧杯中剩余物的质量(g) 39.92 59.84 79.80 99.80
【答案】 (2)设20g黄铜中锌的质量为x。
Zn+H2SO4===ZnSO4+H2↑
65 2
x 0.2g
【解析】 (1)根据实验数据,第三次实验中黄铜粉末完全反应,由质量守恒定律可知,黄铜粉末完全反应生成氢气总质量为20g+60g-79.8g=0.2g。(3)由于硫酸过量,第三次实验的溶质为硫酸和硫酸锌(H2SO4和ZnSO4)。
一、化合反应、分解反应、置换反应和复分解反应的特点
考点1 说明化合反应、分解反应、置换反应和复分解反应的特点(b)
考点2 辨认具体化学反应的基本类型(a)
两种或两种以上
一种
两种
或两种以上
化合物
另一种单质
相互交换成分
反应类型 概念 表达式
化合反应 由_________________的物质生成另________物质的反应 A+B==AB
(多变一)
分解反应 由一种物质生成______ ____________其他物质的反应 AB==A+B
(一变多)
置换反应 由一种单质跟一种__________反应,生成______________和另一种化合物的反应 A+BC==B+AC(一换一)
复分解反应 由两种化合物_____________,生成另外两种化合物的反应 AB+CD==AD+CB(相互交换)
【注意】 氧化还原反应与四种基本反应类型的关系:
考点3 知道复分解反应进行的条件(a)
复分解反应发生的条件:产物要有________、________或______生成,若是碱盐、盐盐之间反应,则反应物要________。
气体
沉淀
水
可溶
二、化学方程式,根据化学方程式进行生成
物和反应物之间的计算
考点1 说出化学方程式表示的意义(a)
1.定义:用__________来表示化学反应的方程式。
2.表示的意义:
考点2 正确书写常见的化学反应方程式(b)
1.书写原则:一是必须以____________为基础;二是要______ __质量守恒定律。
化学式
客观事实
遵守
2.书写步骤:
考点3 根据化学方程式进行生成物和反应物之间的计算(c)
1.根据化学方程式计算的依据是________________。
2.根据化学方程式计算的解题步骤:
设未知数→________________________→写出相关物质的相对分子质量和已知量、未知量→____________________→ __________________。
质量守恒定律
写出并配平化学方程式
列出比例式、求解
简明地写出答案
计算步骤简记为:设、写、找、列、求、答。即:
3.对计算步骤和方法的理解要注意以下几点:
(1)各代入量均指纯净物的质量。若物质不纯必须换算成纯净物的质量才能代入化学方程式进行计算。
(2)计算中所用的质量必须是实际参加反应的物质的质量。
(3)计算过程中各物理量单位必须对应统一,单位要代入计算过程。
类型一 化合反应与分解反应
典例 [2018·嘉兴]化学反应的实质是构成物质分子的原子重新进行组合,形成新分子的过程。如图是在密闭容器中某化学反应过程的微观示意图。据图回答:
(1)参加反应的“ ”与“ ”的分子个数比为________。
(2)该反应的基本反应类型是____________。
【解析】 由反应的微观示意图可知有2个 分子与1个 分子反应生成2个 分子,有2个 分子没有参与反应,参加反应的“ ”与“ ”的分子个数比为2∶1;该反应的反应物是两种,生成物是一种,属于化合反应。
跟踪训练 [2018·黄冈]金属钨(W)可做白炽灯泡的灯丝。用黑钨矿[主要含有FeWO4(钨酸亚铁)]制得金属钨(W)的工艺流程如图所示:
下列说法不正确的是 ( )
A.反应③属于分解反应
B.反应①②③④的产物都有氧化物
C.反应①④中有元素的化合价发生改变
D.为加快反应的速率,可将黑钨矿石碾成粉末
B
类型二 置换反应
典例 [2018·天津]芯片是电脑、智能家电的核心部件,它是以高纯度的单质硅(Si)为材料制成的。硅及其氧化物能发生如下反应:
下列说法不正确的是 ( )
A.反应③属于置换反应
B.上述反应中共生成三种可燃性气体
C.Na2SiO3中Si为+4价
D.Si和SiO2在一定条件下可以相互转化
B
跟踪训练 [2019·预测]下列有关置换反应说法正确的是 ( )
A.将氧化铁转变成单质铁的反应类型只能是置换反应
B.铜的金属活动性比银强,用铜与任何一种银盐反应就都能得到银
C.用铁作反应物发生置换反应得到的产物之一是亚铁盐
D.金属与可溶性盐发生置换反应后,所得溶液中溶质的质量都会比反应前减少
【解析】 一氧化碳与氧化铁在高温下生成二氧化碳和铁的反应
就不属于置换反应;氯化银等难溶于水的盐不能与铜发生置换
反应得到银;锌与硫酸铜反应后,所得溶液中溶质的质量比反
应前增加。
C
【点悟】 在溶液中,金属与盐发生置换反应需要盐能溶于水;金属与盐溶液发生置换反应所得溶液或固体质量的变化需要根据化学方程式中金属与盐的化学计量系数及相对原子质量、相对分子质量进行分析。
类型三 复分解反应
典例 [2017·湖州]科学课上,老师告诉学生“能发生复分解反应的两种盐通常是可溶的”。有“通常”就有“例外”,能否找到某些可溶性盐和难溶性盐发生复分解反应的证据呢?科学兴趣小组进行了探究。
【查阅资料】①水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减少的方向进行。
②了解到某些难溶性盐的溶解能力和颜色。
【实验取证】取一支试管,加入少量AgNO3溶液,再加入过量NaCl溶液,有白色沉淀生成。
再往该试管中加入少量KI溶液,白色沉淀转化为黄色沉淀。
【分析讨论】(1)为什么要加入过量的NaCl溶液?请说明理由:_____________________________________________________ _____________________________。
(2)写出加入少量KI溶液后发生反应的化学方程式:__________ _______________。
(3)该反应能发生的原因是AgI在水中的溶解能力________(选填“大于”“等于”或“小于”)AgCl。
【得出结论】某些可溶性盐和难溶性盐之间能发生复分解反应。
若AgNO3过量,AgI沉淀可能是过量AgNO3与KI反应生成的,无法说明该反应一定发生
KI+AgCl
===AgI+KCl
小于
跟踪训练 [泰安中考]初中化学中,我们学习了酸和碱发生中和反应的实质是H++OH-===H2O,如图。像这种用实际参加反应的离子符号来表示反应的式子叫离子方程式。离子方程式的书写一般按以下步骤:(以Na2SO4与BaCl2反应为例)
①写出Na2SO4与BaCl2反应的化学方程式:_________________ ____________________;
Na2SO4+BaCl2
===BaSO4↓+2NaCl
AC
(2)写出稀盐酸滴在石灰石上所发生反应的离子方程式:____________________________________。
(3)写出一个与离子方程式Mg+2H+===Mg2++H2↑相对应的化学方程式:___________________________________________ ______________。
(4)酸、碱、盐在水溶液中发生的复分解反应实质上就是两种化合物在溶液中相互交换离子的反应,只要具备生成物中有气体或沉淀或______生成,反应就能发生。
【点悟】 酸与碱发生的中和反应属于复分解反应。复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减少的方向进行。
CaCO3+2H+===Ca2++H2O+CO2↑
Mg+H2SO4===MgSO4+H2↑(或Mg+2HCl===
MgCl2+H2↑)
水
类型四 根据化学方程式进行计算
(1)电解过程中消耗氯化钠的质量。
(2)所加盐酸中溶质的质量分数(用化学方程式计算)。
【点悟】 根据化学方程式计算的依据是质量守恒定律,进行计算的过程应规范合理。
请计算:
(1)尿素中氮元素的质量分数。
(2)生产6t尿素理论上需要氨气的质量是多少?
不了解各类化学反应的特点致错
典例 下列关于四种基本反应类型的叙述中,不正确的是( )
A.有单质生成的反应不一定是置换反应
B.复分解反应一定没有单质参加
C.分解反应的反应物一定不是单质
D.由两种物质作用生成盐和水的反应都是中和反应
【错解】选A
【析错】有单质生成的反应不一定是置换反应,如一氧化碳和氧化铁反应、电解水等。
【正解】选D 由两种物质作用生成盐和水的反应不一定是酸碱反应,例如二氧化碳和氢氧化钙反应能生成盐(碳酸钙)和水,不属于中和反应。
跟踪训练 [2018·深圳改编]如图为A~G(初中常见物质)的转化关系,其中A是天然气的主要成分,通常情况下D是一种无色无味有毒的气体。
根据以上信息回答下列问题:
(1)反应①的现象为_______________________。
(2)写出反应②的化学方程式_________________________,该反应属于________反应(填基本反应类型)。
固体溶解,溶液变蓝色
化合
Na2O+H2O=== 2NaOH
(3)写出反应③的化学方程式______________________________ _________。
CuSO4+2NaOH===Cu(OH)2↓+
Na2SO4
过量计算
过量计算的答题技巧
(1)概念:过量计算是在有多种反应物参加的化学反应中,两种或两种以上反应物的用量均已给出的化学计算。
(2)解题原则:过量计算的原则是用__________(即完全反应)的反应物的质量来进行计算,不能用过量的反应物的质量计算。
(3)解题流程:过量计算的基本步骤是先进行过量判断,即判断出不足量的反应物,再把不足量的反应物的质量代入进行计算。
不足量
典例 [2018·嘉兴]洁厕灵是常用的陶瓷清洗液,小彭同学对某品牌洁厕灵的有效成分及其含量进行研究。
(1)查阅资料得知:洁厕灵有效成分是HCl。HCl的含量可通过已知溶质质量分数的NaHCO3溶液来测定,其他成分均不参与反应。请完成HCl与NaHCO3反应的化学方程式:HCl+NaHCO3===NaCl+________+CO2↑。
(2)向一锥形瓶中加入100g该品牌的洁厕灵,再逐次加入相同质量分数的NaHCO3溶液,测出每次锥形瓶中反应后溶液的总质量,数据记录如下:
H2O
试分析计算下列问题:
该品牌洁厕灵中HCl的质量分数是多少?
第一次 第二次 第三次 第四次 第五次
加入NaHCO3溶液的质量(g) 40 40 40 40 40
反应后溶液的总质量(g) 138.9 177.8 216.7 255.6 295.6
【解析】 第一次加入40g NaHCO3溶液后,溶液总质量减少1.1g(即CO2的质量)。第二次加入40g NaHCO3溶液后,溶液总质量减少2.2g(即CO2的质量),说明第一次加入40g NaHCO3溶液后,盐酸过量,不能用第一次的数据计算。第三次加入40g NaHCO3溶液后,溶液总质量减少3.3g(即CO2的质量),说明第二次加入40g NaHCO3溶液后,盐酸仍然过量。第四次加入40g NaHCO3溶液后,溶液总质量减少4.4g(即CO2的质量),说明第三次加入40g NaHCO3溶液后,盐酸依旧过量。第五次加入40g NaHCO3溶液后,溶液总质量减少4.4g(即CO2的质量),说明第四次加入40g NaHCO3溶液后,盐酸已经反应完。可以用第四次或第五次的数据进行计算。
【点悟】 向反应物A中连续加入反应物B时,可以通过分析生成物的质量的变化来判断反应物是否过量。若生成物的质量增加说明加入的反应物B不足量,反应物A过量。若生成物的质量不再变化说明加入的反应物B恰好反应或过量,反应物A恰好反应或不足量。
跟踪训练 [2018·达州]实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有100g碳酸钠溶液,将150g氯化钙溶液分四次加入,充分反应,四次测量所得数据如表所示:
次数 累计加入氯化钙溶液的质量(g) 烧杯中溶液的总质量(g)
一 40 134
二 80 168
三 120 202
四 150 232
(1)恰好完全反应时,生成沉淀的总质量为______g。
(2)第四次测量时,所得溶液中的溶质有________________(填化学式)。
(3)计算氯化钙溶液的溶质质量分数(写出计算过程)。
18
NaCl和CaCl2
【解析】 根据第一次总质量减少100g+40g-134g=6g。第二次总质量减少100g+80g-168g=12g,第三次总质量减少100g+120g-202g=18g,第四次总质量减少100g+150g-232g=18g,即第三次恰好完全反应,恰好完全反应生成沉淀的质量为18g。据此可知,第四次时氯化钙过量,所以可知此时的溶质为NaCl和CaCl2。根据前三次都可以计算氯化钙溶液的溶质质量分数。
同课章节目录
