浙江省中考科学(化学部分)第二篇主题1第一单元物质的性质(课件 46张ppt)
文档属性
| 名称 | 浙江省中考科学(化学部分)第二篇主题1第一单元物质的性质(课件 46张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-03-10 00:00:00 | ||
图片预览










文档简介
第二篇 物质科学(化学部分)
第一单元 物质的性质
主题1 常见的物质
1.[2018·重庆B卷] “川航3U8633”的成功迫降,挽救了128条生命。迫降过程中属于化学变化的是 ( )
A.玻璃破裂 B.轮胎变瘪
C.燃油燃烧 D.座椅摇晃
2.[东营中考]下列用途利用了物质物理性质的是 ( )
A.木炭用作吸附剂 B.生石灰用作干燥剂
C.氧气用作助燃剂 D.氮气用作保护气
C
A
3.[2017·苏州模拟]t℃时,有两瓶硝酸钾溶液,一瓶为饱和溶液(溶质质量分数为40%),另一瓶为10%的溶液。下列实验操作无法区分这两种溶液的是 ( )
A.加一定量的水 B.加入少量硝酸钾晶体
C.适当降低温度 D.t℃时,蒸发少量水
A
4.[2018·枣庄改编]溶解度是定量表示物质溶解性的一种方法。图中给出了三种物质的溶解度曲线,下列说法不正确的是 ( )
A.60℃时,三种物质中溶解度
最大的是硫酸铵
B.三种物质的溶解度均随温度升
高而增大
C.t℃时,将30g氯化铵加入50g水
中,最终得到饱和溶液
D.80℃时氯化钾和氯化铵的饱和溶液分别降温至20℃,析 出晶体的质量后者大
D
【解析】 由于初始饱和溶液的质量关系不确定,因此无法比较
析出晶体质量的大小。
5.[2017·绍兴模拟改编]溶液是生产生活中常见的物质,依据相关信息回答问题。
资料:硝酸钾的溶解度数据(部分数据已作取整数处理)如表所示:
现有①、②、③、④四个烧杯,烧杯中分别盛有100g水。在40℃时,向四个烧杯中分别加入110g、86g、64g、32g硝酸钾,充分溶解,如图所示。
(1)______(填序号)烧杯中盛的是不饱和溶液。
(2)烧杯①、②、③中溶解的硝酸钾质量大小关系为_____。
A.三者一样大 B.①最大 C.③最小 D.无法判断
④
A
① ② ③ ④
温度(℃) 10 20 30 40 50 60 70
溶解度(g) 21 32 46 64 86 110 138
一、物质的物理变化和化学变化
考点1 描述物理变化和化学变化(a)
1.物理变化:物质只发生颜色、状态等变化,而没有产生____ ________的变化。如滴水成冰、冰雪消融、水分蒸发、铁丝变细、灯泡发光、轮胎爆炸等。
物理变化多表现为状态、形状等的变化。
2.化学变化:物质在发生变化后有____________产生。如钢铁锈蚀、食物腐烂、燃料燃烧、燃放烟花、酿酒等。
化学变化常伴随变色、生成气体、产生沉淀等现象以及吸热、放热、发光等能量变化。
新
的物质
新的物质
没有发生
间隔、位置
发生
另一
种
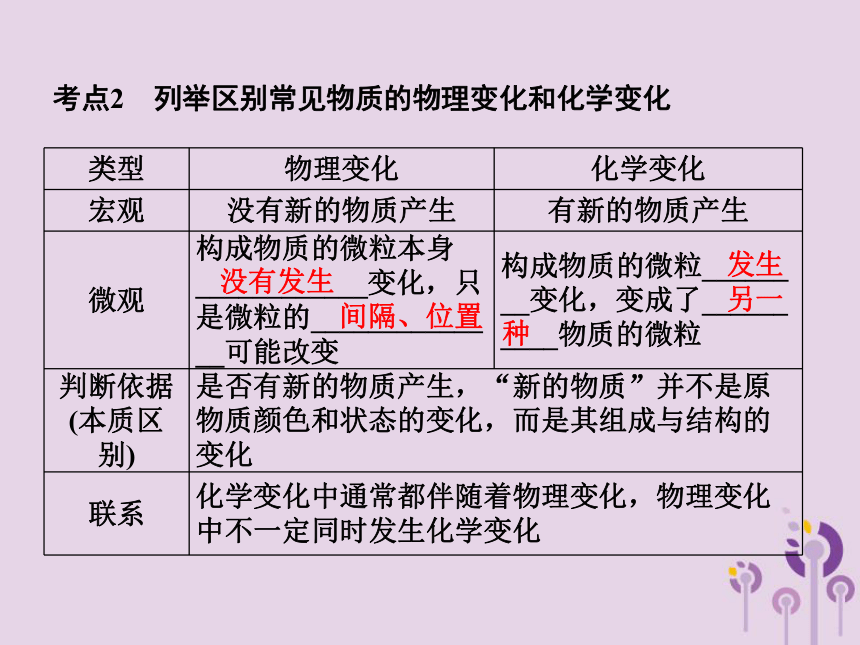
考点2 列举区别常见物质的物理变化和化学变化
类型 物理变化 化学变化
宏观 没有新的物质产生 有新的物质产生
微观 构成物质的微粒本身____________变化,只是微粒的____________ __可能改变 构成物质的微粒______ __变化,变成了______ ____物质的微粒
判断依据(本质区别) 是否有新的物质产生,“新的物质”并不是原物质颜色和状态的变化,而是其组成与结构的变化
联系 化学变化中通常都伴随着物理变化,物理变化中不一定同时发生化学变化
【注意】 ①化学变化的实质:构成物质的微粒__________ __,形成新的微粒。
②爆炸不一定是化学变化,也可能是物理变化,如火药爆炸属于化学变化,但轮胎爆炸、锅炉爆炸属于物理变化。
重新组合
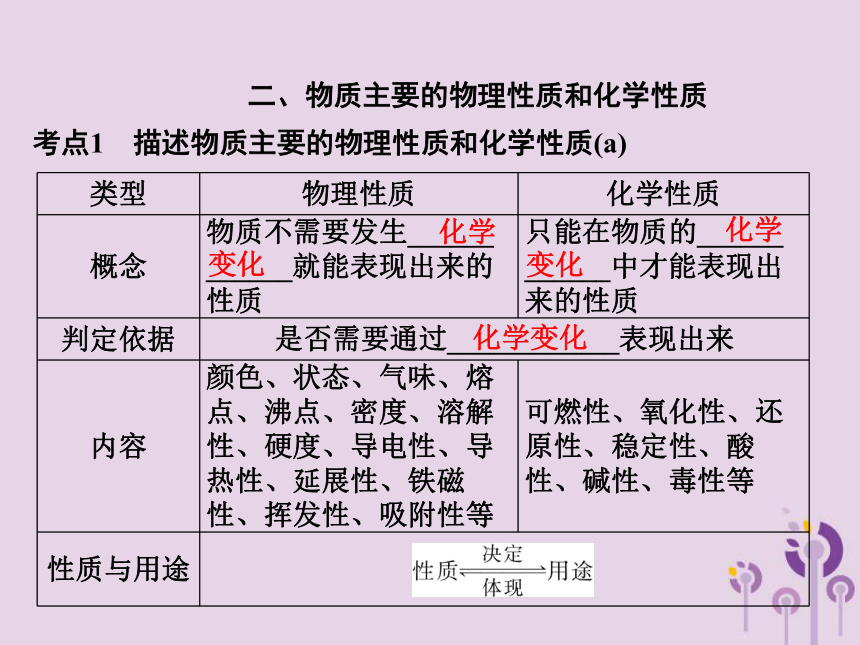
二、物质主要的物理性质和化学性质
考点1 描述物质主要的物理性质和化学性质(a)
化学
变化
化学
变化
化学变化
类型 物理性质 化学性质
概念 物质不需要发生______ ______就能表现出来的性质 只能在物质的______ ______中才能表现出来的性质
判定依据 是否需要通过____________表现出来
内容 颜色、状态、气味、熔点、沸点、密度、溶解性、硬度、导电性、导热性、延展性、铁磁性、挥发性、吸附性等 可燃性、氧化性、还原性、稳定性、酸性、碱性、毒性等
性质与用途
考点2 举例说明外界条件(如温度、压强等)能影响物质的性质
(b)
1.外界条件能影响物质的物理性质,如随着________的变化,水会在固、液、气三态之间变化。
2.物质的溶解性也会受到压强、温度等因素的影响等。
温度
考点3 用物质的有关性质解释自然界和生活中的有关现象(b)
考点4 说出物质的密度、比热容、熔点、沸点、导电性、溶解性、酸碱性等主要性质的含义,并能辨认它们是物理性质还是化学性质(b)
三、饱和溶液和不饱和溶液、溶解度、溶解度表
考点1 说出饱和溶液的概念(a)
在一定温度下,在一定量的溶剂里________继续溶解某种溶质的溶液,称为这种溶质的____________,还能继续溶解某种溶质的溶液,称为这种溶质的______________。
【注意】 必须要指明前提条件“____________”和“______ __________”,饱和溶液和不饱和溶液才有意义;饱和溶液是对______________而言的,对这种溶质饱和,对其他溶质不一定饱和。
不能
饱和溶液
不饱和溶液
一定温度
一定
量的溶剂
一定的溶质
考点2 知道浓溶液、稀溶液、饱和溶液、不饱和溶液的联系、
区别和转化(b)
1.判断溶液是否饱和的方法
(1)在条件(________、____________)不变时,继续向溶液中加入这种溶质,观察是否溶解,若不再溶解则为________溶液;反之,则为__________溶液。
(2)一定条件下,若溶液中有未溶解的溶质,则该溶液一定是这种溶质的________溶液。
(3)降低温度或蒸发溶剂,析出某溶质的晶体后所得的溶液一定为这种溶质的________溶液。
温度
溶剂的量
饱和
不饱和
饱和
饱和
2.溶液的浓或稀与是否饱和没有必然联系。浓溶液__________是饱和溶液,稀溶液__________是不饱和溶液。对于同种溶质和溶剂的溶液来说,在一定温度下的饱和溶液________比不饱和溶液浓。
不一定
不一定
一定
3.饱和溶液与不饱和溶液的转化
(1)对于大多数溶解度随温度升高而 ________的物质:
(2)对于Ca(OH)2等溶解度随温度升高而减小的物质:
增大
1.________物质的溶解性与物质的________(内因)有关,还与________(外因)有关。不同物质在相同的温度变化范围内,其溶解性变化差异也很大,如食盐在水中的溶解性比氢氧化钙大;大多数物质的溶解性随温度升高而增大。
2.________物质在水中的溶解性除温度的影响外,________的影响也很大。
一般情况下,气体溶解性随温度升高而________,随压强增大而________。
3.物质溶解时常常伴随吸、放热现象
________(溶液温度升高):如氢氧化钠;
________(溶液温度降低):如硝酸铵;
________________:如氯化钠。
固体
性质
温度
气体
压强
减小
增大
放热
吸热
没有明显变化
1.定义
在______________下,某物质在____________中达到______ __状态时所溶解的________为该物质在这种溶剂里的溶解度。
【注意】 满足以下四点,才能构成溶解度的完整概念。
(1)条件:“一定的温度”,讨论溶解度时必须指明温度。
(2)标准:“100g溶剂”,一定温度下,物质溶解的多少与溶剂的量是成正比的,规定100g溶剂这个统一标准才有可比性。如不注明,溶剂通常指水。
一定的温度
100g溶剂
饱和
质量
(3)状态:“达到饱和状态”,就是指物质的溶解达到最大限度。
(4)单位:“溶解的质量”,溶解度是有单位的,单位是克。
2.在一定温度下,溶解度的表达式:
四、外界条件对物质性质的影响
考点 了解温度对物质的溶解度的影响(a)
固体与极少数液体的溶解度受外界温度条件影响,气体的溶解度还受压强影响。
类型一 判断物质的变化和性质
典例 [2017·泰安]科学的发展为人类提供了更多的生活、生产资料,下面做法利用了化学变化的是 ( )
A.工业上用空气冷冻分离法得到氧气、氮气
B.工匠熔化玻璃吹制各种容器
C.大棚蔬菜生产施用二氧化碳气体提高产量
D.海员蒸馏海水获取淡水
C
跟踪训练 [2017·广州]下列物质的性质和用途表述没有直接联系的是 ( )
C
选项 性质 用途
A 活性炭有吸附性 脱色制白糖
B 小苏打能与盐酸反应 治疗胃酸过多
C 碳酸氢铵受热易分解 作化肥
D CO具有还原性 工业炼铁
类型二 根据条件分析饱和溶液与不饱和溶液
典例 [2017·绍兴改编]某次蔗糖溶解实验过程如图所示,不考虑水分蒸发,下列判断错误的是 ( )
A.②中溶液是饱和溶液
B.③中溶液一定是不饱和溶液
C.②③中蔗糖溶解度不相同
D.③中溶液的溶质质量大于②中溶液的溶质质量
B
【解析】 ③中溶液可能是饱和溶液,也可能是不饱和溶液;溶解度受温度影响,②③中温度不同,溶解度不同;②中的溶质比③中的溶质少,但溶剂的质量相同。
跟踪训练 [2019·预测]要使一定量20℃时的氢氧化钙饱和溶液的浓度发生改变,可采取的措施有 ( )
①降低温度至10℃ ②升高温度至30℃ ③加入2g氢氧化钙 ④加入2g水 ⑤蒸发掉2g水,再恢复到20℃ ⑥加入20℃的氢氧化钙饱和溶液2g
A.①②③④⑤ B.①④⑤
C.②④ D.全部
C
类型三 了解溶解度
典例 [2016·舟山改编]表中是不同温度时硝酸钾的溶解度,下列有关说法正确的是 ( )
A. 20℃时,100g水中溶解的硝酸钾越多溶解度就越大
B.40℃时,100g硝酸钾饱和溶液中含有硝酸钾63.9g
C.100℃的水能溶解的硝酸钾一定比80℃的水能溶解的硝酸 钾多
D.溶剂质量一定时,0℃的硝酸钾饱和溶液一定比60℃的硝 酸钾饱和溶液溶解的溶质少
D
温度(℃) 0 20 40 60 80 100
溶解度(g) 13.3 31.6 63.9 110 169 246
【解析】 20℃时,硝酸钾的溶解度是一定的,是100g水中最多能溶解硝酸钾的质量;40℃时,163.9g硝酸钾饱和溶液中才含有硝酸钾63.9g;因为没有说明水的质量,所以100℃的水能溶解的硝酸钾不一定比80℃的水能溶解的硝酸钾多。
跟踪训练 [2017·泰安改编]t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图甲所示,硝酸钾和氯化钾的溶解度曲线如图乙所示,则下列说法正确的是 ( )
D
A.烧杯①的溶液一定是不饱和溶液
B.烧杯①的溶液是硝酸钾溶液
C.若烧杯②的溶液升温到t2℃时,烧杯底部还有部分物质不溶解
D.若将烧杯①和烧杯②的溶液都升温到t2℃时,溶液中溶质的
质量相等
【解析】 烧杯①的底部没有固体剩余,则溶液可能是不饱和溶液;t1℃时,烧杯①中物质的溶解度大于烧杯②中物质的溶解度,所以烧杯①的溶液是氯化钾溶液;t2℃时,烧杯②中物质的溶解度大于t1℃时烧杯①物质的溶解度,故烧杯②中物质也会全部溶解,此时两烧杯的溶液中溶质的质量相等。
【点悟】 明确溶解度概念的四要素(一定的温度、100g溶剂、达到饱和状态、溶解的质量)对于解决溶解度的题目非常关键。要会通过溶解度表格或者曲线获取其变化规律,并从中判断饱和溶液与不饱和溶液之间的转化。
不了解“变化是过程,性质是能力”的区别致错
典例 我们生活在不断变化的物质世界中,我们尝试研究物质在变化中体现的性质,请你根据描述填序号。
物理性质:__________。化学性质:__________。
物理变化:__________。化学变化:__________。
①冰雪融化;②指南针指引航海;③酒精易挥发;④氢气能作燃料;⑤食物变质;⑥铁容易生锈;⑦百炼成钢;⑧云的形成;⑨黄金硬度大;⑩石墨可作电极;?干冰可用于人工降雨;?煤气会使人中毒;?敞口放置的浓盐酸瓶口产生白雾;?铵态氮肥与碱共热放出有刺激性气味的气体。
【错解】变化与性质填写混乱
【析错】不理解物理变化、化学变化是一个过程,整个过程称之为“某某变化”。而性质是在变化中体现出来的能力。不需要化学变化就能表现出来的能力属于物理性质,如颜色、气味等。在化学变化中表现出来的性质属化学性质,如可燃性、酸碱性等。通常用“易”“可”“能”“会”等表现能力的词语形容。
【正解】③⑨⑩? ④⑥? ①②⑧? ⑤⑦?
跟踪训练 某同学对一瓶酒精进行了认真观察和实验,在查阅资料后,得到下列材料:
①酒精是一种无色透明、具有特殊气味、易挥发的液体;
②酒精在空气里燃烧,发出淡蓝色的火焰,同时放出大量的热;
③能溶解多种有机物,是常见的溶剂;
④酒精可代替汽油作燃料;
⑤水浴加热酒精对叶片进行脱色处理;
⑥用无水硫酸铜粉末检验酒精中是否含有水;
⑦点燃酒精,酒精在灯芯处汽化后发生燃烧,生成二氧化碳和水。
(1)以上属于描述酒精物理性质的是________;属于描述化学性质的是_____。
(2)填写变化类型(选填“物理”或“化学”):
水浴加热酒精对叶片进行脱色处理是________变化;
用无水硫酸铜粉末检验酒精中是否含有水是________变化。
①③
④
物理
化学
溶解度曲线答题技巧
溶解度的表示方法常用溶解度表格和溶解度曲线。这里着重讨论溶解度曲线。
在溶解度曲线答题中,我们往往会遇到一条、两条甚至更多条曲线。任何一条溶解度曲线都包含着许多相关信息,如:溶解度、温度、溶质质量、饱和溶液与不饱和溶液之间的相互转化等。如何透过溶解度曲线提炼出重点,使得复杂问题简单化,抽象问题具体化?现就溶解度曲线进行分类型讨论,重点弄清图像中的交点、各条线段(含横、纵坐标)的含义、曲线的走向,挖掘图像中的隐含条件,找出解题的突破口。
类型一 一条曲线
1.溶解度的判定
过任一温度作垂直于横坐标轴的直线,直线与曲线的交点对应的纵坐标即为该物质在该温度下的溶解度。
如图中a点表示:在30℃时,该物质的溶解度为25g。
2.溶液饱和与不饱和的判定
以溶解度曲线为界限,曲线上方部分代表该物质的过饱和溶液,曲线下方部分代表该物质的不饱和溶液,曲线上各点表示该物质的饱和溶液。
如图中c点表示:在70℃时,该物质的不饱和溶液;d点表示在70℃时,该物质的过饱和溶液;a、b分别是相应温度下,该物质的饱和溶液。
3.溶质、溶剂及溶液质量的计算
根据溶液的质量=溶剂的质量+溶质的质量(完全溶解的溶质质量),进行质量计算。
如图中a点表示:在30℃时,溶液质量=100g+25g=125g。
类型二 两条曲线
1.交点的含义
交点表示两物质在对应温度下的溶解度相等。
如图中a点的含义:在20℃时,甲、乙两物质的溶解度相等,都为30g。
2.同一温度下,物质之间溶解度大小的比较
同一温度下,位于上方的曲线所对应物质的溶解度大于下方曲线所对应物质的溶解度。
如图0~20℃时,乙的曲线在甲的上方,溶解度大小为甲<乙;大于20 ℃时,乙的曲线在甲的下方,溶解度大小为甲>乙;20℃时,甲、乙两曲线相交,此时溶解度大小为甲=乙。
3.降低相同温度,物质析出晶体多少的比较
溶解度随温度升高而增大的物质,其饱和溶液降温会析出晶体。在100g溶剂中所形成的饱和溶液,降温析出晶体的质量即为其对应纵坐标数值之差。
如图在40℃时,甲、乙两物质分别溶解于100g水中形成饱和溶液,当温度均降至20℃时,析出晶体的质量甲>乙。甲析出晶体的质量为50g-30g=20g,乙析出晶体的质量为40g-30g=10g。
类型三 三条曲线
1.溶解度受温度影响的变化趋势
从左向右看溶解度曲线的坡度及走向,通常分为向上、向下及平缓三种。因而,常见物质的溶解度曲线可分为:
①陡升型,表示物质的溶解度随温度
升高而显著增大,如图中甲;
②缓升型,表示物质的溶解度随温度升
高而缓慢增大,如图中乙;
③下降型,表示物质的溶解度随温度
升高而减小,如图中丙。
2.饱和溶液与不饱和溶液的转化方法
对于甲、乙类溶解度随温度升高而增大的物质:
对于丙类溶解度随温度升高而减小的物质:
3.物质提纯或结晶的方法
①曲线为陡升型,如提纯甲时利用的是降温结晶(或冷却热饱和溶液)的方法;
②曲线为缓升型,如提纯乙时利用的是蒸发溶剂的方法;
③曲线为下降型,如提纯丙时利用的是升温结晶的方法。
如何去除甲晶体中混有的少量乙:将混合物溶于水→蒸发浓缩(无晶体析出)→冷却结晶→过滤;
如何去除乙晶体中混有的少量甲:将混合物溶于水→蒸发浓缩至大量晶体析出→趁热过滤(得到晶体)。
4.温度变化后,溶液相关质量的变化判定
温度变化后,溶液中相关质量的变化判定方法:
根据溶解度曲线判断温度变化时是否有晶体析出,随后详情如表所示:
溶质质量 溶剂质量 溶液质量
无晶体析出 不变 不变 不变
有晶体析出 减少 不变 减少
典例 [2017·广东]如图为四种物质的溶解度曲线,则下列说法错误的是 ( )
D
C.在10℃时把NH4H2PO4和Ce2(SO4)3的饱和溶液升温到30℃,有晶体析出的是Ce2(SO4)3
D.22℃时,100g(NH4)2HPO4饱和溶液中,溶质质量约为70g
A.当温度为10℃时,物质溶解度关系为①>③>②>④
B.若NH4H2PO4中混有少量NaCl杂质,可在较高温度配成饱和溶液,再降温结晶
【解析】 通过分析溶解度曲线可知,当温度为10℃时,物质溶解度关系为①>③>②>④;NH4H2PO4的溶解度受温度变化影响较大,所以NH4H2PO4中混有少量NaCl杂质,可在较高温度配成饱和溶液,再降温结晶;Ce2(SO4)3的溶解度随温度的升高而减小,所以在10℃时把NH4H2PO4和Ce2(SO4)3的饱和溶液升温到30℃,有晶体析出的是Ce2(SO4)3;由图知,22℃时,(NH4)2HPO4的溶解度约是70g,所以170g(NH4)2HPO4饱和溶液中,溶质的质量才应该约为70g。
第一单元 物质的性质
主题1 常见的物质
1.[2018·重庆B卷] “川航3U8633”的成功迫降,挽救了128条生命。迫降过程中属于化学变化的是 ( )
A.玻璃破裂 B.轮胎变瘪
C.燃油燃烧 D.座椅摇晃
2.[东营中考]下列用途利用了物质物理性质的是 ( )
A.木炭用作吸附剂 B.生石灰用作干燥剂
C.氧气用作助燃剂 D.氮气用作保护气
C
A
3.[2017·苏州模拟]t℃时,有两瓶硝酸钾溶液,一瓶为饱和溶液(溶质质量分数为40%),另一瓶为10%的溶液。下列实验操作无法区分这两种溶液的是 ( )
A.加一定量的水 B.加入少量硝酸钾晶体
C.适当降低温度 D.t℃时,蒸发少量水
A
4.[2018·枣庄改编]溶解度是定量表示物质溶解性的一种方法。图中给出了三种物质的溶解度曲线,下列说法不正确的是 ( )
A.60℃时,三种物质中溶解度
最大的是硫酸铵
B.三种物质的溶解度均随温度升
高而增大
C.t℃时,将30g氯化铵加入50g水
中,最终得到饱和溶液
D.80℃时氯化钾和氯化铵的饱和溶液分别降温至20℃,析 出晶体的质量后者大
D
【解析】 由于初始饱和溶液的质量关系不确定,因此无法比较
析出晶体质量的大小。
5.[2017·绍兴模拟改编]溶液是生产生活中常见的物质,依据相关信息回答问题。
资料:硝酸钾的溶解度数据(部分数据已作取整数处理)如表所示:
现有①、②、③、④四个烧杯,烧杯中分别盛有100g水。在40℃时,向四个烧杯中分别加入110g、86g、64g、32g硝酸钾,充分溶解,如图所示。
(1)______(填序号)烧杯中盛的是不饱和溶液。
(2)烧杯①、②、③中溶解的硝酸钾质量大小关系为_____。
A.三者一样大 B.①最大 C.③最小 D.无法判断
④
A
① ② ③ ④
温度(℃) 10 20 30 40 50 60 70
溶解度(g) 21 32 46 64 86 110 138
一、物质的物理变化和化学变化
考点1 描述物理变化和化学变化(a)
1.物理变化:物质只发生颜色、状态等变化,而没有产生____ ________的变化。如滴水成冰、冰雪消融、水分蒸发、铁丝变细、灯泡发光、轮胎爆炸等。
物理变化多表现为状态、形状等的变化。
2.化学变化:物质在发生变化后有____________产生。如钢铁锈蚀、食物腐烂、燃料燃烧、燃放烟花、酿酒等。
化学变化常伴随变色、生成气体、产生沉淀等现象以及吸热、放热、发光等能量变化。
新
的物质
新的物质
没有发生
间隔、位置
发生
另一
种
考点2 列举区别常见物质的物理变化和化学变化
类型 物理变化 化学变化
宏观 没有新的物质产生 有新的物质产生
微观 构成物质的微粒本身____________变化,只是微粒的____________ __可能改变 构成物质的微粒______ __变化,变成了______ ____物质的微粒
判断依据(本质区别) 是否有新的物质产生,“新的物质”并不是原物质颜色和状态的变化,而是其组成与结构的变化
联系 化学变化中通常都伴随着物理变化,物理变化中不一定同时发生化学变化
【注意】 ①化学变化的实质:构成物质的微粒__________ __,形成新的微粒。
②爆炸不一定是化学变化,也可能是物理变化,如火药爆炸属于化学变化,但轮胎爆炸、锅炉爆炸属于物理变化。
重新组合
二、物质主要的物理性质和化学性质
考点1 描述物质主要的物理性质和化学性质(a)
化学
变化
化学
变化
化学变化
类型 物理性质 化学性质
概念 物质不需要发生______ ______就能表现出来的性质 只能在物质的______ ______中才能表现出来的性质
判定依据 是否需要通过____________表现出来
内容 颜色、状态、气味、熔点、沸点、密度、溶解性、硬度、导电性、导热性、延展性、铁磁性、挥发性、吸附性等 可燃性、氧化性、还原性、稳定性、酸性、碱性、毒性等
性质与用途
考点2 举例说明外界条件(如温度、压强等)能影响物质的性质
(b)
1.外界条件能影响物质的物理性质,如随着________的变化,水会在固、液、气三态之间变化。
2.物质的溶解性也会受到压强、温度等因素的影响等。
温度
考点3 用物质的有关性质解释自然界和生活中的有关现象(b)
考点4 说出物质的密度、比热容、熔点、沸点、导电性、溶解性、酸碱性等主要性质的含义,并能辨认它们是物理性质还是化学性质(b)
三、饱和溶液和不饱和溶液、溶解度、溶解度表
考点1 说出饱和溶液的概念(a)
在一定温度下,在一定量的溶剂里________继续溶解某种溶质的溶液,称为这种溶质的____________,还能继续溶解某种溶质的溶液,称为这种溶质的______________。
【注意】 必须要指明前提条件“____________”和“______ __________”,饱和溶液和不饱和溶液才有意义;饱和溶液是对______________而言的,对这种溶质饱和,对其他溶质不一定饱和。
不能
饱和溶液
不饱和溶液
一定温度
一定
量的溶剂
一定的溶质
考点2 知道浓溶液、稀溶液、饱和溶液、不饱和溶液的联系、
区别和转化(b)
1.判断溶液是否饱和的方法
(1)在条件(________、____________)不变时,继续向溶液中加入这种溶质,观察是否溶解,若不再溶解则为________溶液;反之,则为__________溶液。
(2)一定条件下,若溶液中有未溶解的溶质,则该溶液一定是这种溶质的________溶液。
(3)降低温度或蒸发溶剂,析出某溶质的晶体后所得的溶液一定为这种溶质的________溶液。
温度
溶剂的量
饱和
不饱和
饱和
饱和
2.溶液的浓或稀与是否饱和没有必然联系。浓溶液__________是饱和溶液,稀溶液__________是不饱和溶液。对于同种溶质和溶剂的溶液来说,在一定温度下的饱和溶液________比不饱和溶液浓。
不一定
不一定
一定
3.饱和溶液与不饱和溶液的转化
(1)对于大多数溶解度随温度升高而 ________的物质:
(2)对于Ca(OH)2等溶解度随温度升高而减小的物质:
增大
1.________物质的溶解性与物质的________(内因)有关,还与________(外因)有关。不同物质在相同的温度变化范围内,其溶解性变化差异也很大,如食盐在水中的溶解性比氢氧化钙大;大多数物质的溶解性随温度升高而增大。
2.________物质在水中的溶解性除温度的影响外,________的影响也很大。
一般情况下,气体溶解性随温度升高而________,随压强增大而________。
3.物质溶解时常常伴随吸、放热现象
________(溶液温度升高):如氢氧化钠;
________(溶液温度降低):如硝酸铵;
________________:如氯化钠。
固体
性质
温度
气体
压强
减小
增大
放热
吸热
没有明显变化
1.定义
在______________下,某物质在____________中达到______ __状态时所溶解的________为该物质在这种溶剂里的溶解度。
【注意】 满足以下四点,才能构成溶解度的完整概念。
(1)条件:“一定的温度”,讨论溶解度时必须指明温度。
(2)标准:“100g溶剂”,一定温度下,物质溶解的多少与溶剂的量是成正比的,规定100g溶剂这个统一标准才有可比性。如不注明,溶剂通常指水。
一定的温度
100g溶剂
饱和
质量
(3)状态:“达到饱和状态”,就是指物质的溶解达到最大限度。
(4)单位:“溶解的质量”,溶解度是有单位的,单位是克。
2.在一定温度下,溶解度的表达式:
四、外界条件对物质性质的影响
考点 了解温度对物质的溶解度的影响(a)
固体与极少数液体的溶解度受外界温度条件影响,气体的溶解度还受压强影响。
类型一 判断物质的变化和性质
典例 [2017·泰安]科学的发展为人类提供了更多的生活、生产资料,下面做法利用了化学变化的是 ( )
A.工业上用空气冷冻分离法得到氧气、氮气
B.工匠熔化玻璃吹制各种容器
C.大棚蔬菜生产施用二氧化碳气体提高产量
D.海员蒸馏海水获取淡水
C
跟踪训练 [2017·广州]下列物质的性质和用途表述没有直接联系的是 ( )
C
选项 性质 用途
A 活性炭有吸附性 脱色制白糖
B 小苏打能与盐酸反应 治疗胃酸过多
C 碳酸氢铵受热易分解 作化肥
D CO具有还原性 工业炼铁
类型二 根据条件分析饱和溶液与不饱和溶液
典例 [2017·绍兴改编]某次蔗糖溶解实验过程如图所示,不考虑水分蒸发,下列判断错误的是 ( )
A.②中溶液是饱和溶液
B.③中溶液一定是不饱和溶液
C.②③中蔗糖溶解度不相同
D.③中溶液的溶质质量大于②中溶液的溶质质量
B
【解析】 ③中溶液可能是饱和溶液,也可能是不饱和溶液;溶解度受温度影响,②③中温度不同,溶解度不同;②中的溶质比③中的溶质少,但溶剂的质量相同。
跟踪训练 [2019·预测]要使一定量20℃时的氢氧化钙饱和溶液的浓度发生改变,可采取的措施有 ( )
①降低温度至10℃ ②升高温度至30℃ ③加入2g氢氧化钙 ④加入2g水 ⑤蒸发掉2g水,再恢复到20℃ ⑥加入20℃的氢氧化钙饱和溶液2g
A.①②③④⑤ B.①④⑤
C.②④ D.全部
C
类型三 了解溶解度
典例 [2016·舟山改编]表中是不同温度时硝酸钾的溶解度,下列有关说法正确的是 ( )
A. 20℃时,100g水中溶解的硝酸钾越多溶解度就越大
B.40℃时,100g硝酸钾饱和溶液中含有硝酸钾63.9g
C.100℃的水能溶解的硝酸钾一定比80℃的水能溶解的硝酸 钾多
D.溶剂质量一定时,0℃的硝酸钾饱和溶液一定比60℃的硝 酸钾饱和溶液溶解的溶质少
D
温度(℃) 0 20 40 60 80 100
溶解度(g) 13.3 31.6 63.9 110 169 246
【解析】 20℃时,硝酸钾的溶解度是一定的,是100g水中最多能溶解硝酸钾的质量;40℃时,163.9g硝酸钾饱和溶液中才含有硝酸钾63.9g;因为没有说明水的质量,所以100℃的水能溶解的硝酸钾不一定比80℃的水能溶解的硝酸钾多。
跟踪训练 [2017·泰安改编]t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图甲所示,硝酸钾和氯化钾的溶解度曲线如图乙所示,则下列说法正确的是 ( )
D
A.烧杯①的溶液一定是不饱和溶液
B.烧杯①的溶液是硝酸钾溶液
C.若烧杯②的溶液升温到t2℃时,烧杯底部还有部分物质不溶解
D.若将烧杯①和烧杯②的溶液都升温到t2℃时,溶液中溶质的
质量相等
【解析】 烧杯①的底部没有固体剩余,则溶液可能是不饱和溶液;t1℃时,烧杯①中物质的溶解度大于烧杯②中物质的溶解度,所以烧杯①的溶液是氯化钾溶液;t2℃时,烧杯②中物质的溶解度大于t1℃时烧杯①物质的溶解度,故烧杯②中物质也会全部溶解,此时两烧杯的溶液中溶质的质量相等。
【点悟】 明确溶解度概念的四要素(一定的温度、100g溶剂、达到饱和状态、溶解的质量)对于解决溶解度的题目非常关键。要会通过溶解度表格或者曲线获取其变化规律,并从中判断饱和溶液与不饱和溶液之间的转化。
不了解“变化是过程,性质是能力”的区别致错
典例 我们生活在不断变化的物质世界中,我们尝试研究物质在变化中体现的性质,请你根据描述填序号。
物理性质:__________。化学性质:__________。
物理变化:__________。化学变化:__________。
①冰雪融化;②指南针指引航海;③酒精易挥发;④氢气能作燃料;⑤食物变质;⑥铁容易生锈;⑦百炼成钢;⑧云的形成;⑨黄金硬度大;⑩石墨可作电极;?干冰可用于人工降雨;?煤气会使人中毒;?敞口放置的浓盐酸瓶口产生白雾;?铵态氮肥与碱共热放出有刺激性气味的气体。
【错解】变化与性质填写混乱
【析错】不理解物理变化、化学变化是一个过程,整个过程称之为“某某变化”。而性质是在变化中体现出来的能力。不需要化学变化就能表现出来的能力属于物理性质,如颜色、气味等。在化学变化中表现出来的性质属化学性质,如可燃性、酸碱性等。通常用“易”“可”“能”“会”等表现能力的词语形容。
【正解】③⑨⑩? ④⑥? ①②⑧? ⑤⑦?
跟踪训练 某同学对一瓶酒精进行了认真观察和实验,在查阅资料后,得到下列材料:
①酒精是一种无色透明、具有特殊气味、易挥发的液体;
②酒精在空气里燃烧,发出淡蓝色的火焰,同时放出大量的热;
③能溶解多种有机物,是常见的溶剂;
④酒精可代替汽油作燃料;
⑤水浴加热酒精对叶片进行脱色处理;
⑥用无水硫酸铜粉末检验酒精中是否含有水;
⑦点燃酒精,酒精在灯芯处汽化后发生燃烧,生成二氧化碳和水。
(1)以上属于描述酒精物理性质的是________;属于描述化学性质的是_____。
(2)填写变化类型(选填“物理”或“化学”):
水浴加热酒精对叶片进行脱色处理是________变化;
用无水硫酸铜粉末检验酒精中是否含有水是________变化。
①③
④
物理
化学
溶解度曲线答题技巧
溶解度的表示方法常用溶解度表格和溶解度曲线。这里着重讨论溶解度曲线。
在溶解度曲线答题中,我们往往会遇到一条、两条甚至更多条曲线。任何一条溶解度曲线都包含着许多相关信息,如:溶解度、温度、溶质质量、饱和溶液与不饱和溶液之间的相互转化等。如何透过溶解度曲线提炼出重点,使得复杂问题简单化,抽象问题具体化?现就溶解度曲线进行分类型讨论,重点弄清图像中的交点、各条线段(含横、纵坐标)的含义、曲线的走向,挖掘图像中的隐含条件,找出解题的突破口。
类型一 一条曲线
1.溶解度的判定
过任一温度作垂直于横坐标轴的直线,直线与曲线的交点对应的纵坐标即为该物质在该温度下的溶解度。
如图中a点表示:在30℃时,该物质的溶解度为25g。
2.溶液饱和与不饱和的判定
以溶解度曲线为界限,曲线上方部分代表该物质的过饱和溶液,曲线下方部分代表该物质的不饱和溶液,曲线上各点表示该物质的饱和溶液。
如图中c点表示:在70℃时,该物质的不饱和溶液;d点表示在70℃时,该物质的过饱和溶液;a、b分别是相应温度下,该物质的饱和溶液。
3.溶质、溶剂及溶液质量的计算
根据溶液的质量=溶剂的质量+溶质的质量(完全溶解的溶质质量),进行质量计算。
如图中a点表示:在30℃时,溶液质量=100g+25g=125g。
类型二 两条曲线
1.交点的含义
交点表示两物质在对应温度下的溶解度相等。
如图中a点的含义:在20℃时,甲、乙两物质的溶解度相等,都为30g。
2.同一温度下,物质之间溶解度大小的比较
同一温度下,位于上方的曲线所对应物质的溶解度大于下方曲线所对应物质的溶解度。
如图0~20℃时,乙的曲线在甲的上方,溶解度大小为甲<乙;大于20 ℃时,乙的曲线在甲的下方,溶解度大小为甲>乙;20℃时,甲、乙两曲线相交,此时溶解度大小为甲=乙。
3.降低相同温度,物质析出晶体多少的比较
溶解度随温度升高而增大的物质,其饱和溶液降温会析出晶体。在100g溶剂中所形成的饱和溶液,降温析出晶体的质量即为其对应纵坐标数值之差。
如图在40℃时,甲、乙两物质分别溶解于100g水中形成饱和溶液,当温度均降至20℃时,析出晶体的质量甲>乙。甲析出晶体的质量为50g-30g=20g,乙析出晶体的质量为40g-30g=10g。
类型三 三条曲线
1.溶解度受温度影响的变化趋势
从左向右看溶解度曲线的坡度及走向,通常分为向上、向下及平缓三种。因而,常见物质的溶解度曲线可分为:
①陡升型,表示物质的溶解度随温度
升高而显著增大,如图中甲;
②缓升型,表示物质的溶解度随温度升
高而缓慢增大,如图中乙;
③下降型,表示物质的溶解度随温度
升高而减小,如图中丙。
2.饱和溶液与不饱和溶液的转化方法
对于甲、乙类溶解度随温度升高而增大的物质:
对于丙类溶解度随温度升高而减小的物质:
3.物质提纯或结晶的方法
①曲线为陡升型,如提纯甲时利用的是降温结晶(或冷却热饱和溶液)的方法;
②曲线为缓升型,如提纯乙时利用的是蒸发溶剂的方法;
③曲线为下降型,如提纯丙时利用的是升温结晶的方法。
如何去除甲晶体中混有的少量乙:将混合物溶于水→蒸发浓缩(无晶体析出)→冷却结晶→过滤;
如何去除乙晶体中混有的少量甲:将混合物溶于水→蒸发浓缩至大量晶体析出→趁热过滤(得到晶体)。
4.温度变化后,溶液相关质量的变化判定
温度变化后,溶液中相关质量的变化判定方法:
根据溶解度曲线判断温度变化时是否有晶体析出,随后详情如表所示:
溶质质量 溶剂质量 溶液质量
无晶体析出 不变 不变 不变
有晶体析出 减少 不变 减少
典例 [2017·广东]如图为四种物质的溶解度曲线,则下列说法错误的是 ( )
D
C.在10℃时把NH4H2PO4和Ce2(SO4)3的饱和溶液升温到30℃,有晶体析出的是Ce2(SO4)3
D.22℃时,100g(NH4)2HPO4饱和溶液中,溶质质量约为70g
A.当温度为10℃时,物质溶解度关系为①>③>②>④
B.若NH4H2PO4中混有少量NaCl杂质,可在较高温度配成饱和溶液,再降温结晶
【解析】 通过分析溶解度曲线可知,当温度为10℃时,物质溶解度关系为①>③>②>④;NH4H2PO4的溶解度受温度变化影响较大,所以NH4H2PO4中混有少量NaCl杂质,可在较高温度配成饱和溶液,再降温结晶;Ce2(SO4)3的溶解度随温度的升高而减小,所以在10℃时把NH4H2PO4和Ce2(SO4)3的饱和溶液升温到30℃,有晶体析出的是Ce2(SO4)3;由图知,22℃时,(NH4)2HPO4的溶解度约是70g,所以170g(NH4)2HPO4饱和溶液中,溶质的质量才应该约为70g。
同课章节目录
