浙江省中考科学(化学部分)第二篇主题2第二单元物质的分类(课件 44张ppt)
文档属性
| 名称 | 浙江省中考科学(化学部分)第二篇主题2第二单元物质的分类(课件 44张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-03-10 11:40:49 | ||
图片预览








文档简介
第二单元 物质的分类
1.[2018·济宁]下列物质的分类,不正确的一组是 ( )
A.H2O、MgO、H2CO3 都属于氧化物
B.H2S、H2SO3、H2SO4 都属于酸
C.NaOH、Ca(OH)2、Fe(OH)2 都属于碱
D.NaCl、Na2CO3、NaHCO3 都属于盐
A
2.[北京中考]某同学制作的试剂标签如下,其中化学式书写不正确的是 ( )
B
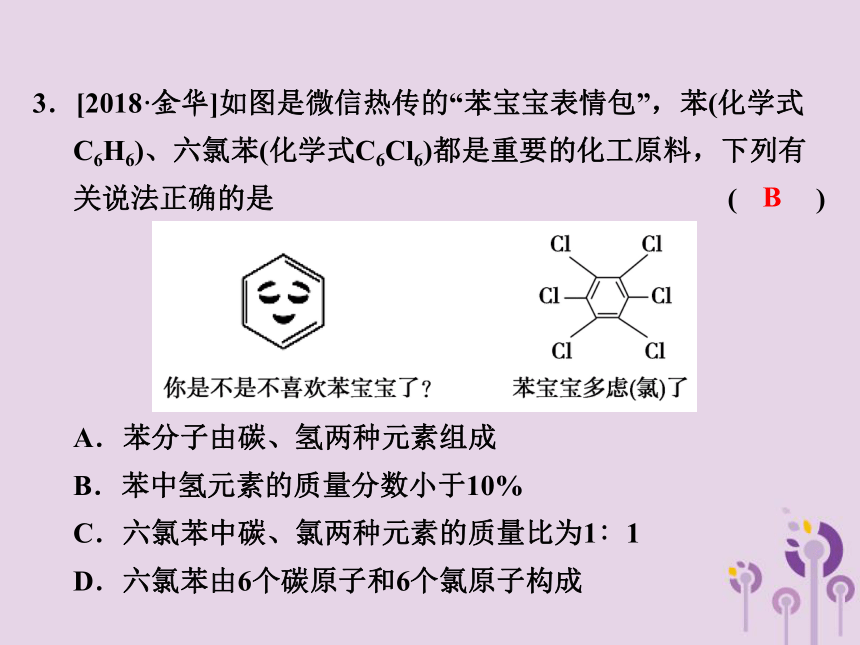
3.[2018·金华]如图是微信热传的“苯宝宝表情包”,苯(化学式C6H6)、六氯苯(化学式C6Cl6)都是重要的化工原料,下列有关说法正确的是 ( )
A.苯分子由碳、氢两种元素组成
B.苯中氢元素的质量分数小于10%
C.六氯苯中碳、氯两种元素的质量比为1∶1
D.六氯苯由6个碳原子和6个氯原子构成
B
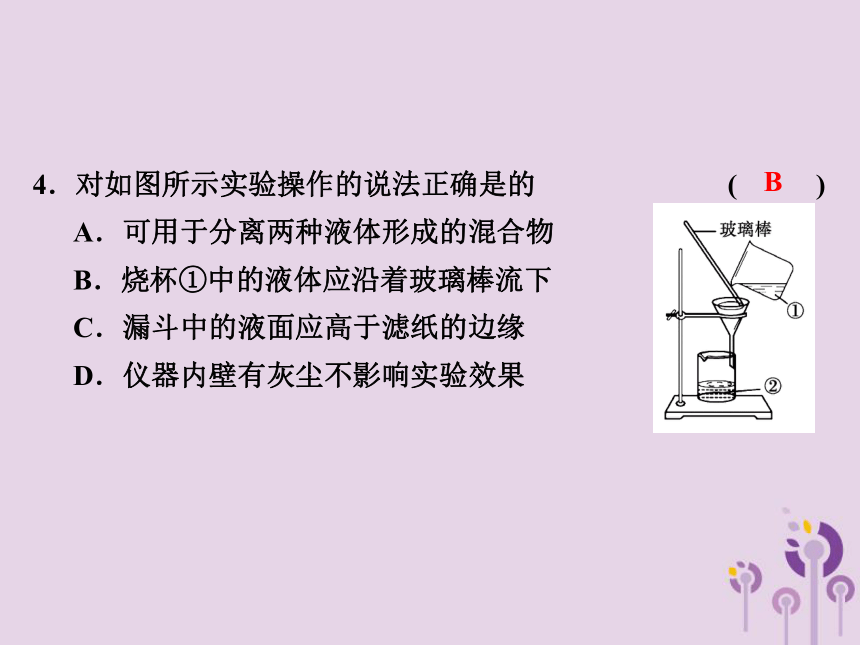
4.对如图所示实验操作的说法正确是的 ( )
A.可用于分离两种液体形成的混合物
B.烧杯①中的液体应沿着玻璃棒流下
C.漏斗中的液面应高于滤纸的边缘
D.仪器内壁有灰尘不影响实验效果
B
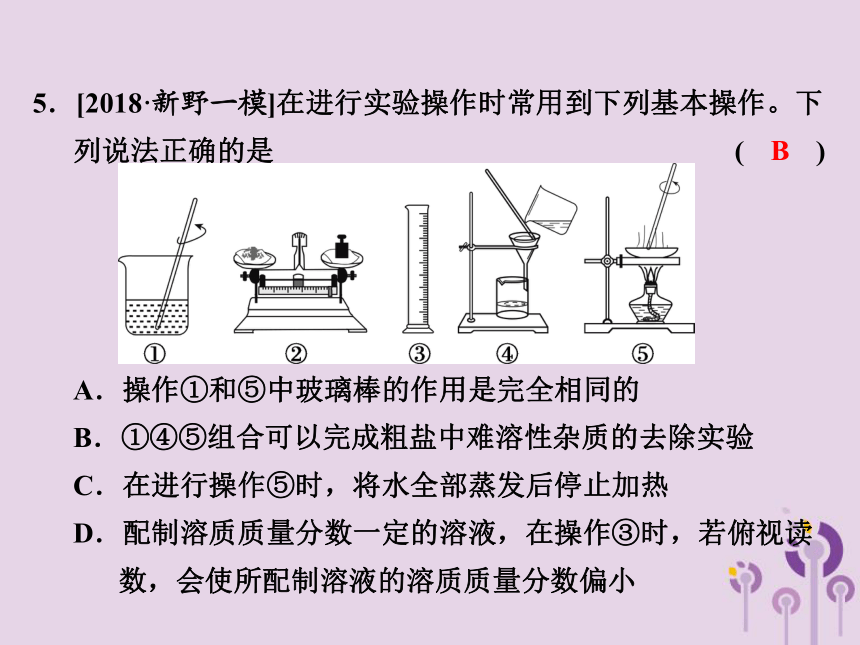
5.[2018·新野一模]在进行实验操作时常用到下列基本操作。下列说法正确的是 ( )
A.操作①和⑤中玻璃棒的作用是完全相同的
B.①④⑤组合可以完成粗盐中难溶性杂质的去除实验
C.在进行操作⑤时,将水全部蒸发后停止加热
D.配制溶质质量分数一定的溶液,在操作③时,若俯视读 数,会使所配制溶液的溶质质量分数偏小
B
6.[2017·广州]N(NO2)3是科学家近年发现的一种新型火箭燃料。下列关于N(NO2)3说法正确的是 ( )
A.N(NO2)3的相对分子质量为152
B.N(NO2)3中氮元素与氧元素的质量比是2∶3
C.N(NO2)3中总共有3个N原子和6个O原子
A
一、纯净物和混合物,混合物的分离
考点1 识别纯净物与混合物(b)
混合物与纯净物的区别与联系
多种物质
一种物质
混合物 纯净物
概念 由____________混合而成 由____________组成
区别 (1)含多种物质
(2)若物质由分子构成,则由两种或两种以上的不同分子构成
(3)没有固定的组成和性质 (1)只含一种物质
(2)若物质由分子构成,则只含一种分子
(3)有固定的组成和性质
联系
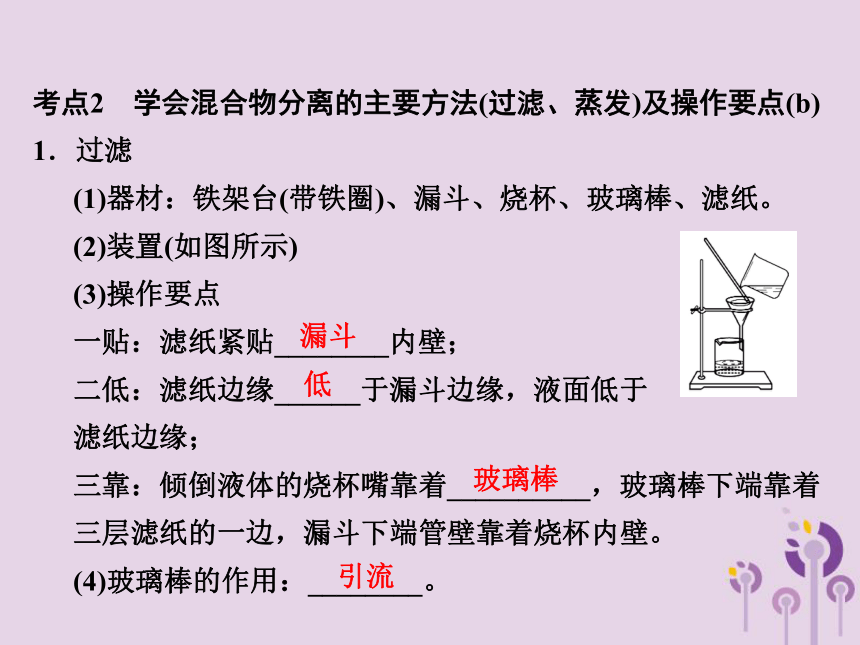
考点2 学会混合物分离的主要方法(过滤、蒸发)及操作要点(b)
1.过滤
(1)器材:铁架台(带铁圈)、漏斗、烧杯、玻璃棒、滤纸。
(2)装置(如图所示)
(3)操作要点
一贴:滤纸紧贴________内壁;
二低:滤纸边缘______于漏斗边缘,液面低于
滤纸边缘;
三靠:倾倒液体的烧杯嘴靠着__________,玻璃棒下端靠着三层滤纸的一边,漏斗下端管壁靠着烧杯内壁。
(4)玻璃棒的作用:________。
漏斗
低
玻璃棒
引流
过滤操作口诀
斗架烧杯玻璃棒,滤纸漏斗角一样;
过滤之前要静置,三靠二低莫要忘。
记忆卡片
2.蒸发实验操作
(1)仪器:三脚架(或带铁圈的铁架台)、蒸发皿、玻璃棒、酒精灯。
(2)注意事项:在蒸发过程中要不断搅拌,当出现大量固体时停止加热,剩余少量液体靠余热蒸干,但仍需不停搅拌,直至冷却。
(3)玻璃棒的作用是搅拌,防止液体飞溅。
考点3 比较不同的饮用水(矿泉水、纯净水、自来水)的净化方
法和主要特点(b)
1.自来水厂的水净化
自来水厂对从江河或水库等水源引来的水进行净化处理时,一般经过2个阶段。
①物理阶段:通过过滤和沉淀等方法除去水中的固体颗粒。
②化学阶段:通入氯气或漂白粉等杀死水中的微生物。
最后,经过化学检测,证明水是洁净的之后,这些水才被送到用户家中。
2.我们每天使用的自来水是经过自来水厂净化处理过的。在一些偏远山区,则利用明矾或活性炭吸附水中的悬浮杂质,使其凝聚成较大的固体颗粒而沉到水底。把上述已经处理过的水通过过滤器,再用具有吸附作用的固体过滤液体,浑浊的水变澄清了,但所得的水仍然不是纯水。通过蒸馏的方法,就可以得到纯净的水。
考点4 说明粗盐提纯的过程(b)
加
速溶解
实验内容和步骤 实验现象 解释和结论
1.粗盐溶解
(1)称量:在托盘天平上称取混入少量泥沙杂质的粗盐5g(注意:两托盘上放上质量相同的表面皿或小块纸片,调节零点)
(2)溶解
粗盐水中混有少量泥沙,盐水浑浊 用玻璃棒搅拌的目的是____ ________;溶解所得到的是氯化钠溶液
2.过滤
滤纸上有固体难溶性杂质,过滤后溶液变澄清 把难溶性的固态物质和液态物质分离开来可以用过滤的方法
3.蒸发
蒸发皿底部有白色固体析出 析出的晶体是氯化钠
4.固体食盐洗涤
用玻璃棒将固体食盐移入一个洁净的过滤器里,用饱和食盐水均匀冲洗 所得的精盐呈白色,颜色比粗盐浅 洗涤的目的是把固体食盐表面的可溶性杂质洗掉
二、化学式
考点1 能写出常见物质的化学式(b)
用元素符号来表示物质组成的式子叫做化学式。
记忆卡片
根据化合价写化学式口诀
一排顺序二标价,价数交叉写右下;
约简价数作角码,化合价规则去检查。
考点2 知道化学式所表示的含义(b)
化学式的含义
氢
氧
一个水分子
一个水分子由两
个氢原子和一个氧原子构成
化学式的含义 以H2O为例
宏观 ①表示一种物质 表示水这种物质
②表示该物质由哪种元素组成 表示水由______元素和______元素组成
微观 ①由分子构成的物质的化学式表示该物质的一个分子 表示______________
②由分子构成的物质的化学式表示构成物质的一个分子中所含的元素的原子个数或原子个数比 表示_________________ ___________________________
考点3 能根据化学式进行简单的计算(c)
1.物质中各元素的质量比=(A元素的相对原子质量×A元素的原子个数)∶(B元素的相对原子质量×B元素的原子个数)……
2.化合物中某元素的质量分数=
三、物质的分类
考点1 会运用物质组成的分类方法对常见物质进行分类(c)
考点2 能指认具体物质的类别(a)
四、相对原子质量、相对分子质量
考点1 会查阅相对原子质量(a)
考点2 根据化学式计算物质的相对分子质量(c)
相对分子质量的计算:
(1)在计算相对分子质量时,元素符号与数字之间需用“×”号,元素符号之间需用“+”号,如H2O的相对分子质量=1×2+16=18。
(2)化学式原子团右下角的数字表示其个数,计算时可先求出一个原子团的相对质量,再乘以其个数,如(NH4)2SO4的相对分子质量=(14+1×4)×2+32+16×4=132。
(3)结晶水合物中的“·”表示结合的含义,在计算结晶水合物的相对分子质量时应将“·”前后两部分的相对质量“加”在一起。如CuSO4·5H2O的相对分子质量=64+32+16×4+5×(1×2+16)=250。
【注意】
考点3 了解相对原子质量、相对分子质量的含义(a)
1.相对原子质量: ______________________________________ ____________________ 。相对原子质量与该原子的实际质量成正比。
2.相对分子质量:一个分子中各原子的相对原子质量总和。
原子的实际质量跟C-12原子质量的1/12
相比之后得出的比值
【考点延伸】
(1)相对原子质量只是一个比值,不是原子的实际质量。
(2)相对原子质量的单位为“1”,一般不写出。
(3)构成原子的粒子有质子、中子、电子,1个质子和1个中子的质量跟相对原子质量标准相比较,均约等于1。电子质量很小,跟质子和中子相比可以忽略不计,所以原子的质量主要集中在质子和中子(即原子核)上,故相对原子质量≈质子数+中子数。
类型一 纯净物、混合物的区分
典例 [宜昌中考改编]下列各图中,“●”和“○”分别表示两种不同元素的原子,其中表示混合物的是 ( )
A B C D
【解析】 由图示可知B中物质由三种分子构成,属于混合物。
B
跟踪训练 [荆州中考]下列物质中属于纯净物的是 ( )
A.洁净的空气
B.敞口长时间放置的NaOH固体
C.纯净的NaCl溶液
D.冰、水混合物
D
类型二 混合物的分离
典例 [天津中考]除去下列各物质中混有的少量杂质,所用除杂试剂及操作方法均正确的是 ( )
B
选项 物质 杂质 除杂试剂及操作方法
A 二氧化碳 一氧化碳 通入氧气,点燃
B 氢气 氯化氢 先通过过量氢氧化钠溶液,再通过过量浓硫酸
C 锌粉 铁粉 加入适量氯化锌溶液,充分反应后过滤
D 氯化钾溶液 碳酸钾 加入过量氯化钙溶液,充分反应后过滤
【解析】 除去二氧化碳中的一氧化碳不能通入氧气点燃,因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳不会燃烧,且除去气体中的气体杂质不能使用气体,否则会引入新的气体杂质;氯化氢能与氢氧化钠溶液反应生成氯化钠和水,氢气不与氢氧化钠溶液反应,再通过过量浓硫酸除去水分,能除去杂质且没有引入新的杂质,符合除杂原则;铁的活动性比锌弱,铁粉不能与氯化锌溶液反应,不能除去杂质;碳酸钾能与过量氯化钙溶液反应生成碳酸钙沉淀和氯化钾,能除去杂质,但引入了新的杂质氯化钙。
跟踪训练 [2017·长春模拟]下列物质的分离方法或操作,错误的
是 ( )
A.分离KCl和MnO2的混合物:加入足量的水,溶解、过滤、蒸发
B.分离过氧化氢制取氧气的剩余物,回收二氧化锰:过滤、干燥
C.分离KNO3和NaCl的混合物:溶于热水制成热饱和溶液,降温结晶后过滤
D.分离CO和CO2的混合气体:先通过足量氢氧化钠溶液,后滴加足量稀硫酸
C
【点悟】 提纯物质时应注意以下四点:①除去杂质的过程中不能引入新的杂质;②所选择的试剂一般只能与杂质反应,而不能与被提纯的物质反应;③反应的产物易分离,即操作简便易行;④若除杂质过程中被提纯的物质发生了化学反应,应复原为原物质。即不增(杂),不减(主),易分,复原。
类型三 粗盐提纯
典例 [重庆中考B卷]工业上用海水获取粗盐以及实验室用粗盐制得精盐都包含许多化学实验知识,分析以下过程后填写下列空白:
(1)操作Ⅰ的名称是________。
(2)海水晒盐与上述操作中________的原理相同。
(3)上述操作可能用到下列装置,装置B中仪器①的名称是_______,用甲制取淡水可选用装置______(填序号),装置A中玻璃棒的作用是_____________________。
溶解
蒸发
漏斗
C
搅拌,防止液体飞溅
【解析】 (1)粗盐中氯化钠易溶于水,泥沙难溶于水,故操作Ⅰ是溶解操作。(2)食盐的溶解度受温度的影响小,从海水中获得食盐主要利用阳光和风蒸发水分,使氯化钠结晶出来,利用了蒸发结晶的原理。(3)装置B中仪器①的名称是漏斗;甲是溶解之后得到的食盐水,用甲制取淡水可进行蒸馏,可选用装置C。
跟踪训练 [2017·南京秦淮区二模]“粗盐中难溶性杂质的去除”实验活动中,出现下列情况仍继续实验,有可能造成计算出的精盐产率偏低的是 ( )
①溶解步骤中,粗盐未充分溶解
②过滤步骤中,得到的滤液浑浊
③蒸发步骤中,有液滴飞溅现象
④蒸发步骤中,得到的固体潮湿
A.①③ B.③④ C.①② D.②④
A
类型四 了解物质的分类
典例 [株洲中考改编]化学概念在逻辑上存在如图所示关系时,对下列概念间的关系说法正确的是 ( )
①纯净物与混合物属于包含关系
②化合物与氧化物属于包含关系
③单质与化合物属于交叉关系
④酸、碱、盐属于并列关系
A.①② B.③④ C.①③ D.②④
D
跟踪训练 [2017·德州]分类是研究物质的常用方
法 。如图是纯净物、单质、化合物、氧化物之间
关系的形象表示,若整个大圈表示纯净物,则下
列物质属于Z范围的是 ( )
A.红磷 B.干冰
C.氯酸钾 D.食盐水
【解析】 物质包括混合物和纯净物,纯净物包括单质和化合物,化合物包括酸、碱、盐、氧化物,根据它们之间的包含关系分析。由图中信息可知,X属于单质;Y属于化合物;Z属于氧化物。红磷属于单质,干冰属于氧化物,氯酸钾属于化合物,食盐水属于混合物。
B
【点悟】 分类的标准不同,分类的结果不同。了解常见物质的类别。
类型五 掌握关于化学式的计算
典例 [2018·温州]茶叶中含有茶氨酸(C7H14O3N2), 茶氨酸中各元素质量分数如图所示。其中①表示的元素是 ( )
A.碳 B.氢
C.氧 D.氮
A
跟踪训练 苯(化学式:C6H6)是一种重要的有机溶剂,它的部分同系列物质如下:
(1)比较归纳是学好化学的重要方法,据表推断X的化学式为________。
(2)在C6H6中,C与H元素质量比为__________。
(3)156g C6H6中含碳元素多少克?(要求写出计算过程)
【点悟】 根据化学式计算元素的质量分数关键是理解物质的元素组成以及化学式中量的含义。
C8H10
12∶1
碳原子数 6 7 8 9 10
化学式 C6H6 C7H8 X C9H12 C10H14
对概念理解不清致错
典例 [2017·邯山模拟]经分析,某种物质只含有一种元素,则此物质 ( )
A.一定是一种单质 B.一定是纯净物
C.一定是化合物 D.可能是纯净物,可能是混合物
【错解】选A
【析错】上述解答错误在于把该物质只含有一种元素理解为一种物质。单质、化合物都是纯净物,同种元素可组成单质,也可组成混合物。
【正解】选D 某种物质只含一种元素,可能是单质,如O2等,
单质属于纯净物;也有可能是混合物,如O2和O3的混合物。
跟踪训练 [2018·宁波南三县模拟]下列物质分类组合中完全正确的是 ( )
B
碱 酸 盐 氧化物
A 纯碱 盐酸 烧碱 二氧化硫
B 烧碱 硫酸 纯碱 一氧化碳
C 苛性钠 醋酸 生石灰 水
D 熟石灰 硝酸 食盐 氨水
粗盐提纯
1.实验原理图
2.实验器材
烧杯、玻璃棒、铁架台(带铁圈)、酒精灯、漏斗、蒸发皿、量筒、托盘天平、坩埚钳等
3.实验关键点
实验过程中玻璃棒的作用:
溶解——搅拌,加速溶解
过滤——引流
蒸发——搅拌,防止局部温度过高,造成液滴或晶体飞溅
4.产率偏低的原因分析
(1)粗盐没有充分溶解;
(2)过滤时有滤液损失;
(3)蒸发时有液体溅出。
5.实验拓展
除去粗盐中的氯化镁、氯化钙、硫酸钠:
(1)实验思路:过量的NaOH可以将MgCl2除去;过量的BaCl2可以将Na2SO4除去;过量的Na2CO3可以将CaCl2除去。由于试剂过量,引入了新的杂质,其中BaCl2可以用Na2CO3除去,NaOH、Na2CO3可以用稀盐酸除去。
(2)实验步骤:粗盐加水溶解→过滤除去不溶或难溶性杂质→加入过量试剂(①过量BaCl2溶液→②过量Na2CO3溶液→③过量NaOH溶液)→过滤→加入适量稀盐酸→蒸发→(①②③试剂位置可以互换,但Na2CO3溶液必须在BaCl2溶液之后,否则过量的BaCl2无法除去)。
典例 (1)实验室除去粗盐中泥沙等难溶性杂质的实验步骤如下:
①操作Ⅰ的名称是________。
②蒸发过程中,当蒸发皿中出现____________时,停止加热,利用蒸发皿的余热使滤液蒸干。
(2)工业上制备粗盐时,通过晒盐或煮盐的方法,可以蒸发盐溶液中水分使之浓缩结晶,理由是______________________ ___________________________________________________________________。
(3)由于粗盐中含有少量CaCl2等杂质,不能满足化工生产的要求。因此必须将粗盐进行精制。若要除去粗盐中的CaCl2,所用的试剂为___________。
较多固体
氯化钠的溶解度受温度
影响不大,蒸发水分,不饱和溶液变成饱和溶液,继续蒸发,固体析出
Na2CO3
过滤
1.[2018·济宁]下列物质的分类,不正确的一组是 ( )
A.H2O、MgO、H2CO3 都属于氧化物
B.H2S、H2SO3、H2SO4 都属于酸
C.NaOH、Ca(OH)2、Fe(OH)2 都属于碱
D.NaCl、Na2CO3、NaHCO3 都属于盐
A
2.[北京中考]某同学制作的试剂标签如下,其中化学式书写不正确的是 ( )
B
3.[2018·金华]如图是微信热传的“苯宝宝表情包”,苯(化学式C6H6)、六氯苯(化学式C6Cl6)都是重要的化工原料,下列有关说法正确的是 ( )
A.苯分子由碳、氢两种元素组成
B.苯中氢元素的质量分数小于10%
C.六氯苯中碳、氯两种元素的质量比为1∶1
D.六氯苯由6个碳原子和6个氯原子构成
B
4.对如图所示实验操作的说法正确是的 ( )
A.可用于分离两种液体形成的混合物
B.烧杯①中的液体应沿着玻璃棒流下
C.漏斗中的液面应高于滤纸的边缘
D.仪器内壁有灰尘不影响实验效果
B
5.[2018·新野一模]在进行实验操作时常用到下列基本操作。下列说法正确的是 ( )
A.操作①和⑤中玻璃棒的作用是完全相同的
B.①④⑤组合可以完成粗盐中难溶性杂质的去除实验
C.在进行操作⑤时,将水全部蒸发后停止加热
D.配制溶质质量分数一定的溶液,在操作③时,若俯视读 数,会使所配制溶液的溶质质量分数偏小
B
6.[2017·广州]N(NO2)3是科学家近年发现的一种新型火箭燃料。下列关于N(NO2)3说法正确的是 ( )
A.N(NO2)3的相对分子质量为152
B.N(NO2)3中氮元素与氧元素的质量比是2∶3
C.N(NO2)3中总共有3个N原子和6个O原子
A
一、纯净物和混合物,混合物的分离
考点1 识别纯净物与混合物(b)
混合物与纯净物的区别与联系
多种物质
一种物质
混合物 纯净物
概念 由____________混合而成 由____________组成
区别 (1)含多种物质
(2)若物质由分子构成,则由两种或两种以上的不同分子构成
(3)没有固定的组成和性质 (1)只含一种物质
(2)若物质由分子构成,则只含一种分子
(3)有固定的组成和性质
联系
考点2 学会混合物分离的主要方法(过滤、蒸发)及操作要点(b)
1.过滤
(1)器材:铁架台(带铁圈)、漏斗、烧杯、玻璃棒、滤纸。
(2)装置(如图所示)
(3)操作要点
一贴:滤纸紧贴________内壁;
二低:滤纸边缘______于漏斗边缘,液面低于
滤纸边缘;
三靠:倾倒液体的烧杯嘴靠着__________,玻璃棒下端靠着三层滤纸的一边,漏斗下端管壁靠着烧杯内壁。
(4)玻璃棒的作用:________。
漏斗
低
玻璃棒
引流
过滤操作口诀
斗架烧杯玻璃棒,滤纸漏斗角一样;
过滤之前要静置,三靠二低莫要忘。
记忆卡片
2.蒸发实验操作
(1)仪器:三脚架(或带铁圈的铁架台)、蒸发皿、玻璃棒、酒精灯。
(2)注意事项:在蒸发过程中要不断搅拌,当出现大量固体时停止加热,剩余少量液体靠余热蒸干,但仍需不停搅拌,直至冷却。
(3)玻璃棒的作用是搅拌,防止液体飞溅。
考点3 比较不同的饮用水(矿泉水、纯净水、自来水)的净化方
法和主要特点(b)
1.自来水厂的水净化
自来水厂对从江河或水库等水源引来的水进行净化处理时,一般经过2个阶段。
①物理阶段:通过过滤和沉淀等方法除去水中的固体颗粒。
②化学阶段:通入氯气或漂白粉等杀死水中的微生物。
最后,经过化学检测,证明水是洁净的之后,这些水才被送到用户家中。
2.我们每天使用的自来水是经过自来水厂净化处理过的。在一些偏远山区,则利用明矾或活性炭吸附水中的悬浮杂质,使其凝聚成较大的固体颗粒而沉到水底。把上述已经处理过的水通过过滤器,再用具有吸附作用的固体过滤液体,浑浊的水变澄清了,但所得的水仍然不是纯水。通过蒸馏的方法,就可以得到纯净的水。
考点4 说明粗盐提纯的过程(b)
加
速溶解
实验内容和步骤 实验现象 解释和结论
1.粗盐溶解
(1)称量:在托盘天平上称取混入少量泥沙杂质的粗盐5g(注意:两托盘上放上质量相同的表面皿或小块纸片,调节零点)
(2)溶解
粗盐水中混有少量泥沙,盐水浑浊 用玻璃棒搅拌的目的是____ ________;溶解所得到的是氯化钠溶液
2.过滤
滤纸上有固体难溶性杂质,过滤后溶液变澄清 把难溶性的固态物质和液态物质分离开来可以用过滤的方法
3.蒸发
蒸发皿底部有白色固体析出 析出的晶体是氯化钠
4.固体食盐洗涤
用玻璃棒将固体食盐移入一个洁净的过滤器里,用饱和食盐水均匀冲洗 所得的精盐呈白色,颜色比粗盐浅 洗涤的目的是把固体食盐表面的可溶性杂质洗掉
二、化学式
考点1 能写出常见物质的化学式(b)
用元素符号来表示物质组成的式子叫做化学式。
记忆卡片
根据化合价写化学式口诀
一排顺序二标价,价数交叉写右下;
约简价数作角码,化合价规则去检查。
考点2 知道化学式所表示的含义(b)
化学式的含义
氢
氧
一个水分子
一个水分子由两
个氢原子和一个氧原子构成
化学式的含义 以H2O为例
宏观 ①表示一种物质 表示水这种物质
②表示该物质由哪种元素组成 表示水由______元素和______元素组成
微观 ①由分子构成的物质的化学式表示该物质的一个分子 表示______________
②由分子构成的物质的化学式表示构成物质的一个分子中所含的元素的原子个数或原子个数比 表示_________________ ___________________________
考点3 能根据化学式进行简单的计算(c)
1.物质中各元素的质量比=(A元素的相对原子质量×A元素的原子个数)∶(B元素的相对原子质量×B元素的原子个数)……
2.化合物中某元素的质量分数=
三、物质的分类
考点1 会运用物质组成的分类方法对常见物质进行分类(c)
考点2 能指认具体物质的类别(a)
四、相对原子质量、相对分子质量
考点1 会查阅相对原子质量(a)
考点2 根据化学式计算物质的相对分子质量(c)
相对分子质量的计算:
(1)在计算相对分子质量时,元素符号与数字之间需用“×”号,元素符号之间需用“+”号,如H2O的相对分子质量=1×2+16=18。
(2)化学式原子团右下角的数字表示其个数,计算时可先求出一个原子团的相对质量,再乘以其个数,如(NH4)2SO4的相对分子质量=(14+1×4)×2+32+16×4=132。
(3)结晶水合物中的“·”表示结合的含义,在计算结晶水合物的相对分子质量时应将“·”前后两部分的相对质量“加”在一起。如CuSO4·5H2O的相对分子质量=64+32+16×4+5×(1×2+16)=250。
【注意】
考点3 了解相对原子质量、相对分子质量的含义(a)
1.相对原子质量: ______________________________________ ____________________ 。相对原子质量与该原子的实际质量成正比。
2.相对分子质量:一个分子中各原子的相对原子质量总和。
原子的实际质量跟C-12原子质量的1/12
相比之后得出的比值
【考点延伸】
(1)相对原子质量只是一个比值,不是原子的实际质量。
(2)相对原子质量的单位为“1”,一般不写出。
(3)构成原子的粒子有质子、中子、电子,1个质子和1个中子的质量跟相对原子质量标准相比较,均约等于1。电子质量很小,跟质子和中子相比可以忽略不计,所以原子的质量主要集中在质子和中子(即原子核)上,故相对原子质量≈质子数+中子数。
类型一 纯净物、混合物的区分
典例 [宜昌中考改编]下列各图中,“●”和“○”分别表示两种不同元素的原子,其中表示混合物的是 ( )
A B C D
【解析】 由图示可知B中物质由三种分子构成,属于混合物。
B
跟踪训练 [荆州中考]下列物质中属于纯净物的是 ( )
A.洁净的空气
B.敞口长时间放置的NaOH固体
C.纯净的NaCl溶液
D.冰、水混合物
D
类型二 混合物的分离
典例 [天津中考]除去下列各物质中混有的少量杂质,所用除杂试剂及操作方法均正确的是 ( )
B
选项 物质 杂质 除杂试剂及操作方法
A 二氧化碳 一氧化碳 通入氧气,点燃
B 氢气 氯化氢 先通过过量氢氧化钠溶液,再通过过量浓硫酸
C 锌粉 铁粉 加入适量氯化锌溶液,充分反应后过滤
D 氯化钾溶液 碳酸钾 加入过量氯化钙溶液,充分反应后过滤
【解析】 除去二氧化碳中的一氧化碳不能通入氧气点燃,因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳不会燃烧,且除去气体中的气体杂质不能使用气体,否则会引入新的气体杂质;氯化氢能与氢氧化钠溶液反应生成氯化钠和水,氢气不与氢氧化钠溶液反应,再通过过量浓硫酸除去水分,能除去杂质且没有引入新的杂质,符合除杂原则;铁的活动性比锌弱,铁粉不能与氯化锌溶液反应,不能除去杂质;碳酸钾能与过量氯化钙溶液反应生成碳酸钙沉淀和氯化钾,能除去杂质,但引入了新的杂质氯化钙。
跟踪训练 [2017·长春模拟]下列物质的分离方法或操作,错误的
是 ( )
A.分离KCl和MnO2的混合物:加入足量的水,溶解、过滤、蒸发
B.分离过氧化氢制取氧气的剩余物,回收二氧化锰:过滤、干燥
C.分离KNO3和NaCl的混合物:溶于热水制成热饱和溶液,降温结晶后过滤
D.分离CO和CO2的混合气体:先通过足量氢氧化钠溶液,后滴加足量稀硫酸
C
【点悟】 提纯物质时应注意以下四点:①除去杂质的过程中不能引入新的杂质;②所选择的试剂一般只能与杂质反应,而不能与被提纯的物质反应;③反应的产物易分离,即操作简便易行;④若除杂质过程中被提纯的物质发生了化学反应,应复原为原物质。即不增(杂),不减(主),易分,复原。
类型三 粗盐提纯
典例 [重庆中考B卷]工业上用海水获取粗盐以及实验室用粗盐制得精盐都包含许多化学实验知识,分析以下过程后填写下列空白:
(1)操作Ⅰ的名称是________。
(2)海水晒盐与上述操作中________的原理相同。
(3)上述操作可能用到下列装置,装置B中仪器①的名称是_______,用甲制取淡水可选用装置______(填序号),装置A中玻璃棒的作用是_____________________。
溶解
蒸发
漏斗
C
搅拌,防止液体飞溅
【解析】 (1)粗盐中氯化钠易溶于水,泥沙难溶于水,故操作Ⅰ是溶解操作。(2)食盐的溶解度受温度的影响小,从海水中获得食盐主要利用阳光和风蒸发水分,使氯化钠结晶出来,利用了蒸发结晶的原理。(3)装置B中仪器①的名称是漏斗;甲是溶解之后得到的食盐水,用甲制取淡水可进行蒸馏,可选用装置C。
跟踪训练 [2017·南京秦淮区二模]“粗盐中难溶性杂质的去除”实验活动中,出现下列情况仍继续实验,有可能造成计算出的精盐产率偏低的是 ( )
①溶解步骤中,粗盐未充分溶解
②过滤步骤中,得到的滤液浑浊
③蒸发步骤中,有液滴飞溅现象
④蒸发步骤中,得到的固体潮湿
A.①③ B.③④ C.①② D.②④
A
类型四 了解物质的分类
典例 [株洲中考改编]化学概念在逻辑上存在如图所示关系时,对下列概念间的关系说法正确的是 ( )
①纯净物与混合物属于包含关系
②化合物与氧化物属于包含关系
③单质与化合物属于交叉关系
④酸、碱、盐属于并列关系
A.①② B.③④ C.①③ D.②④
D
跟踪训练 [2017·德州]分类是研究物质的常用方
法 。如图是纯净物、单质、化合物、氧化物之间
关系的形象表示,若整个大圈表示纯净物,则下
列物质属于Z范围的是 ( )
A.红磷 B.干冰
C.氯酸钾 D.食盐水
【解析】 物质包括混合物和纯净物,纯净物包括单质和化合物,化合物包括酸、碱、盐、氧化物,根据它们之间的包含关系分析。由图中信息可知,X属于单质;Y属于化合物;Z属于氧化物。红磷属于单质,干冰属于氧化物,氯酸钾属于化合物,食盐水属于混合物。
B
【点悟】 分类的标准不同,分类的结果不同。了解常见物质的类别。
类型五 掌握关于化学式的计算
典例 [2018·温州]茶叶中含有茶氨酸(C7H14O3N2), 茶氨酸中各元素质量分数如图所示。其中①表示的元素是 ( )
A.碳 B.氢
C.氧 D.氮
A
跟踪训练 苯(化学式:C6H6)是一种重要的有机溶剂,它的部分同系列物质如下:
(1)比较归纳是学好化学的重要方法,据表推断X的化学式为________。
(2)在C6H6中,C与H元素质量比为__________。
(3)156g C6H6中含碳元素多少克?(要求写出计算过程)
【点悟】 根据化学式计算元素的质量分数关键是理解物质的元素组成以及化学式中量的含义。
C8H10
12∶1
碳原子数 6 7 8 9 10
化学式 C6H6 C7H8 X C9H12 C10H14
对概念理解不清致错
典例 [2017·邯山模拟]经分析,某种物质只含有一种元素,则此物质 ( )
A.一定是一种单质 B.一定是纯净物
C.一定是化合物 D.可能是纯净物,可能是混合物
【错解】选A
【析错】上述解答错误在于把该物质只含有一种元素理解为一种物质。单质、化合物都是纯净物,同种元素可组成单质,也可组成混合物。
【正解】选D 某种物质只含一种元素,可能是单质,如O2等,
单质属于纯净物;也有可能是混合物,如O2和O3的混合物。
跟踪训练 [2018·宁波南三县模拟]下列物质分类组合中完全正确的是 ( )
B
碱 酸 盐 氧化物
A 纯碱 盐酸 烧碱 二氧化硫
B 烧碱 硫酸 纯碱 一氧化碳
C 苛性钠 醋酸 生石灰 水
D 熟石灰 硝酸 食盐 氨水
粗盐提纯
1.实验原理图
2.实验器材
烧杯、玻璃棒、铁架台(带铁圈)、酒精灯、漏斗、蒸发皿、量筒、托盘天平、坩埚钳等
3.实验关键点
实验过程中玻璃棒的作用:
溶解——搅拌,加速溶解
过滤——引流
蒸发——搅拌,防止局部温度过高,造成液滴或晶体飞溅
4.产率偏低的原因分析
(1)粗盐没有充分溶解;
(2)过滤时有滤液损失;
(3)蒸发时有液体溅出。
5.实验拓展
除去粗盐中的氯化镁、氯化钙、硫酸钠:
(1)实验思路:过量的NaOH可以将MgCl2除去;过量的BaCl2可以将Na2SO4除去;过量的Na2CO3可以将CaCl2除去。由于试剂过量,引入了新的杂质,其中BaCl2可以用Na2CO3除去,NaOH、Na2CO3可以用稀盐酸除去。
(2)实验步骤:粗盐加水溶解→过滤除去不溶或难溶性杂质→加入过量试剂(①过量BaCl2溶液→②过量Na2CO3溶液→③过量NaOH溶液)→过滤→加入适量稀盐酸→蒸发→(①②③试剂位置可以互换,但Na2CO3溶液必须在BaCl2溶液之后,否则过量的BaCl2无法除去)。
典例 (1)实验室除去粗盐中泥沙等难溶性杂质的实验步骤如下:
①操作Ⅰ的名称是________。
②蒸发过程中,当蒸发皿中出现____________时,停止加热,利用蒸发皿的余热使滤液蒸干。
(2)工业上制备粗盐时,通过晒盐或煮盐的方法,可以蒸发盐溶液中水分使之浓缩结晶,理由是______________________ ___________________________________________________________________。
(3)由于粗盐中含有少量CaCl2等杂质,不能满足化工生产的要求。因此必须将粗盐进行精制。若要除去粗盐中的CaCl2,所用的试剂为___________。
较多固体
氯化钠的溶解度受温度
影响不大,蒸发水分,不饱和溶液变成饱和溶液,继续蒸发,固体析出
Na2CO3
过滤
同课章节目录
