人教版九年级上册第三单元物质构成的奥秘复习课件(25张PPT)
文档属性
| 名称 | 人教版九年级上册第三单元物质构成的奥秘复习课件(25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 620.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-11 17:38:28 | ||
图片预览






文档简介
第三单元 物质构成的奥秘
复习课
复习目标
1、梳理知识,掌握知识点间的内在联系,从
宏观到微观对物质的组成和构成加深理解,培养学生对基础知识的理解、应用、分析与综合的能力。
2、能用微粒的观点解释某些常见的现象
3、对有关分子、原子、离子的知识加深理解
在此基础上,形成系统的解题方法和思路。
构
成
分
裂
得失电
子
得失电
子
物
质
纯净物
混合物
分子
原子
离子
结构
原子核
核外电子
质子
中子
原子结构示意图
质量表示方法
相对原子质量
阳离子
阴离子
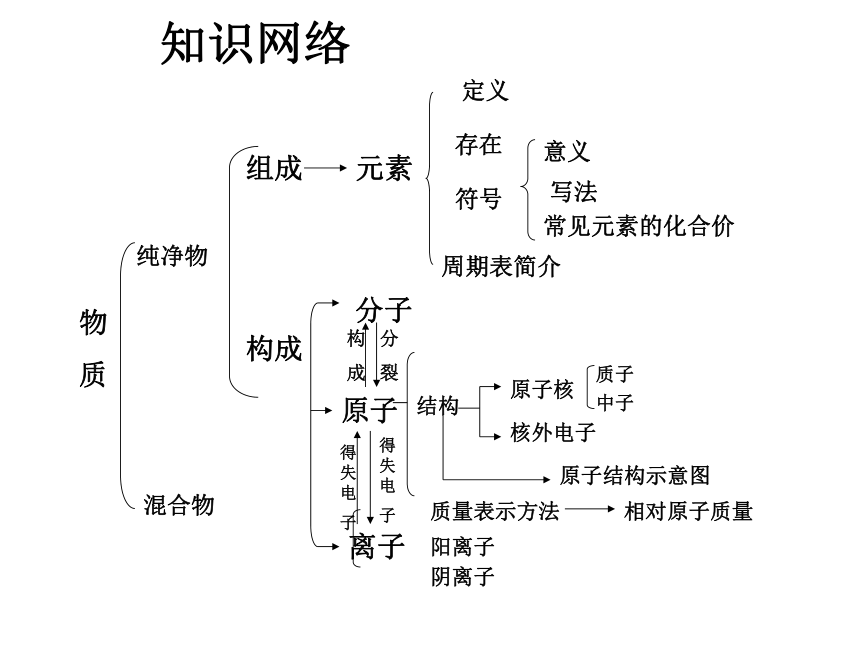
组成
构成
元素
周期表简介
定义
存在
意义
写法
常见元素的化合价
符号
知识网络
物质
分子
构 成
离子
构 成
原子
构
成
构 成
组 成
元素
总 称
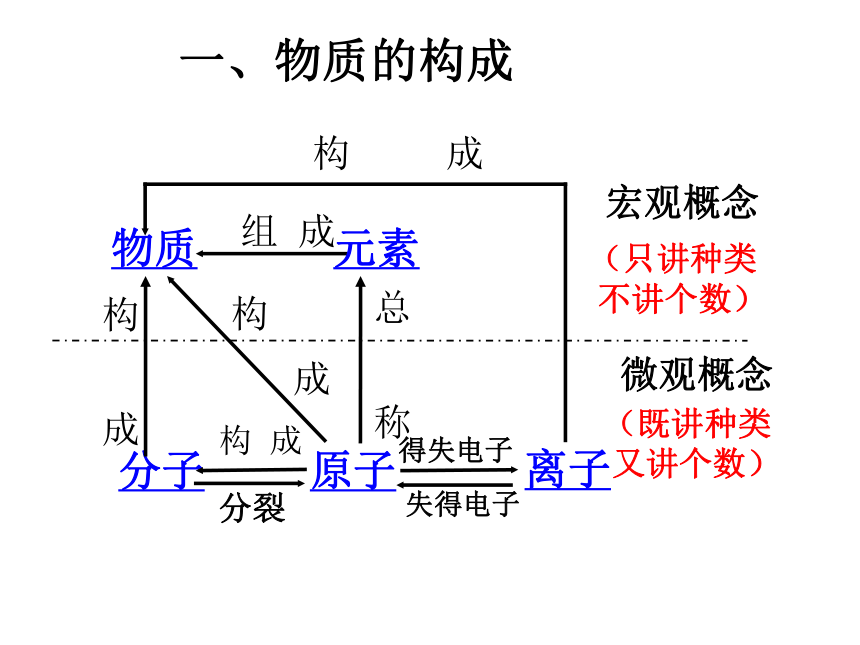
宏观概念
微观概念
(只讲种类
不讲个数)
(既讲种类
又讲个数)
分裂
得失电子
失得电子
一、物质的构成
1、分子的基本性质
①分子体积、质量很小
②分子在不断运动
③分子间有间隔
温度越高,分子能量越大,分子运动速率就越快
通常状况,
气体分子间隙>液体分子间隙>固体分子间隙
一、构成物质的微粒-分子
2、分子与物质变化的关系
物理变化——分子本身不发生改变;
化学变化——分子本身发生改变,生成新的分子
3、分子的定义:
由分子构成的物质,分子是保持物质的化学性质
的最小粒子(分子相同,性质相同)
4、化学反应的本质
一、构成物质的微粒-分子
分解
重新组合
新物质的分子
原物质的分子
原子
1、吸烟有害健康,非吸烟者往往会因吸烟者吸烟而造成被动吸烟,这是因为( )
A、分子在不断运动 B、分子之间有间隔
C、分子的体积很小 D、分子的质量很小
2、将50 mL水与50 mL酒精混合,所得溶液体积小于100 mL,对此现象的解释最科学的是( )
A、分子之间有间隔 B、分子是不断运动的
C、分子具有一定的质量 D、分子是由原子构成的
3.保持过氧化氢化学性质的最小粒子是( )
A.氧气分子和氢气分子 B.水分子
C.氢原子和氧原子 D.过氧化氢分子
A
A
小试牛刀
D
延伸:
原子是构成物质的另一种微粒。原子构成分子,原子可以直接构成物质
1、原子——是化学变化中的最小微粒。
“最小”指在化学反应中不能再分。
2、原子的特征
①原子的体积和质量很小。
②原子在不断的运动。
③原子间有间隔。
分子与原子的主要区别:
在化学变化中,分子可分,而原子不可分;
分子可变,而原子不可变
二、构成物质的微粒-原子
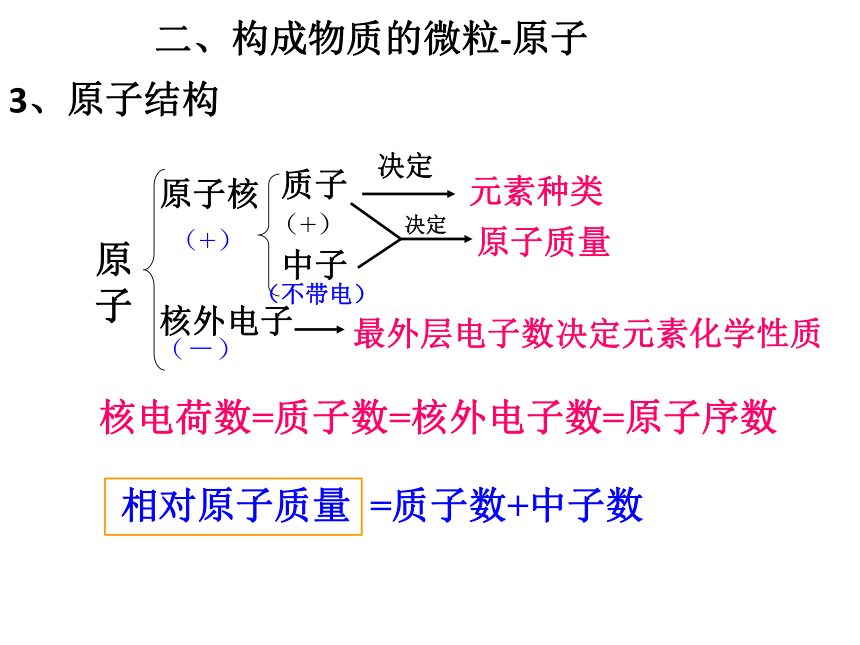
原子核
核外电子
质子
中子
决定
元素种类
最外层电子数决定元素化学性质
决定
原子质量
(+)
(-)
(+)
(不带电)
核电荷数=质子数=核外电子数=原子序数
相对原子质量 =质子数+中子数
原子
3、原子结构
二、构成物质的微粒-原子
电子层
该电子层上的电子数
原子核
核内质子数
(核电荷数)
Na原子结构示意图
二、构成物质的微粒-原子
4、原子结构示意图
元素的
分类 最外层电子数 得失电子趋势 化学性质 结论
一般小于4
易失去电子
一般大于4
易得到电子
活泼
等于8(氦等于2)
稳定结构
稳定
元素的化学性质与原子最外层电子数关系密切
金属元素
非金属
元素
稀有气
体元素
二、构成物质的微粒-原子
5、元素的化学性质与原子最外层电子的关系
①核电荷数=质子数=电子数(原子)
②核电荷数=质子数≠电子数(离子)
③相对原子质量≈质子数+中子数
④元素种类由质子数决定,
⑤元素化学性质主要由最外层电子数决定,
⑥元素的相对原子质量由质子数和中子数之和决定。
二、构成物质的微粒-原子
6、归纳小结:
4、原子序数为94的钚(Pu)是一种核原料,该元素一种原子的质子数和中子数之和为239,下列关于该原子的说法不正确的是( )
A.中子数为145
B.核外电子数为94
C.质子数为94
D.核电荷数为239
D
5、下列四种粒子的结构示意图中,表示金属元素原子的是( )
B
1、定义:带电的原子或原子团叫做离子。
2、离子形成的过程
三、离子
原子:
2
1
8
+11
Na
2
7
8
+17
Cl
离子:
失一个电子
得一个电子
+11
2
8
Na+
8
2
8
+17
Cl-
Na+
Cl-
4、离子符号里的数字的意义:
2Mg2+
表示2个镁离子
表示每个镁离子带2个单位的正电荷
3、离子符号的意义:
离子符号
表示一种离子
表示一个离子
三、离子
原子
阳离子
(+)
阴离子
(-)
失电子
得电子
失电子
得电子
原子中:质子数=电子数(原子不带电)
阳离子中:质子数>电子数(带正电)
阴离子中:质子数<电子数(带负电)
5、原子和离子的区别和联系
三、离子
1、构成物质的微粒有:分子、原子和离子
2、由原子构成的物质:金属单质(Fe、Cu),稀有气体(He、Ne),固态非金属(C、S)
3、由分子构成的物质:非金属氧化物(CO2、H2O2),气态单质(O2、H2)
4、由离子构成的物质:酸碱盐以及金属氧化物
归纳小结
1、定义:质子数(即核电荷数)相同的一类原子的总称
注意事项:
①“一类原子”指的化学变化中不能再分的粒子
②原子的质子数(即核电荷数)决定元素种类
③
元素——是一类原子的总称,只能讲种类,不能讲个数。
原子——是一种粒子,有种类、个数
四、元素
2、地壳中含量较多的几种元素
含量前五位:氧、硅、铝、铁、钙
四、元素
3、元素符号书写的要求:
①由一个字母表示的元素符号要大写;
②由两个字母表示的元素符号,第一个字母大写 ,第二个字母小写
四、元素
4、元素符号表示的意义
元素符号
注意事项:在元素符号前的系数,只表示原子的个数,失去宏观意义,不再表示元素。
宏观:表示一种元素
微观:表示该元素的一个原子
5、元素与原子的区别和联系
区别:
联系:
元素用于描述物质的宏观组成;只讲种类,不讲个数
原子用于描述物质的微观构成;既讲种类,又讲个数
①、元素概念建立在原子基础上;
②、原子的核电荷数(即核内质子数)决定了元素的种类,原子的最外层电子数决定了元素的化学性质
四、元素
1、周期:每一个横行称为一个周期。
2、族:每一个纵行称为一个族。
3、原子序数=核电荷数=核内质子数=核外电子数
五、元素周期表
26 Fe
铁
55.847
元素名称
相对原子质量
原子序数(核电荷数)
元素符号
4、元素周期表所能提供的信息
五、元素周期表
业精于勤,荒于嬉;行成于思,毁于随。——韩愈
复习课
复习目标
1、梳理知识,掌握知识点间的内在联系,从
宏观到微观对物质的组成和构成加深理解,培养学生对基础知识的理解、应用、分析与综合的能力。
2、能用微粒的观点解释某些常见的现象
3、对有关分子、原子、离子的知识加深理解
在此基础上,形成系统的解题方法和思路。
构
成
分
裂
得失电
子
得失电
子
物
质
纯净物
混合物
分子
原子
离子
结构
原子核
核外电子
质子
中子
原子结构示意图
质量表示方法
相对原子质量
阳离子
阴离子
组成
构成
元素
周期表简介
定义
存在
意义
写法
常见元素的化合价
符号
知识网络
物质
分子
构 成
离子
构 成
原子
构
成
构 成
组 成
元素
总 称
宏观概念
微观概念
(只讲种类
不讲个数)
(既讲种类
又讲个数)
分裂
得失电子
失得电子
一、物质的构成
1、分子的基本性质
①分子体积、质量很小
②分子在不断运动
③分子间有间隔
温度越高,分子能量越大,分子运动速率就越快
通常状况,
气体分子间隙>液体分子间隙>固体分子间隙
一、构成物质的微粒-分子
2、分子与物质变化的关系
物理变化——分子本身不发生改变;
化学变化——分子本身发生改变,生成新的分子
3、分子的定义:
由分子构成的物质,分子是保持物质的化学性质
的最小粒子(分子相同,性质相同)
4、化学反应的本质
一、构成物质的微粒-分子
分解
重新组合
新物质的分子
原物质的分子
原子
1、吸烟有害健康,非吸烟者往往会因吸烟者吸烟而造成被动吸烟,这是因为( )
A、分子在不断运动 B、分子之间有间隔
C、分子的体积很小 D、分子的质量很小
2、将50 mL水与50 mL酒精混合,所得溶液体积小于100 mL,对此现象的解释最科学的是( )
A、分子之间有间隔 B、分子是不断运动的
C、分子具有一定的质量 D、分子是由原子构成的
3.保持过氧化氢化学性质的最小粒子是( )
A.氧气分子和氢气分子 B.水分子
C.氢原子和氧原子 D.过氧化氢分子
A
A
小试牛刀
D
延伸:
原子是构成物质的另一种微粒。原子构成分子,原子可以直接构成物质
1、原子——是化学变化中的最小微粒。
“最小”指在化学反应中不能再分。
2、原子的特征
①原子的体积和质量很小。
②原子在不断的运动。
③原子间有间隔。
分子与原子的主要区别:
在化学变化中,分子可分,而原子不可分;
分子可变,而原子不可变
二、构成物质的微粒-原子
原子核
核外电子
质子
中子
决定
元素种类
最外层电子数决定元素化学性质
决定
原子质量
(+)
(-)
(+)
(不带电)
核电荷数=质子数=核外电子数=原子序数
相对原子质量 =质子数+中子数
原子
3、原子结构
二、构成物质的微粒-原子
电子层
该电子层上的电子数
原子核
核内质子数
(核电荷数)
Na原子结构示意图
二、构成物质的微粒-原子
4、原子结构示意图
元素的
分类 最外层电子数 得失电子趋势 化学性质 结论
一般小于4
易失去电子
一般大于4
易得到电子
活泼
等于8(氦等于2)
稳定结构
稳定
元素的化学性质与原子最外层电子数关系密切
金属元素
非金属
元素
稀有气
体元素
二、构成物质的微粒-原子
5、元素的化学性质与原子最外层电子的关系
①核电荷数=质子数=电子数(原子)
②核电荷数=质子数≠电子数(离子)
③相对原子质量≈质子数+中子数
④元素种类由质子数决定,
⑤元素化学性质主要由最外层电子数决定,
⑥元素的相对原子质量由质子数和中子数之和决定。
二、构成物质的微粒-原子
6、归纳小结:
4、原子序数为94的钚(Pu)是一种核原料,该元素一种原子的质子数和中子数之和为239,下列关于该原子的说法不正确的是( )
A.中子数为145
B.核外电子数为94
C.质子数为94
D.核电荷数为239
D
5、下列四种粒子的结构示意图中,表示金属元素原子的是( )
B
1、定义:带电的原子或原子团叫做离子。
2、离子形成的过程
三、离子
原子:
2
1
8
+11
Na
2
7
8
+17
Cl
离子:
失一个电子
得一个电子
+11
2
8
Na+
8
2
8
+17
Cl-
Na+
Cl-
4、离子符号里的数字的意义:
2Mg2+
表示2个镁离子
表示每个镁离子带2个单位的正电荷
3、离子符号的意义:
离子符号
表示一种离子
表示一个离子
三、离子
原子
阳离子
(+)
阴离子
(-)
失电子
得电子
失电子
得电子
原子中:质子数=电子数(原子不带电)
阳离子中:质子数>电子数(带正电)
阴离子中:质子数<电子数(带负电)
5、原子和离子的区别和联系
三、离子
1、构成物质的微粒有:分子、原子和离子
2、由原子构成的物质:金属单质(Fe、Cu),稀有气体(He、Ne),固态非金属(C、S)
3、由分子构成的物质:非金属氧化物(CO2、H2O2),气态单质(O2、H2)
4、由离子构成的物质:酸碱盐以及金属氧化物
归纳小结
1、定义:质子数(即核电荷数)相同的一类原子的总称
注意事项:
①“一类原子”指的化学变化中不能再分的粒子
②原子的质子数(即核电荷数)决定元素种类
③
元素——是一类原子的总称,只能讲种类,不能讲个数。
原子——是一种粒子,有种类、个数
四、元素
2、地壳中含量较多的几种元素
含量前五位:氧、硅、铝、铁、钙
四、元素
3、元素符号书写的要求:
①由一个字母表示的元素符号要大写;
②由两个字母表示的元素符号,第一个字母大写 ,第二个字母小写
四、元素
4、元素符号表示的意义
元素符号
注意事项:在元素符号前的系数,只表示原子的个数,失去宏观意义,不再表示元素。
宏观:表示一种元素
微观:表示该元素的一个原子
5、元素与原子的区别和联系
区别:
联系:
元素用于描述物质的宏观组成;只讲种类,不讲个数
原子用于描述物质的微观构成;既讲种类,又讲个数
①、元素概念建立在原子基础上;
②、原子的核电荷数(即核内质子数)决定了元素的种类,原子的最外层电子数决定了元素的化学性质
四、元素
1、周期:每一个横行称为一个周期。
2、族:每一个纵行称为一个族。
3、原子序数=核电荷数=核内质子数=核外电子数
五、元素周期表
26 Fe
铁
55.847
元素名称
相对原子质量
原子序数(核电荷数)
元素符号
4、元素周期表所能提供的信息
五、元素周期表
业精于勤,荒于嬉;行成于思,毁于随。——韩愈
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
