第七单元 第三节 溶液的酸碱性(同步提优学案)
文档属性
| 名称 | 第七单元 第三节 溶液的酸碱性(同步提优学案) |
|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-12 13:15:29 | ||
图片预览




文档简介
第七单元 常见的酸和碱
第三节 溶液的酸碱性
学习目标
1、学会用酸碱指示剂、试纸检验溶液的酸碱性,知道pH与溶液的酸碱性强弱的关系,会用pH试纸测定溶液的酸碱度。(重点)
2、从H+和OH-离子的角度认识溶液的酸碱性及酸碱度不同的原因。(重点)
3、了解溶液的酸碱性对生命活动的重要意义。(重点)
考点关注
1、溶液的酸碱性与酸碱度。(常考点)
2、溶液的酸碱性的实质。(易考点)
3、液的酸碱性对生命活动的意义(易考点)
知识点1、如何检验溶液的酸碱性(重点)
1、用酸碱指示剂检验溶液的酸碱性
能检验溶液酸、碱性的指示剂,称为酸碱指示剂
紫色石蕊和无色酚酞是两种常用的酸碱指示剂。
(1)溶液的酸碱性的实质
a、酸性
酸性溶液 H+ 酸性
酸性实质是H+的性质,酸的溶液中阳离子只有H+,故酸的溶液一定显酸性,但显酸性的不一定是酸的溶液,如NH4Cl是盐,溶液显酸性。
a、碱性
碱性溶液 OH- 碱性
碱性实质是OH-的性质,碱的溶液中阳离子只有OH-,故碱的溶液一定显酸性,但显碱性的不一定是碱的溶液,如Na2CO3是盐,溶液显碱性。
(2)溶液酸碱性的识别
a、石蕊试液识别溶液的酸碱性
结论:紫色石蕊在酸性溶液变红色,紫色石蕊在碱性溶液变蓝色,
中性不变色。
a、酚酞试液识别溶液的酸碱性
结论:酚酞在酸性和中性溶液中不变色,酚酞在碱性溶液中变红色。
★酸碱指示剂:遇到酸性和碱性时能发生特定的颜色变化的物质
☆尖子生笔记☆
【规律方法】
1、能识别溶液酸碱度的方法也一定能识别溶液的酸碱性。
2、紫色石蕊试液变色情况:
“酸红,碱蓝,中性紫”;无色酚酞试液的变色情况:“碱红,酸无,中不变”
【易错点津】
1、变色的是酸碱指示剂,酸、碱的溶液不变色
2、通过识别溶液的酸碱性,而将酸和碱识别
3、使石蕊试液变蓝或酚酞试液变红的溶液是碱性的溶液,但不一定是酸或碱的溶液;使石蕊试液变红的是酸性溶液,不一定是酸的溶液;不使酚酞试液变色的可能酸性的,也可能是中性的。
【化学常识】
溶液按酸碱性可分为三种类型:碱性、中性、酸性三种。
【拓展延伸】×××××
(编写要求:左右栏对照讲解,根据左栏的讲解内容合理设置,四个小栏目可以分开设置,也可以都设置,注意左右栏的页面要合适,根据此栏宽进行内容的编写,不要随意修改)
【漫画】
(不需要老师编写内容,但在写稿过程中,在应该放置漫画的地方标上漫画二字,预留4—5行空)
知识点2、怎样判断溶液酸碱性的强弱(重点)
1、溶液酸碱度的表示-------pH
在一定量的水溶液中,H+越多酸性越强;
在一定量的水溶液中, OH-越多碱性越强
常用pH表示溶液的酸碱性强弱,即溶液酸碱度。
pH的范围通常在0~14之间
2、测定溶液pH的方法
⑴pH的测定
a、器材
PH试纸
(PH试纸) (标准比色卡)
PH计
b、用pH试纸测定的操作
在白瓷板或玻璃片上放一小片pH 试纸,用干净的玻璃棒蘸取(或用胶头滴管吸取)被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,读取出比色卡上相近颜色所对应的数值,即可得出被测液的pH 。
⑵注意事项
a、pH试纸只能进行粗略测定,广泛pH试纸通常只能精确到整数。
b、测定前不能将试纸湿润,如湿润后测定,酸性:结果偏大;碱性:结果偏小。
c、不能将试纸伸入待测液中,否则易导致污染试剂
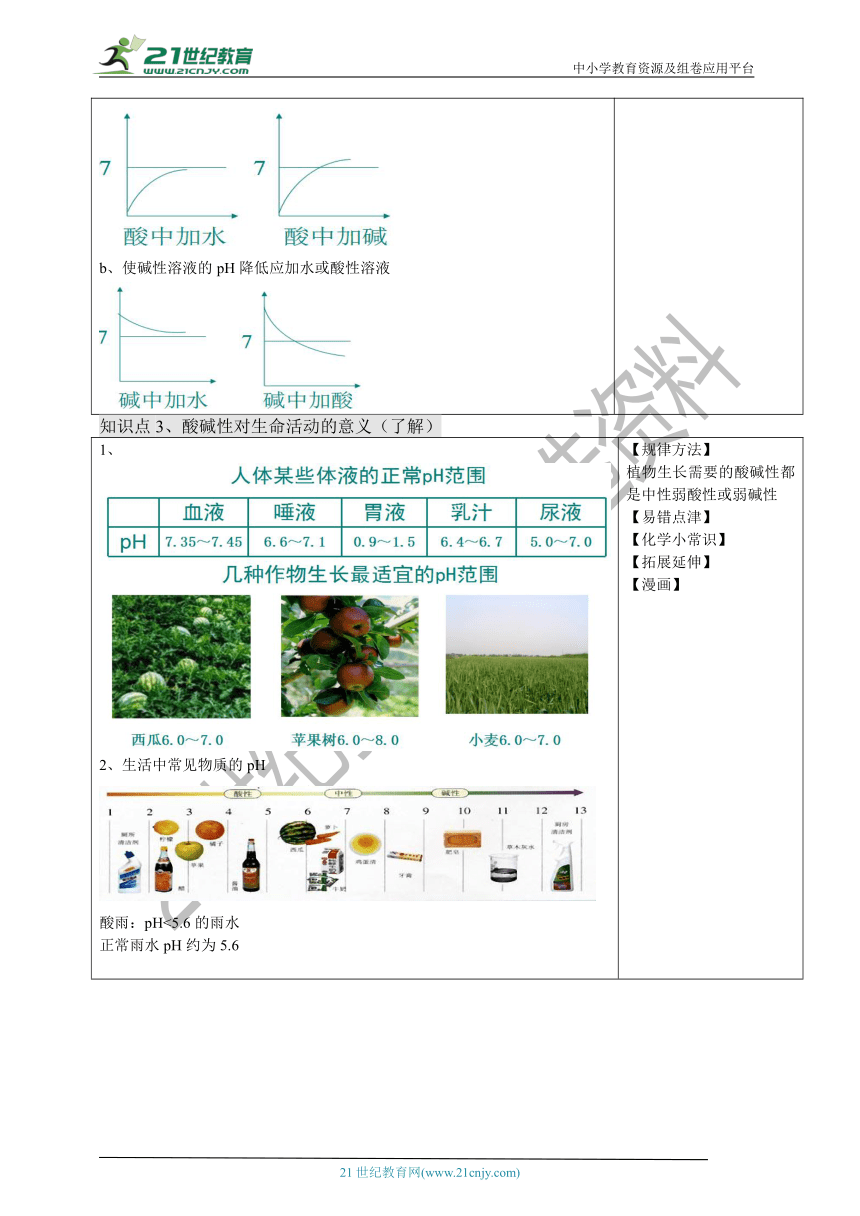
⑶改变酸碱度强弱的方法
a、使酸性溶液的pH升高应加水或碱性溶液
b、使碱性溶液的pH降低应加水或酸性溶液
【规律方法】
1、溶液的pH以“7”为中心,极限增强
2、在测定溶液pH的实际操作中,将试纸显示的颜色与标准比色卡对照的
操作中,将试纸显示的颜色与标准比色卡对照的间隔时间不能超过30秒。
3、测定溶液pH的操作可简记为:一放,二蘸,三滴,四比。
4、加水稀释时,只改变溶液的酸碱度,不改变溶液的酸碱性;加水时,溶液的pH可无限接近7,但不会等于7或超过7。
【易错点津】
pH的书写:“p”小写,“H”代表氢,要大写。
【化学常识】
【拓展延伸】
1、pH通常用来表示溶质的质量分数较小的水溶液的酸碱度,对溶质的质量分数较大的溶液,一般直接用H+或OH- 的浓度表示,不再用 PH表示,因此,PH=0的溶液不使酸性最强的溶液;PH=14的溶液也不是碱性最强的溶液。
【漫画】
知识点3、酸碱性对生命活动的意义(了解)
1、
2、生活中常见物质的pH
酸雨:pH<5.6的雨水
正常雨水pH约为5.6
【规律方法】
植物生长需要的酸碱性都是中性弱酸性或弱碱性
【易错点津】
【化学小常识】
【拓展延伸】
【漫画】
(栏目整体要求:
1、知识点要全,知识点的名称要规范,按照教材的顺序进行编写。
2、知识点讲解要符合图书定位,尽量以图表的形式体现,进行总结性的知识讲解,但基本概念、定义、实验要讲解到位。
3、教材涉及到的知识拓展、方法拓展要全面,比较大的拓展点做知识点讲解,比较小的拓展点做尖子生笔记)
题型1、酸碱指示剂
【例1】(2017·邵阳中考)下列试剂能将稀硫酸、氯化钠溶液、澄清石灰水三种溶液一步鉴别出来的是
A.稀盐酸 B.二氧化碳
C.碳酸钙 D.石蕊溶液
【解析】稀硫酸溶液呈酸性,能使紫色石蕊试液变红;氯化钠溶液呈中性,不使紫色石蕊试液变色;澄清石灰水溶液呈碱性,能使紫色石蕊试液变蓝。能将三种物质鉴别开,选D
【答案】D
【解题策略】①碱性的溶液都能使紫色石蕊试液变蓝,使无色酚酞试液变红;酸性溶液都能使紫色石蕊试液变红,不能使无色酚酞试液变色。②难溶性碱不能使指示剂变色;③呈碱性的溶液,不一定是碱的溶液。
【针对性训练1】(2017·枣庄中考)紫甘蓝是大众爱吃的蔬菜,含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色,在凉拌紫甘蓝丝时,观察到菜丝变成红色,可能是加入了下列哪种调味品
A.食盐 B.味精 C.食醋 D.香油
【针对性训练2】(2017·北京中考)如下图所示,在白色点滴板1-6
的孔穴中,分别滴加2滴紫色石蕊溶液。
(1)孔穴6中溶液变为蓝色,说明碳酸钾溶
液显 (填“酸性”或“碱性”)。
(2)溶液变为红色的孔穴有 (填孔穴序号,下同)。
(3)作为空白对照实验的孔穴是 。
(4)再向孔穴4中滴加稀硫酸,溶液变为紫色,用化学方程式解释其
原因: 。
题型2、溶液的酸碱性与pH的关系
【例3】(2017·北京)土壤的酸碱度会影响植物的生长。下列植物在微酸性土壤中,不适宜种植的是
植物
花生
苹果
西瓜
沙枣
适宜的pH范围
5.0~6.0
5.0~6.5
6.0~7.0
8.0~8.7
A.花生 B.苹果 C.西瓜 D.沙枣
【解析】沙枣适宜的pH范围为碱性,不适宜在微酸性的土壤中种植。
【答案】D
【解题策略】要想解答好这类题目,首先要理解和熟记溶液的酸碱性与pH值的关系等相关知识.然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,细致地分析题意(或实验、图表信息)等各种信息资源,联系起来综合分析,并细心地探究、推理后,按照题目要求对症下药,进行认真地选择或解答即可.
【针对性训练3】(2017·福建中考)下列人体体液中,酸性最强的是
A.唾液(pH约6.6~7.1)
B.胃液(pH约0.8~1.5)
C.胆汁(pH约6.8~7.4)
D.血液(pH约7.35~7.45)
【针对性训练4】(2017·来宾中考)分别向甲、乙、丙三种无色溶液中滴加紫色石蕊试液、观察到甲溶液变红色,乙溶液变蓝色,丙溶液变紫色.则它们的pH由小到大的排列是( )
A.甲、乙、丙 B.甲、丙、乙 C.乙、甲、丙 D.丙、甲、乙
题型3、酸碱性对生命活动的意义
【例4】一些食物的近似pH如下:葡萄汁3.5-4.5;苹果汁:2.9-3.3;牛奶:6.3-6.6;鸡蛋清:7.6-8.0,则下列说法中,不正确的是( )
?鸡蛋清和牛奶显碱性????????????????????????????????????
B.?苹果汁和葡萄汁显酸性???????????????????????????????????????
C.?苹果汁比葡萄汁的酸性强???????????????????????????????????????
?D.?胃酸过多的人应少饮葡萄汁和苹果汁
【解析】A、鸡蛋清的pH大于7,显碱性,牛奶的小于7,呈酸性;B、苹果汁和葡萄汁的酸碱度小于7,显酸性;C、溶液的酸性越强,溶液的pH越小,所以苹果汁比葡萄汁的酸性强?;D、 苹果汁和葡萄汁都显酸性,所以胃酸过多的人应少饮葡萄汁和苹果汁。
【答案】A
【解题策略】动植物的生理活动需要特定的溶液的pH,当溶液的pH改变时,会影响正常的生命活动,甚至生病或死亡。
【针对性训练5】(2017·北京东城模考)我们的胃液呈酸性,是因为胃腺壁细胞能分泌出盐酸。胃酸在人体的消化吸收中发挥着重要作用,比如为胃蛋白酶提供适宜的酸性环境,分解食物中的结缔组织和肌纤维使其易于被消化吸收。
你知道吗?深受人们喜欢的早餐食品燕麦中常添加颗粒极小的铁粉,它既可以作为双吸剂(起到干燥和减缓食品变质的作用),还可以作为人体补铁剂。要把铁粉变为人体需要的、能吸收的营养元素,就离不开胃酸的帮助。
健康人胃液的pH在0.9~1.5,胃液的pH不仅影响人的消化吸收功能,还对伴随食物进入胃内的各类病菌的繁殖有影响。某医院对99位胃溃疡和十二指肠溃疡等患者胃液的pH及胃液中的病菌进行了检测,结果如下表:
分组
胃液的pH
受检患者人数
胃液中检出病菌的人数及比例
A
≤2.0
7
0
B
2.0~4.0
13
3(23.1%)
C
4.0~6.0
26
17(65.4%)
D
>6.0
53
45(84.9%)
胃酸过多会对胃黏膜具有侵蚀作用,并使人感觉反酸或烧心。治疗胃酸过多的药主要有两大类:一是抑酸药,能抑制胃酸分泌,但本身不能和胃酸反应;二是抗酸药,能直接与胃酸反应,常见的抗酸药有碳酸氢钠、氢氧化铝、氧化镁、氢氧化镁和碳酸钙等。
胃溃疡患者若服用不合适的抗酸药,会因胃内气体压力增大而引起胃穿孔。患者如长期使用抗酸药,很可能刺激胃酸分泌过多。因此,应遵医嘱合理使用抗酸类和抑酸类药物。
依据文章内容,回答下列问题。
(1)用化学方程式表示燕麦中的铁粉遇胃酸发生的反应:_____ 。
(2)铁粉可以减缓食物变质,是因为铁可以和 反应。
(3)胃溃疡患者不宜服用的抗酸药是 。
(4)关于文中提到的几种抗酸药,下列说法正确的是
(填字母序号)。
A.均属于盐类或碱类
B.在使用抗酸药时不是用量越多越好
C.适量使用碳酸钙可治疗胃酸过多,同时还可为人体补钙
(5)下列关于胃液与人体健康关系的说法中,合理的是 (填字母序号)。
A.胃酸能帮助人体消化吸收食物,所以胃液pH越小越利于人体健康
B.胃酸过多会对胃黏膜具有侵蚀作用,所以胃液pH越大越利于人体健康
C.胃液pH越大越有利于病菌生存
【针对性训练6】(2017·北京)土壤的酸碱度会影响植物的生长。下列植物在微酸性土壤中,不适宜种植的是( )
植物
花生
苹果
西瓜
沙枣
适宜的pH范围
5.0~6.0
5.0~6.5
6.0~7.0
8.0~8.7
A.花生 B.苹果 C.西瓜 D.沙枣
题型3、结合图像分析某些情况下溶液PH的变化
【例4】??我市有些滩涂地区的土壤被称为“盐碱地“,当地农民常用引进内河淡水浸泡再排水的方法改良土壤.若以土壤pH为纵坐标,浸泡水次数(m)为横坐标,下列能正确表示土壤pH变化的图象的是( )
【解析】:盐碱地的土壤呈碱性,淡水浸泡时,溶液的碱性变弱,但是始终呈碱性,不可能成为酸性或中性。
【答案】C
【解题策略】将溶液加水稀释时,只改变溶液的酸碱度,不改变溶液的酸碱性。物质间相互反应时,溶液的酸碱性可能会发生改变。
【针对性训练7】如图能表示人体大量喝水时,胃液的pH变化的曲线图是( ) A. B. C. D.
【针对性训练8】盐酸和氢氧化钠溶液(滴有酚酞试液)发生反应过程中溶液的pH变化如下图.下列有关该实验事实的说法错误的是( )
A.B点表示盐酸和氢氧化钠恰好完全反应 B.该实验是将氢氧化钠滴入盐酸溶液中 C.B点和C点时,溶液均呈现无色 D.实验通过证明碱溶液的消失来证明发生了反应
题型3、pH的测定方法及误差分析
【例4】下列检测某溶液pH的操作正确的是
A.将pH试纸投入待测液,对照标准比色卡读数
B.用玻璃棒蘸取待测液沾在pH试纸上,3分钟后对照标准比色卡读数
C.用玻璃棒蘸取待测液沾在用蒸馏水润湿的pH试纸上.对照标准比色卡读数
D.用干燥、洁净的玻璃棒蘸取少量待测液,沾在置于洁净表而皿的pH试纸上,半分钟内根据试纸呈现颜色,对照标准比色卡读数
【解析】:PH试纸的使用方法:取一小块试纸在表面皿或玻璃片上,用洁净干燥的玻璃棒蘸取待测液点滴于试纸的中部,观察变化稳定后的颜色,与标准比色卡对比,判断溶液的性质。A.不应将试纸投入待测液中,此项错误。B.用玻璃棒蘸取待测液沾在pH试纸上,约半分钟后对照标准比色卡读数,如时间太长可能发生颜色变化。此项错误。C.用蒸馏水润湿pH试纸,则使待测液的浓度发生变化,使测量不准确。D.用干燥、洁净的玻璃棒蘸取少量待测液,沾在置于洁净表而皿的pH试纸上,半分钟内根据试纸呈现颜色,对照标准比色卡读数。此项正确。所以应选D项。
【答案】D
【解题策略】测定操作注意事项:1、不能将试纸伸入待测液中,以免污染试剂;2、不能将试纸先用水湿润,否则导致测定结果不准确。3、滴加待测液后,30秒左右就要和标准比色卡对照读数,不能等待时间过长。4、测定结果,一般只有整数。
【针对性训练9】用pH试纸测定石灰水的pH,如图所示,则测得结果与实际值相比( )
A、偏高 B、偏低 C、相等 D、不确定
【针对性训练10】××××××××××××××××××××××××
某校同学开展了如下“溶液酸碱性的检验”的实验活动:
(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示:
①图1中存放紫薯汁的仪器名称??????????????????;
②据上表推测,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液可能显示的颜色是????????????,该汁液_______(填“能”或“不能”)做酸碱指示剂。
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于????????(填“酸性”、“中性”或“碱性”)溶液,白醋pH??????????(填“>”、”<”或”=”)7。
(3)图2是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是?????????????(填“A”、“B”或“C”,下同),可能导致所测溶液pH数值发生改变的错误操作是
???????????。
实验探究案:有关溶液酸碱性的探究
【例题】(实验探究题)下列是同学们对物质溶液酸碱性的一次探究活动.我们知道溶液酸碱度pH可显示的溶液的酸碱性;酸溶液pH<7,溶液显酸性;碱溶液pH>7,溶液显碱性.提出问题:盐溶液的pH怎样呢?盐溶液显什么性呢? 猜想与假设:盐溶液的pH可能为:pH=7、______. 设计与实验: (1)要测定盐溶液的酸碱度,不能选择下列试剂中的______(选填序号)进行测定实验; ①紫色石蕊试液???②无色酚酞试液???③pH试纸 (2)下列是两同学分别对相同的NaCl溶液、CuSO4溶液、K2CO3溶液的pH进行的测定实验: 甲同学:取pH试纸放在玻片上,用玻棒蘸取测试液滴在pH试纸上,试纸显色后与pH标准比色卡比较. 乙同学:取pH试纸放在玻片上,用蒸馏水将pH试纸润湿,再用玻棒蘸取测试液滴在pH试纸上,试纸显色后与pH标准比色卡比较. 记录数据:下表是两同学记录所测pH的实验数据:
NaCl溶液
CuSO4溶液
K2CO3溶液
甲同学
7
4.2
10
乙同学
7
4.5
9.6
结论:通过测定几种盐溶液的pH,可以得出的结论是:______. 评价与反思:上述两同学测得的数据,反映了溶液真实pH的是______同学,另一同学测定的不够真实的原因在于:______.
【解析】:由于pH=7的溶液呈中性,所以猜想与假设:盐溶液的pH可能为:pH=7是中性溶液; (1)溶液的酸碱度反映的是溶液酸碱性强弱程度,可依据pH试纸的变色情况判断,而酸碱指示剂只能鉴定溶液的酸碱性,不能反应溶液的酸碱强弱程度; (2)结论:根据NaCl溶液、CuSO4溶液、K2CO3溶液三种盐溶液的pH可以知道,盐的溶液有的呈中性,有的呈碱性,有的呈酸性,所以盐的溶液不一定呈中性,原假设错误; 反思:上述两同学测得的数据,反映了溶液真实pH的是甲同学,因为用蒸馏水将pH试纸润湿再进行测量会稀释待测液,从而导致测量的结果不准确; 【答案】:中性;(1)①②;(2)结论:盐的溶液不一定呈中性;反思:甲;蒸馏水将pH试纸润湿会稀释待测液,从而导致测量的结果不准确;
【解法策略】根据pH=7的溶液显中性分析解答; (1)依据测定溶液酸碱度需要用到pH试纸完成,而酸碱指示剂只能鉴定溶液的酸碱性; (2)从三种溶液的pH数值进行分析进而得结论;依据pH试纸的正确使用方式判断两同学的操作是否有误;
(编写要求:设置每节的中考中常出现的综合型例题,提升学生解决综合题的思维和能力。要对一类题的解法进行总结,比较简单的、或不涉及此类题型的课题或节中,此栏目可缺)
1、(2017·潍坊)人体内几种液体的正常pH范围如下:
体液
血浆
胃液
胆汁
胰液
pH
7.35~7.45
0.9~1.5
7.1~7.3
7.5~8.0
下列说法错误的是
A.血浆显碱性 B.胃液和胆汁显酸性
C.胰液比血浆的碱性强 D.胃酸过多的人应少饮碳酸饮料
【答案】B
【解析】溶液的pH小于7,溶液呈酸性,pH越小,酸性越强;溶液的pH大于7,溶液呈碱性,pH越大碱性越强;pH等于7,溶液呈中性。由表格中的数据可知,胆汁、血浆、胰液都呈碱性,胃液呈酸性,选B
2、(2017·益阳中考)下列试剂能一次鉴别出稀盐酸、澄清石灰水、氢氧化钠溶液的是
A.紫色石蕊试液 B.酚酞试液 C.碳酸钙粉末 D.碳酸钾溶液
【解析】:A 紫色石蕊使澄清石灰水和氢氧化钠溶液都变蓝,A不行;B 酚酞使澄清石灰水和氢氧化钠溶液都变红,B不行;C 碳酸钙只能和稀盐酸反应,和澄清石灰水和氢氧化钠都不反应,C不行;D 碳酸钾和稀盐酸反应有气泡,和澄清石灰水反应有白色沉淀,和氢氧化钠不反应。
【答案】:D
3、(2017·青岛中考)下表列出了一些常见物质在常温下的 pH 范围, 其中呈碱性的是
A.鸡蛋清 B.牛奶 C.西红柿 D.柠檬汁
物质名称
鸡蛋清
牛奶
西红柿
柠檬汁
pH 范围
7.6~8.0
6.3~6.6
4.0~4.4
2.0~3.0
【解析】溶液的pH小于7,溶液呈酸性,pH越小,酸性越强;溶液的pH大于7,溶液呈碱性,pH越大碱性越强;pH等于7,溶液呈中性;选A
【答案】A
4、(2017·兰州中考)下列数据是人体内一些液体的正常pH范围,其中酸性最强的是( )
A.尿液4.7~8.4 B.唾液6.6~7.1
C.血浆7.35~7.45 D.胃液0.9~1.5
【解析】:A、尿液的pH为4.7~8.4,可能显酸性、中性、碱性.
B、唾液的pH为6.6﹣7.1,可能显酸性、中性、碱性.
C、血浆的pH为7.35﹣7.45,大于7,显碱性.
D、胃液的pH为0.9﹣1.5,小于7,显酸性.
根据当溶液的pH小于7时,呈酸性,且pH越小,酸性越强,胃液的pH最小,酸性最强.
【答案】D.
5、(2017·广州)常温下,下列物质水溶液的pH<7的是
A.KOH B.草木灰 C.生石灰 D.醋酸
【解析】KOH、草木灰 、生石灰等物质溶于水溶液都呈碱性,pH>7;醋酸的溶液显酸性,pH<7。故选D。
【答案】D
6、(2017·山东枣庄)紫甘蓝是大众爱吃的蔬菜,含有丰富的花靑素。花靑素遇酸性溶液变红色,遇碱性溶液变蓝色。在凉拌紫甘蓝丝时,观察到菜丝变成红色,可能是加人了下列哪种调味品( C )
A.食盐 B.味精 C.食醋 D.香油
【解答】花青素遇酸性溶液变红色,遇碱性溶液变蓝色,在凉拌紫甘蓝丝时,观察到菜丝变成红色,可知该调味品显酸性,因此是食醋,而食盐、味精、香油都不显酸性。
【答案】C
7、(2017·海南中考)某实验小组做中和反应的实验,向盛有氢氧化钠溶液(滴有酚酞试液)的烧杯中逐滴加入稀盐酸,并不断搅拌。右图为依据实验数据绘制的V(盐酸)-pH 图。
(1)滴加盐酸的体积为V1时,溶液呈什么颜色?
(2)滴加盐酸的体积为V2 时,溶液中除了水分子外,主要的微粒有哪些?
【解析】反应后溶液中的物质一定有生成的可溶性物质,还可能有剩余的反应物。滴加盐酸的体积为V1时,氢氧化钠有剩余,溶质为氯化钠和氢氧化钠,溶液呈碱性,酚酞试液呈现红色。滴加盐酸的体积为V2 时,刚好完全反应,溶质只有氯化钠,所以溶液中除了水分子外,主要的微粒是氯化钠电离产生的钠离子和氯离子。
【答案】(1)红色(或粉红色) (2)钠离子、氯离子(或Na+、 Cl-)
8、(2017·河南中考)向盛有氢氧化钠溶液(滴有酚酞溶液)的烧杯中滴加盐酸时,观察到烧杯中的溶液有红色变为无色。
(1)请写出有关反应的化学方程式。
(2)烧杯中无色溶液的溶质可能只有NaCl,也可能还有HCl。要确定该溶质的成分,请写出一种可选用的试剂。
【解析】(1)氢氧化钠溶液与稀盐酸反应生成氯化钠和水,反应的化学方程式为:HCl+NaOH=NaCl+H2O。(2)烧杯中无色溶液的溶质可能只有NaCl,也可能还有HCl,确定是否含盐酸,紫色石蕊溶液遇酸性溶液变红,可选用紫色石蕊溶液,若变红,说明含有盐酸(或锌、碳酸钠、氧化铜等,锌、碳酸钠能与稀盐酸反应生成气体,氧化铜与稀盐酸反应生成氯化铜和水,会观察到黑色粉末溶解,溶液变蓝色)。
【答案】(1)HCl+NaOH=NaCl+H2O (2)石蕊溶液(或Zn、Na2CO3、CuO、Cu(OH)2等)
(2017·浙江绍兴)食物在胃里是如何消化的?
(1)历史上,针对动物的胃是只能研磨食物进行物理消化,还是能同时进行化学消化的问题有过争议。若穆、斯帕兰扎尼等科学家进行了实验:将一块肉装在由金属丝制成的小笼里,然后让鹰吞食这个小笼,过一段时间,将小笼从鹰体内取出。如果胃在进行物理消化同时,也能进行化学消化,科学家应该观察到的现象是 。【版权所有:21教育】
(2)为了研究胃内能进行化学消化的液体是一直存在的,还是在进食后的消化过程中才产生的,有人设计了以下两个实验:
实验甲:取一群人早餮后的胃内容物,进行成分分析。你认为哪种实验设计更合理,并说明理由: 。
(3)有同学猜想,可能胃内液体不能对不同营养素都进行一样的消化,准备以面包、脂肪块和蛋白块进行实验,请简述你的实验方案: 。
(4)同学们查阅文献资料发现,人体的胃液中存在胃蛋白酶。为了研究pH对胃蛋白酶催化作用的影响,他们在适宜的温度下,以蛋白块为材料进行了实验,结果如图所示,从中可以得到的结论是 。
【答案】(1)肉块消失或明显变小
(2)实验甲,样本数大,又使研究对象一晚饥饿,排尽胃内物体(合理答案均可)
(3)取同样大小(同样质量)的面包、脂肪块和蛋白块,切成同样大小的小块,浸泡在相同胃液里,观察消失情况(或观察消失的时间长短)
(4)胃蛋白酶的催化作用与PH有关。当PH约等于2时,胃蛋白酶的催化作用最强(合理答案均可)
参考答案
【针对性训练】
1、【解析】此题考查酸碱指示剂的性质及常见物质溶液的酸碱性。由题干信息可知,花青素遇酸性溶液变红色,食盐、味精的溶液都显中性,香油不溶于水,所以,A、B、D错误;食醋中含有醋酸,其水溶液显酸性,能使花青素变红色,故选C。
【答案】C
2、【解析】
(1)考查酸碱指示剂,紫色石蕊遇碱性物质变蓝;
(2)考查酸碱指示剂,紫色石蕊遇酸性物质变红;
(3)考查酸碱指示剂分别遇到酸性、碱性和中性物质变色情况,需要学生利用课上讲过的对比和控制变量的方法来解决问题;
(4)孔穴4中原来是氢氧化钠,向其中滴加稀硫酸,发生中和反应,方程式为2NaOH + H2SO4= Na2SO4+ 2H2O。
【答案】
(1)碱性;(2)2,5;(3)3
(4)2NaOH + H2SO4= Na2SO4+ 2H2O
3、【答案】B
【解析】pH<7的溶液呈酸性,且pH越小酸性越强;pH>7的溶液呈碱性,且pH越大碱性越强。故选B。
4、【解析】:乙能使紫色石蕊试液变蓝色,说明乙显碱性,溶液的pH大于7.
丙不能使紫色石蕊试液变色,说明丙显中性,溶液的pH等于7.
甲能使紫色石蕊试液变红色,说明甲显酸性,溶液的pH小于7.
【答案】A.
5、【解析】:(1)胃液注意成分是盐酸,与铁粉反应的化学方程式为:Fe+?2HCl?=?FeCl2+H2↑
(2)食物变质是食物与氧气反应?,铁生锈反应掉氧气,食物就不易变质(3)碳酸氢钠和碳酸钙都能与盐酸反应产生二氧化碳气体,使得胃内气体压力增大而引起胃穿孔??(4)A、氧化镁既不是碱类也不是盐类,错误;B、服用药物要适量?,正确;?C、碳酸钙能与盐酸反应,而且因含有钙元素可补钙,正确。故选B、C(5)?胃液pH的正常范围在0.9~1.5,过大或过小均不利于人体健康,酸性越弱越有利于病菌生存。
【答案】(1)Fe +2HCl = 2FeCl2+ H2↑
(2)氧气(只要写氧气即给分)
(3)碳酸氢钠和碳酸钙(4)B C (5)C
6、【解析】沙枣适宜的pH范围为碱性,不适宜在微酸性的土壤中种植。
【答案】D
7、【解析】胃液中含有盐酸,盐酸显酸性,PH<7.人大量喝水时,稀释胃液,胃液的pH增大,越来越接近7. 【答案】C
8、【解析】 A、从图中可以看出B点的pH值为7,所以可以判断该点为盐酸和氢氧化钠溶液恰好完全反应,故A说法正确; B、从图中可以看出,溶液的起始的pH大于7,所以可以判断起初的溶液为氢氧化钠溶液,即该实验时将盐酸滴入氢氧化钠溶液中,故B说法错误; C、无色酚酞遇酸性和中性溶液都不变色,而B点的pH=7,C点的pH小于7,所以这两点的溶液都为无色,故C说法正确; D、本实验借助于无色酚酞遇碱液变红,而在中性和酸性溶液中都不变色,从而判断碱溶液消失,说明盐酸和氢氧化钠溶液发生了反应,故D说法正确. 【答案】B.
9、【解析】试题分析:石灰水是氢氧化钙的水溶液,显碱性;用蒸馏水润湿后,溶液的碱性变弱,当溶液的pH大于7时,呈碱性,且pH越大,碱性越强,则测得的pH结果比实际值偏小。
【答案】B。
10、【解析】:(1)①由图可知仪器的名称是滴瓶;
②由表格可知紫薯汁遇到酸性的白醋和盐酸均变红,因此遇到稀硫酸显示的颜色也是红色;紫薯汁在酸性和碱性溶液中能显现不同的颜色,因此可以作为酸碱指示剂。
(2)pH的取值范围:pH<7时,溶液显酸性;pH>7时,溶液显碱性;pH=7时,溶液显中性。草木灰水pH>7,属于碱性溶液;白醋属于酸性溶液,所以pH<7。
(3)PH试纸的使用方法:取一小块试纸在表面皿或玻璃片上,用洁净干燥的玻璃棒蘸取待测液点滴于试纸的中部,观察变化稳定后的颜色,与标准比色卡对比,读出溶液的PH值,判断溶液的性质。A中将试纸浸入待测液中不正确。C操作中点滴板上有水,会使溶液被稀释,会导致所测的pH数值发生变化。所以应选择B项
【答案】(1)①滴瓶;
②紫薯汁;能
(2)碱性;<。
(3)B
实验探究案:有关溶液酸碱性的探究
【解析】:由于pH=7的溶液呈中性,所以猜想与假设:盐溶液的pH可能为:pH=7是中性溶液; (1)溶液的酸碱度反映的是溶液酸碱性强弱程度,可依据pH试纸的变色情况判断,而酸碱指示剂只能鉴定溶液的酸碱性,不能反应溶液的酸碱强弱程度; (2)结论:根据NaCl溶液、CuSO4溶液、K2CO3溶液三种盐溶液的pH可以知道,盐的溶液有的呈中性,有的呈碱性,有的呈酸性,所以盐的溶液不一定呈中性,原假设错误; 反思:上述两同学测得的数据,反映了溶液真实pH的是甲同学,因为用蒸馏水将pH试纸润湿再进行测量会稀释待测液,从而导致测量的结果不准确; 【答案】:中性;(1)①②;(2)结论:盐的溶液不一定呈中性;反思:甲;蒸馏水将pH试纸润湿会稀释待测液,从而导致测量的结果不准确;
1、【解析】溶液的pH小于7,溶液呈酸性,pH越小,酸性越强;溶液的pH大于7,溶液呈碱性,pH越大碱性越强;pH等于7,溶液呈中性。由表格中的数据可知,胆汁、血浆、胰液都呈碱性,胃液呈酸性,选B
【答案】B
2、【解析】:A 紫色石蕊使澄清石灰水和氢氧化钠溶液都变蓝,A不行;B 酚酞使澄清石灰水和氢氧化钠溶液都变红,B不行;C 碳酸钙只能和稀盐酸反应,和澄清石灰水和氢氧化钠都不反应,C不行;D 碳酸钾和稀盐酸反应有气泡,和澄清石灰水反应有白色沉淀,和氢氧化钠不反应。
【答案】:D
3、【解析】溶液的pH小于7,溶液呈酸性,pH越小,酸性越强;溶液的pH大于7,溶液呈碱性,pH越大碱性越强;pH等于7,溶液呈中性;选A
【答案】A
4、【解析】:A、尿液的pH为4.7~8.4,可能显酸性、中性、碱性.
B、唾液的pH为6.6﹣7.1,可能显酸性、中性、碱性.
C、血浆的pH为7.35﹣7.45,大于7,显碱性.
D、胃液的pH为0.9﹣1.5,小于7,显酸性.
根据当溶液的pH小于7时,呈酸性,且pH越小,酸性越强,胃液的pH最小,酸性最强.
【答案】D.
5、【解析】KOH、草木灰 、生石灰等物质溶于水溶液都呈碱性,pH>7;醋酸的溶液显酸性,pH<7。故选D。
【答案】D
6、【解答】花青素遇酸性溶液变红色,遇碱性溶液变蓝色,在凉拌紫甘蓝丝时,观察到菜丝变成红色,可知该调味品显酸性,因此是食醋,而食盐、味精、香油都不显酸性。
【答案】C
7、【解析】反应后溶液中的物质一定有生成的可溶性物质,还可能有剩余的反应物。滴加盐酸的体积为V1时,氢氧化钠有剩余,溶质为氯化钠和氢氧化钠,溶液呈碱性,酚酞试液呈现红色。滴加盐酸的体积为V2 时,刚好完全反应,溶质只有氯化钠,所以溶液中除了水分子外,主要的微粒是氯化钠电离产生的钠离子和氯离子。
【答案】(1)红色(或粉红色) (2)钠离子、氯离子(或Na+、 Cl-)
8、【解析】(1)氢氧化钠溶液与稀盐酸反应生成氯化钠和水,反应的化学方程式为:HCl+NaOH=NaCl+H2O。(2)烧杯中无色溶液的溶质可能只有NaCl,也可能还有HCl,确定是否含盐酸,紫色石蕊溶液遇酸性溶液变红,可选用紫色石蕊溶液,若变红,说明含有盐酸(或锌、碳酸钠、氧化铜等,锌、碳酸钠能与稀盐酸反应生成气体,氧化铜与稀盐酸反应生成氯化铜和水,会观察到黑色粉末溶解,溶液变蓝色)。
【答案】(1)HCl+NaOH=NaCl+H2O (2)石蕊溶液(或Zn、Na2CO3、CuO、Cu(OH)2等)
【解析】(1)若发生化学消化,则铁笼中的肉块能被消化,则现象为肉块消失或明显变小; (2)实验甲更合理,选取实验对象充足样本数大,又使研究对象一晚饥饿,排尽胃内物体,避免干扰(合理答案均可); (3)设计实验方案:取同样大小(同样质量)的面包、脂肪块和蛋白块,切成同样大小的小块,浸泡在相同胃液里,观察消失情况(或观察消失的时间长短); (4)观察图可看出胃蛋白酶的催化作用与pH有关。当pH约等于2时,胃蛋白酶的催化作用最强。 故答案为:(1)肉块消失或明显变小;(2)实验甲,样本数大,又使研究对象一晚饥饿,排尽胃内物体(合理答案均可);(3)取同样大小(同样质量)的面包、脂肪块和蛋白块,切成同样大小的小块,浸泡在相同胃液里,观察消失情况(或观察消失的时间长短);(4)胃蛋白酶的催化作用与pH有关。当pH约等于2时,胃蛋白酶的催化作用最强。????
【答案】(1)肉块消失或明显变小
(2)实验甲,样本数大,又使研究对象一晚饥饿,排尽胃内物体(合理答案均可)
(3)取同样大小(同样质量)的面包、脂肪块和蛋白块,切成同样大小的小块,浸泡在相同胃液里,观察消失情况(或观察消失的时间长短)
(4)胃蛋白酶的催化作用与PH有关。当PH约等于2时,胃蛋白酶的催化作用最强(合理答案均可)
第三节 溶液的酸碱性
学习目标
1、学会用酸碱指示剂、试纸检验溶液的酸碱性,知道pH与溶液的酸碱性强弱的关系,会用pH试纸测定溶液的酸碱度。(重点)
2、从H+和OH-离子的角度认识溶液的酸碱性及酸碱度不同的原因。(重点)
3、了解溶液的酸碱性对生命活动的重要意义。(重点)
考点关注
1、溶液的酸碱性与酸碱度。(常考点)
2、溶液的酸碱性的实质。(易考点)
3、液的酸碱性对生命活动的意义(易考点)
知识点1、如何检验溶液的酸碱性(重点)
1、用酸碱指示剂检验溶液的酸碱性
能检验溶液酸、碱性的指示剂,称为酸碱指示剂
紫色石蕊和无色酚酞是两种常用的酸碱指示剂。
(1)溶液的酸碱性的实质
a、酸性
酸性溶液 H+ 酸性
酸性实质是H+的性质,酸的溶液中阳离子只有H+,故酸的溶液一定显酸性,但显酸性的不一定是酸的溶液,如NH4Cl是盐,溶液显酸性。
a、碱性
碱性溶液 OH- 碱性
碱性实质是OH-的性质,碱的溶液中阳离子只有OH-,故碱的溶液一定显酸性,但显碱性的不一定是碱的溶液,如Na2CO3是盐,溶液显碱性。
(2)溶液酸碱性的识别
a、石蕊试液识别溶液的酸碱性
结论:紫色石蕊在酸性溶液变红色,紫色石蕊在碱性溶液变蓝色,
中性不变色。
a、酚酞试液识别溶液的酸碱性
结论:酚酞在酸性和中性溶液中不变色,酚酞在碱性溶液中变红色。
★酸碱指示剂:遇到酸性和碱性时能发生特定的颜色变化的物质
☆尖子生笔记☆
【规律方法】
1、能识别溶液酸碱度的方法也一定能识别溶液的酸碱性。
2、紫色石蕊试液变色情况:
“酸红,碱蓝,中性紫”;无色酚酞试液的变色情况:“碱红,酸无,中不变”
【易错点津】
1、变色的是酸碱指示剂,酸、碱的溶液不变色
2、通过识别溶液的酸碱性,而将酸和碱识别
3、使石蕊试液变蓝或酚酞试液变红的溶液是碱性的溶液,但不一定是酸或碱的溶液;使石蕊试液变红的是酸性溶液,不一定是酸的溶液;不使酚酞试液变色的可能酸性的,也可能是中性的。
【化学常识】
溶液按酸碱性可分为三种类型:碱性、中性、酸性三种。
【拓展延伸】×××××
(编写要求:左右栏对照讲解,根据左栏的讲解内容合理设置,四个小栏目可以分开设置,也可以都设置,注意左右栏的页面要合适,根据此栏宽进行内容的编写,不要随意修改)
【漫画】
(不需要老师编写内容,但在写稿过程中,在应该放置漫画的地方标上漫画二字,预留4—5行空)
知识点2、怎样判断溶液酸碱性的强弱(重点)
1、溶液酸碱度的表示-------pH
在一定量的水溶液中,H+越多酸性越强;
在一定量的水溶液中, OH-越多碱性越强
常用pH表示溶液的酸碱性强弱,即溶液酸碱度。
pH的范围通常在0~14之间
2、测定溶液pH的方法
⑴pH的测定
a、器材
PH试纸
(PH试纸) (标准比色卡)
PH计
b、用pH试纸测定的操作
在白瓷板或玻璃片上放一小片pH 试纸,用干净的玻璃棒蘸取(或用胶头滴管吸取)被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,读取出比色卡上相近颜色所对应的数值,即可得出被测液的pH 。
⑵注意事项
a、pH试纸只能进行粗略测定,广泛pH试纸通常只能精确到整数。
b、测定前不能将试纸湿润,如湿润后测定,酸性:结果偏大;碱性:结果偏小。
c、不能将试纸伸入待测液中,否则易导致污染试剂
⑶改变酸碱度强弱的方法
a、使酸性溶液的pH升高应加水或碱性溶液
b、使碱性溶液的pH降低应加水或酸性溶液
【规律方法】
1、溶液的pH以“7”为中心,极限增强
2、在测定溶液pH的实际操作中,将试纸显示的颜色与标准比色卡对照的
操作中,将试纸显示的颜色与标准比色卡对照的间隔时间不能超过30秒。
3、测定溶液pH的操作可简记为:一放,二蘸,三滴,四比。
4、加水稀释时,只改变溶液的酸碱度,不改变溶液的酸碱性;加水时,溶液的pH可无限接近7,但不会等于7或超过7。
【易错点津】
pH的书写:“p”小写,“H”代表氢,要大写。
【化学常识】
【拓展延伸】
1、pH通常用来表示溶质的质量分数较小的水溶液的酸碱度,对溶质的质量分数较大的溶液,一般直接用H+或OH- 的浓度表示,不再用 PH表示,因此,PH=0的溶液不使酸性最强的溶液;PH=14的溶液也不是碱性最强的溶液。
【漫画】
知识点3、酸碱性对生命活动的意义(了解)
1、
2、生活中常见物质的pH
酸雨:pH<5.6的雨水
正常雨水pH约为5.6
【规律方法】
植物生长需要的酸碱性都是中性弱酸性或弱碱性
【易错点津】
【化学小常识】
【拓展延伸】
【漫画】
(栏目整体要求:
1、知识点要全,知识点的名称要规范,按照教材的顺序进行编写。
2、知识点讲解要符合图书定位,尽量以图表的形式体现,进行总结性的知识讲解,但基本概念、定义、实验要讲解到位。
3、教材涉及到的知识拓展、方法拓展要全面,比较大的拓展点做知识点讲解,比较小的拓展点做尖子生笔记)
题型1、酸碱指示剂
【例1】(2017·邵阳中考)下列试剂能将稀硫酸、氯化钠溶液、澄清石灰水三种溶液一步鉴别出来的是
A.稀盐酸 B.二氧化碳
C.碳酸钙 D.石蕊溶液
【解析】稀硫酸溶液呈酸性,能使紫色石蕊试液变红;氯化钠溶液呈中性,不使紫色石蕊试液变色;澄清石灰水溶液呈碱性,能使紫色石蕊试液变蓝。能将三种物质鉴别开,选D
【答案】D
【解题策略】①碱性的溶液都能使紫色石蕊试液变蓝,使无色酚酞试液变红;酸性溶液都能使紫色石蕊试液变红,不能使无色酚酞试液变色。②难溶性碱不能使指示剂变色;③呈碱性的溶液,不一定是碱的溶液。
【针对性训练1】(2017·枣庄中考)紫甘蓝是大众爱吃的蔬菜,含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色,在凉拌紫甘蓝丝时,观察到菜丝变成红色,可能是加入了下列哪种调味品
A.食盐 B.味精 C.食醋 D.香油
【针对性训练2】(2017·北京中考)如下图所示,在白色点滴板1-6
的孔穴中,分别滴加2滴紫色石蕊溶液。
(1)孔穴6中溶液变为蓝色,说明碳酸钾溶
液显 (填“酸性”或“碱性”)。
(2)溶液变为红色的孔穴有 (填孔穴序号,下同)。
(3)作为空白对照实验的孔穴是 。
(4)再向孔穴4中滴加稀硫酸,溶液变为紫色,用化学方程式解释其
原因: 。
题型2、溶液的酸碱性与pH的关系
【例3】(2017·北京)土壤的酸碱度会影响植物的生长。下列植物在微酸性土壤中,不适宜种植的是
植物
花生
苹果
西瓜
沙枣
适宜的pH范围
5.0~6.0
5.0~6.5
6.0~7.0
8.0~8.7
A.花生 B.苹果 C.西瓜 D.沙枣
【解析】沙枣适宜的pH范围为碱性,不适宜在微酸性的土壤中种植。
【答案】D
【解题策略】要想解答好这类题目,首先要理解和熟记溶液的酸碱性与pH值的关系等相关知识.然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,细致地分析题意(或实验、图表信息)等各种信息资源,联系起来综合分析,并细心地探究、推理后,按照题目要求对症下药,进行认真地选择或解答即可.
【针对性训练3】(2017·福建中考)下列人体体液中,酸性最强的是
A.唾液(pH约6.6~7.1)
B.胃液(pH约0.8~1.5)
C.胆汁(pH约6.8~7.4)
D.血液(pH约7.35~7.45)
【针对性训练4】(2017·来宾中考)分别向甲、乙、丙三种无色溶液中滴加紫色石蕊试液、观察到甲溶液变红色,乙溶液变蓝色,丙溶液变紫色.则它们的pH由小到大的排列是( )
A.甲、乙、丙 B.甲、丙、乙 C.乙、甲、丙 D.丙、甲、乙
题型3、酸碱性对生命活动的意义
【例4】一些食物的近似pH如下:葡萄汁3.5-4.5;苹果汁:2.9-3.3;牛奶:6.3-6.6;鸡蛋清:7.6-8.0,则下列说法中,不正确的是( )
?鸡蛋清和牛奶显碱性????????????????????????????????????
B.?苹果汁和葡萄汁显酸性???????????????????????????????????????
C.?苹果汁比葡萄汁的酸性强???????????????????????????????????????
?D.?胃酸过多的人应少饮葡萄汁和苹果汁
【解析】A、鸡蛋清的pH大于7,显碱性,牛奶的小于7,呈酸性;B、苹果汁和葡萄汁的酸碱度小于7,显酸性;C、溶液的酸性越强,溶液的pH越小,所以苹果汁比葡萄汁的酸性强?;D、 苹果汁和葡萄汁都显酸性,所以胃酸过多的人应少饮葡萄汁和苹果汁。
【答案】A
【解题策略】动植物的生理活动需要特定的溶液的pH,当溶液的pH改变时,会影响正常的生命活动,甚至生病或死亡。
【针对性训练5】(2017·北京东城模考)我们的胃液呈酸性,是因为胃腺壁细胞能分泌出盐酸。胃酸在人体的消化吸收中发挥着重要作用,比如为胃蛋白酶提供适宜的酸性环境,分解食物中的结缔组织和肌纤维使其易于被消化吸收。
你知道吗?深受人们喜欢的早餐食品燕麦中常添加颗粒极小的铁粉,它既可以作为双吸剂(起到干燥和减缓食品变质的作用),还可以作为人体补铁剂。要把铁粉变为人体需要的、能吸收的营养元素,就离不开胃酸的帮助。
健康人胃液的pH在0.9~1.5,胃液的pH不仅影响人的消化吸收功能,还对伴随食物进入胃内的各类病菌的繁殖有影响。某医院对99位胃溃疡和十二指肠溃疡等患者胃液的pH及胃液中的病菌进行了检测,结果如下表:
分组
胃液的pH
受检患者人数
胃液中检出病菌的人数及比例
A
≤2.0
7
0
B
2.0~4.0
13
3(23.1%)
C
4.0~6.0
26
17(65.4%)
D
>6.0
53
45(84.9%)
胃酸过多会对胃黏膜具有侵蚀作用,并使人感觉反酸或烧心。治疗胃酸过多的药主要有两大类:一是抑酸药,能抑制胃酸分泌,但本身不能和胃酸反应;二是抗酸药,能直接与胃酸反应,常见的抗酸药有碳酸氢钠、氢氧化铝、氧化镁、氢氧化镁和碳酸钙等。
胃溃疡患者若服用不合适的抗酸药,会因胃内气体压力增大而引起胃穿孔。患者如长期使用抗酸药,很可能刺激胃酸分泌过多。因此,应遵医嘱合理使用抗酸类和抑酸类药物。
依据文章内容,回答下列问题。
(1)用化学方程式表示燕麦中的铁粉遇胃酸发生的反应:_____ 。
(2)铁粉可以减缓食物变质,是因为铁可以和 反应。
(3)胃溃疡患者不宜服用的抗酸药是 。
(4)关于文中提到的几种抗酸药,下列说法正确的是
(填字母序号)。
A.均属于盐类或碱类
B.在使用抗酸药时不是用量越多越好
C.适量使用碳酸钙可治疗胃酸过多,同时还可为人体补钙
(5)下列关于胃液与人体健康关系的说法中,合理的是 (填字母序号)。
A.胃酸能帮助人体消化吸收食物,所以胃液pH越小越利于人体健康
B.胃酸过多会对胃黏膜具有侵蚀作用,所以胃液pH越大越利于人体健康
C.胃液pH越大越有利于病菌生存
【针对性训练6】(2017·北京)土壤的酸碱度会影响植物的生长。下列植物在微酸性土壤中,不适宜种植的是( )
植物
花生
苹果
西瓜
沙枣
适宜的pH范围
5.0~6.0
5.0~6.5
6.0~7.0
8.0~8.7
A.花生 B.苹果 C.西瓜 D.沙枣
题型3、结合图像分析某些情况下溶液PH的变化
【例4】??我市有些滩涂地区的土壤被称为“盐碱地“,当地农民常用引进内河淡水浸泡再排水的方法改良土壤.若以土壤pH为纵坐标,浸泡水次数(m)为横坐标,下列能正确表示土壤pH变化的图象的是( )
【解析】:盐碱地的土壤呈碱性,淡水浸泡时,溶液的碱性变弱,但是始终呈碱性,不可能成为酸性或中性。
【答案】C
【解题策略】将溶液加水稀释时,只改变溶液的酸碱度,不改变溶液的酸碱性。物质间相互反应时,溶液的酸碱性可能会发生改变。
【针对性训练7】如图能表示人体大量喝水时,胃液的pH变化的曲线图是( ) A. B. C. D.
【针对性训练8】盐酸和氢氧化钠溶液(滴有酚酞试液)发生反应过程中溶液的pH变化如下图.下列有关该实验事实的说法错误的是( )
A.B点表示盐酸和氢氧化钠恰好完全反应 B.该实验是将氢氧化钠滴入盐酸溶液中 C.B点和C点时,溶液均呈现无色 D.实验通过证明碱溶液的消失来证明发生了反应
题型3、pH的测定方法及误差分析
【例4】下列检测某溶液pH的操作正确的是
A.将pH试纸投入待测液,对照标准比色卡读数
B.用玻璃棒蘸取待测液沾在pH试纸上,3分钟后对照标准比色卡读数
C.用玻璃棒蘸取待测液沾在用蒸馏水润湿的pH试纸上.对照标准比色卡读数
D.用干燥、洁净的玻璃棒蘸取少量待测液,沾在置于洁净表而皿的pH试纸上,半分钟内根据试纸呈现颜色,对照标准比色卡读数
【解析】:PH试纸的使用方法:取一小块试纸在表面皿或玻璃片上,用洁净干燥的玻璃棒蘸取待测液点滴于试纸的中部,观察变化稳定后的颜色,与标准比色卡对比,判断溶液的性质。A.不应将试纸投入待测液中,此项错误。B.用玻璃棒蘸取待测液沾在pH试纸上,约半分钟后对照标准比色卡读数,如时间太长可能发生颜色变化。此项错误。C.用蒸馏水润湿pH试纸,则使待测液的浓度发生变化,使测量不准确。D.用干燥、洁净的玻璃棒蘸取少量待测液,沾在置于洁净表而皿的pH试纸上,半分钟内根据试纸呈现颜色,对照标准比色卡读数。此项正确。所以应选D项。
【答案】D
【解题策略】测定操作注意事项:1、不能将试纸伸入待测液中,以免污染试剂;2、不能将试纸先用水湿润,否则导致测定结果不准确。3、滴加待测液后,30秒左右就要和标准比色卡对照读数,不能等待时间过长。4、测定结果,一般只有整数。
【针对性训练9】用pH试纸测定石灰水的pH,如图所示,则测得结果与实际值相比( )
A、偏高 B、偏低 C、相等 D、不确定
【针对性训练10】××××××××××××××××××××××××
某校同学开展了如下“溶液酸碱性的检验”的实验活动:
(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示:
①图1中存放紫薯汁的仪器名称??????????????????;
②据上表推测,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液可能显示的颜色是????????????,该汁液_______(填“能”或“不能”)做酸碱指示剂。
(2)用pH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于????????(填“酸性”、“中性”或“碱性”)溶液,白醋pH??????????(填“>”、”<”或”=”)7。
(3)图2是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是?????????????(填“A”、“B”或“C”,下同),可能导致所测溶液pH数值发生改变的错误操作是
???????????。
实验探究案:有关溶液酸碱性的探究
【例题】(实验探究题)下列是同学们对物质溶液酸碱性的一次探究活动.我们知道溶液酸碱度pH可显示的溶液的酸碱性;酸溶液pH<7,溶液显酸性;碱溶液pH>7,溶液显碱性.提出问题:盐溶液的pH怎样呢?盐溶液显什么性呢? 猜想与假设:盐溶液的pH可能为:pH=7、______. 设计与实验: (1)要测定盐溶液的酸碱度,不能选择下列试剂中的______(选填序号)进行测定实验; ①紫色石蕊试液???②无色酚酞试液???③pH试纸 (2)下列是两同学分别对相同的NaCl溶液、CuSO4溶液、K2CO3溶液的pH进行的测定实验: 甲同学:取pH试纸放在玻片上,用玻棒蘸取测试液滴在pH试纸上,试纸显色后与pH标准比色卡比较. 乙同学:取pH试纸放在玻片上,用蒸馏水将pH试纸润湿,再用玻棒蘸取测试液滴在pH试纸上,试纸显色后与pH标准比色卡比较. 记录数据:下表是两同学记录所测pH的实验数据:
NaCl溶液
CuSO4溶液
K2CO3溶液
甲同学
7
4.2
10
乙同学
7
4.5
9.6
结论:通过测定几种盐溶液的pH,可以得出的结论是:______. 评价与反思:上述两同学测得的数据,反映了溶液真实pH的是______同学,另一同学测定的不够真实的原因在于:______.
【解析】:由于pH=7的溶液呈中性,所以猜想与假设:盐溶液的pH可能为:pH=7是中性溶液; (1)溶液的酸碱度反映的是溶液酸碱性强弱程度,可依据pH试纸的变色情况判断,而酸碱指示剂只能鉴定溶液的酸碱性,不能反应溶液的酸碱强弱程度; (2)结论:根据NaCl溶液、CuSO4溶液、K2CO3溶液三种盐溶液的pH可以知道,盐的溶液有的呈中性,有的呈碱性,有的呈酸性,所以盐的溶液不一定呈中性,原假设错误; 反思:上述两同学测得的数据,反映了溶液真实pH的是甲同学,因为用蒸馏水将pH试纸润湿再进行测量会稀释待测液,从而导致测量的结果不准确; 【答案】:中性;(1)①②;(2)结论:盐的溶液不一定呈中性;反思:甲;蒸馏水将pH试纸润湿会稀释待测液,从而导致测量的结果不准确;
【解法策略】根据pH=7的溶液显中性分析解答; (1)依据测定溶液酸碱度需要用到pH试纸完成,而酸碱指示剂只能鉴定溶液的酸碱性; (2)从三种溶液的pH数值进行分析进而得结论;依据pH试纸的正确使用方式判断两同学的操作是否有误;
(编写要求:设置每节的中考中常出现的综合型例题,提升学生解决综合题的思维和能力。要对一类题的解法进行总结,比较简单的、或不涉及此类题型的课题或节中,此栏目可缺)
1、(2017·潍坊)人体内几种液体的正常pH范围如下:
体液
血浆
胃液
胆汁
胰液
pH
7.35~7.45
0.9~1.5
7.1~7.3
7.5~8.0
下列说法错误的是
A.血浆显碱性 B.胃液和胆汁显酸性
C.胰液比血浆的碱性强 D.胃酸过多的人应少饮碳酸饮料
【答案】B
【解析】溶液的pH小于7,溶液呈酸性,pH越小,酸性越强;溶液的pH大于7,溶液呈碱性,pH越大碱性越强;pH等于7,溶液呈中性。由表格中的数据可知,胆汁、血浆、胰液都呈碱性,胃液呈酸性,选B
2、(2017·益阳中考)下列试剂能一次鉴别出稀盐酸、澄清石灰水、氢氧化钠溶液的是
A.紫色石蕊试液 B.酚酞试液 C.碳酸钙粉末 D.碳酸钾溶液
【解析】:A 紫色石蕊使澄清石灰水和氢氧化钠溶液都变蓝,A不行;B 酚酞使澄清石灰水和氢氧化钠溶液都变红,B不行;C 碳酸钙只能和稀盐酸反应,和澄清石灰水和氢氧化钠都不反应,C不行;D 碳酸钾和稀盐酸反应有气泡,和澄清石灰水反应有白色沉淀,和氢氧化钠不反应。
【答案】:D
3、(2017·青岛中考)下表列出了一些常见物质在常温下的 pH 范围, 其中呈碱性的是
A.鸡蛋清 B.牛奶 C.西红柿 D.柠檬汁
物质名称
鸡蛋清
牛奶
西红柿
柠檬汁
pH 范围
7.6~8.0
6.3~6.6
4.0~4.4
2.0~3.0
【解析】溶液的pH小于7,溶液呈酸性,pH越小,酸性越强;溶液的pH大于7,溶液呈碱性,pH越大碱性越强;pH等于7,溶液呈中性;选A
【答案】A
4、(2017·兰州中考)下列数据是人体内一些液体的正常pH范围,其中酸性最强的是( )
A.尿液4.7~8.4 B.唾液6.6~7.1
C.血浆7.35~7.45 D.胃液0.9~1.5
【解析】:A、尿液的pH为4.7~8.4,可能显酸性、中性、碱性.
B、唾液的pH为6.6﹣7.1,可能显酸性、中性、碱性.
C、血浆的pH为7.35﹣7.45,大于7,显碱性.
D、胃液的pH为0.9﹣1.5,小于7,显酸性.
根据当溶液的pH小于7时,呈酸性,且pH越小,酸性越强,胃液的pH最小,酸性最强.
【答案】D.
5、(2017·广州)常温下,下列物质水溶液的pH<7的是
A.KOH B.草木灰 C.生石灰 D.醋酸
【解析】KOH、草木灰 、生石灰等物质溶于水溶液都呈碱性,pH>7;醋酸的溶液显酸性,pH<7。故选D。
【答案】D
6、(2017·山东枣庄)紫甘蓝是大众爱吃的蔬菜,含有丰富的花靑素。花靑素遇酸性溶液变红色,遇碱性溶液变蓝色。在凉拌紫甘蓝丝时,观察到菜丝变成红色,可能是加人了下列哪种调味品( C )
A.食盐 B.味精 C.食醋 D.香油
【解答】花青素遇酸性溶液变红色,遇碱性溶液变蓝色,在凉拌紫甘蓝丝时,观察到菜丝变成红色,可知该调味品显酸性,因此是食醋,而食盐、味精、香油都不显酸性。
【答案】C
7、(2017·海南中考)某实验小组做中和反应的实验,向盛有氢氧化钠溶液(滴有酚酞试液)的烧杯中逐滴加入稀盐酸,并不断搅拌。右图为依据实验数据绘制的V(盐酸)-pH 图。
(1)滴加盐酸的体积为V1时,溶液呈什么颜色?
(2)滴加盐酸的体积为V2 时,溶液中除了水分子外,主要的微粒有哪些?
【解析】反应后溶液中的物质一定有生成的可溶性物质,还可能有剩余的反应物。滴加盐酸的体积为V1时,氢氧化钠有剩余,溶质为氯化钠和氢氧化钠,溶液呈碱性,酚酞试液呈现红色。滴加盐酸的体积为V2 时,刚好完全反应,溶质只有氯化钠,所以溶液中除了水分子外,主要的微粒是氯化钠电离产生的钠离子和氯离子。
【答案】(1)红色(或粉红色) (2)钠离子、氯离子(或Na+、 Cl-)
8、(2017·河南中考)向盛有氢氧化钠溶液(滴有酚酞溶液)的烧杯中滴加盐酸时,观察到烧杯中的溶液有红色变为无色。
(1)请写出有关反应的化学方程式。
(2)烧杯中无色溶液的溶质可能只有NaCl,也可能还有HCl。要确定该溶质的成分,请写出一种可选用的试剂。
【解析】(1)氢氧化钠溶液与稀盐酸反应生成氯化钠和水,反应的化学方程式为:HCl+NaOH=NaCl+H2O。(2)烧杯中无色溶液的溶质可能只有NaCl,也可能还有HCl,确定是否含盐酸,紫色石蕊溶液遇酸性溶液变红,可选用紫色石蕊溶液,若变红,说明含有盐酸(或锌、碳酸钠、氧化铜等,锌、碳酸钠能与稀盐酸反应生成气体,氧化铜与稀盐酸反应生成氯化铜和水,会观察到黑色粉末溶解,溶液变蓝色)。
【答案】(1)HCl+NaOH=NaCl+H2O (2)石蕊溶液(或Zn、Na2CO3、CuO、Cu(OH)2等)
(2017·浙江绍兴)食物在胃里是如何消化的?
(1)历史上,针对动物的胃是只能研磨食物进行物理消化,还是能同时进行化学消化的问题有过争议。若穆、斯帕兰扎尼等科学家进行了实验:将一块肉装在由金属丝制成的小笼里,然后让鹰吞食这个小笼,过一段时间,将小笼从鹰体内取出。如果胃在进行物理消化同时,也能进行化学消化,科学家应该观察到的现象是 。【版权所有:21教育】
(2)为了研究胃内能进行化学消化的液体是一直存在的,还是在进食后的消化过程中才产生的,有人设计了以下两个实验:
实验甲:取一群人早餮后的胃内容物,进行成分分析。你认为哪种实验设计更合理,并说明理由: 。
(3)有同学猜想,可能胃内液体不能对不同营养素都进行一样的消化,准备以面包、脂肪块和蛋白块进行实验,请简述你的实验方案: 。
(4)同学们查阅文献资料发现,人体的胃液中存在胃蛋白酶。为了研究pH对胃蛋白酶催化作用的影响,他们在适宜的温度下,以蛋白块为材料进行了实验,结果如图所示,从中可以得到的结论是 。
【答案】(1)肉块消失或明显变小
(2)实验甲,样本数大,又使研究对象一晚饥饿,排尽胃内物体(合理答案均可)
(3)取同样大小(同样质量)的面包、脂肪块和蛋白块,切成同样大小的小块,浸泡在相同胃液里,观察消失情况(或观察消失的时间长短)
(4)胃蛋白酶的催化作用与PH有关。当PH约等于2时,胃蛋白酶的催化作用最强(合理答案均可)
参考答案
【针对性训练】
1、【解析】此题考查酸碱指示剂的性质及常见物质溶液的酸碱性。由题干信息可知,花青素遇酸性溶液变红色,食盐、味精的溶液都显中性,香油不溶于水,所以,A、B、D错误;食醋中含有醋酸,其水溶液显酸性,能使花青素变红色,故选C。
【答案】C
2、【解析】
(1)考查酸碱指示剂,紫色石蕊遇碱性物质变蓝;
(2)考查酸碱指示剂,紫色石蕊遇酸性物质变红;
(3)考查酸碱指示剂分别遇到酸性、碱性和中性物质变色情况,需要学生利用课上讲过的对比和控制变量的方法来解决问题;
(4)孔穴4中原来是氢氧化钠,向其中滴加稀硫酸,发生中和反应,方程式为2NaOH + H2SO4= Na2SO4+ 2H2O。
【答案】
(1)碱性;(2)2,5;(3)3
(4)2NaOH + H2SO4= Na2SO4+ 2H2O
3、【答案】B
【解析】pH<7的溶液呈酸性,且pH越小酸性越强;pH>7的溶液呈碱性,且pH越大碱性越强。故选B。
4、【解析】:乙能使紫色石蕊试液变蓝色,说明乙显碱性,溶液的pH大于7.
丙不能使紫色石蕊试液变色,说明丙显中性,溶液的pH等于7.
甲能使紫色石蕊试液变红色,说明甲显酸性,溶液的pH小于7.
【答案】A.
5、【解析】:(1)胃液注意成分是盐酸,与铁粉反应的化学方程式为:Fe+?2HCl?=?FeCl2+H2↑
(2)食物变质是食物与氧气反应?,铁生锈反应掉氧气,食物就不易变质(3)碳酸氢钠和碳酸钙都能与盐酸反应产生二氧化碳气体,使得胃内气体压力增大而引起胃穿孔??(4)A、氧化镁既不是碱类也不是盐类,错误;B、服用药物要适量?,正确;?C、碳酸钙能与盐酸反应,而且因含有钙元素可补钙,正确。故选B、C(5)?胃液pH的正常范围在0.9~1.5,过大或过小均不利于人体健康,酸性越弱越有利于病菌生存。
【答案】(1)Fe +2HCl = 2FeCl2+ H2↑
(2)氧气(只要写氧气即给分)
(3)碳酸氢钠和碳酸钙(4)B C (5)C
6、【解析】沙枣适宜的pH范围为碱性,不适宜在微酸性的土壤中种植。
【答案】D
7、【解析】胃液中含有盐酸,盐酸显酸性,PH<7.人大量喝水时,稀释胃液,胃液的pH增大,越来越接近7. 【答案】C
8、【解析】 A、从图中可以看出B点的pH值为7,所以可以判断该点为盐酸和氢氧化钠溶液恰好完全反应,故A说法正确; B、从图中可以看出,溶液的起始的pH大于7,所以可以判断起初的溶液为氢氧化钠溶液,即该实验时将盐酸滴入氢氧化钠溶液中,故B说法错误; C、无色酚酞遇酸性和中性溶液都不变色,而B点的pH=7,C点的pH小于7,所以这两点的溶液都为无色,故C说法正确; D、本实验借助于无色酚酞遇碱液变红,而在中性和酸性溶液中都不变色,从而判断碱溶液消失,说明盐酸和氢氧化钠溶液发生了反应,故D说法正确. 【答案】B.
9、【解析】试题分析:石灰水是氢氧化钙的水溶液,显碱性;用蒸馏水润湿后,溶液的碱性变弱,当溶液的pH大于7时,呈碱性,且pH越大,碱性越强,则测得的pH结果比实际值偏小。
【答案】B。
10、【解析】:(1)①由图可知仪器的名称是滴瓶;
②由表格可知紫薯汁遇到酸性的白醋和盐酸均变红,因此遇到稀硫酸显示的颜色也是红色;紫薯汁在酸性和碱性溶液中能显现不同的颜色,因此可以作为酸碱指示剂。
(2)pH的取值范围:pH<7时,溶液显酸性;pH>7时,溶液显碱性;pH=7时,溶液显中性。草木灰水pH>7,属于碱性溶液;白醋属于酸性溶液,所以pH<7。
(3)PH试纸的使用方法:取一小块试纸在表面皿或玻璃片上,用洁净干燥的玻璃棒蘸取待测液点滴于试纸的中部,观察变化稳定后的颜色,与标准比色卡对比,读出溶液的PH值,判断溶液的性质。A中将试纸浸入待测液中不正确。C操作中点滴板上有水,会使溶液被稀释,会导致所测的pH数值发生变化。所以应选择B项
【答案】(1)①滴瓶;
②紫薯汁;能
(2)碱性;<。
(3)B
实验探究案:有关溶液酸碱性的探究
【解析】:由于pH=7的溶液呈中性,所以猜想与假设:盐溶液的pH可能为:pH=7是中性溶液; (1)溶液的酸碱度反映的是溶液酸碱性强弱程度,可依据pH试纸的变色情况判断,而酸碱指示剂只能鉴定溶液的酸碱性,不能反应溶液的酸碱强弱程度; (2)结论:根据NaCl溶液、CuSO4溶液、K2CO3溶液三种盐溶液的pH可以知道,盐的溶液有的呈中性,有的呈碱性,有的呈酸性,所以盐的溶液不一定呈中性,原假设错误; 反思:上述两同学测得的数据,反映了溶液真实pH的是甲同学,因为用蒸馏水将pH试纸润湿再进行测量会稀释待测液,从而导致测量的结果不准确; 【答案】:中性;(1)①②;(2)结论:盐的溶液不一定呈中性;反思:甲;蒸馏水将pH试纸润湿会稀释待测液,从而导致测量的结果不准确;
1、【解析】溶液的pH小于7,溶液呈酸性,pH越小,酸性越强;溶液的pH大于7,溶液呈碱性,pH越大碱性越强;pH等于7,溶液呈中性。由表格中的数据可知,胆汁、血浆、胰液都呈碱性,胃液呈酸性,选B
【答案】B
2、【解析】:A 紫色石蕊使澄清石灰水和氢氧化钠溶液都变蓝,A不行;B 酚酞使澄清石灰水和氢氧化钠溶液都变红,B不行;C 碳酸钙只能和稀盐酸反应,和澄清石灰水和氢氧化钠都不反应,C不行;D 碳酸钾和稀盐酸反应有气泡,和澄清石灰水反应有白色沉淀,和氢氧化钠不反应。
【答案】:D
3、【解析】溶液的pH小于7,溶液呈酸性,pH越小,酸性越强;溶液的pH大于7,溶液呈碱性,pH越大碱性越强;pH等于7,溶液呈中性;选A
【答案】A
4、【解析】:A、尿液的pH为4.7~8.4,可能显酸性、中性、碱性.
B、唾液的pH为6.6﹣7.1,可能显酸性、中性、碱性.
C、血浆的pH为7.35﹣7.45,大于7,显碱性.
D、胃液的pH为0.9﹣1.5,小于7,显酸性.
根据当溶液的pH小于7时,呈酸性,且pH越小,酸性越强,胃液的pH最小,酸性最强.
【答案】D.
5、【解析】KOH、草木灰 、生石灰等物质溶于水溶液都呈碱性,pH>7;醋酸的溶液显酸性,pH<7。故选D。
【答案】D
6、【解答】花青素遇酸性溶液变红色,遇碱性溶液变蓝色,在凉拌紫甘蓝丝时,观察到菜丝变成红色,可知该调味品显酸性,因此是食醋,而食盐、味精、香油都不显酸性。
【答案】C
7、【解析】反应后溶液中的物质一定有生成的可溶性物质,还可能有剩余的反应物。滴加盐酸的体积为V1时,氢氧化钠有剩余,溶质为氯化钠和氢氧化钠,溶液呈碱性,酚酞试液呈现红色。滴加盐酸的体积为V2 时,刚好完全反应,溶质只有氯化钠,所以溶液中除了水分子外,主要的微粒是氯化钠电离产生的钠离子和氯离子。
【答案】(1)红色(或粉红色) (2)钠离子、氯离子(或Na+、 Cl-)
8、【解析】(1)氢氧化钠溶液与稀盐酸反应生成氯化钠和水,反应的化学方程式为:HCl+NaOH=NaCl+H2O。(2)烧杯中无色溶液的溶质可能只有NaCl,也可能还有HCl,确定是否含盐酸,紫色石蕊溶液遇酸性溶液变红,可选用紫色石蕊溶液,若变红,说明含有盐酸(或锌、碳酸钠、氧化铜等,锌、碳酸钠能与稀盐酸反应生成气体,氧化铜与稀盐酸反应生成氯化铜和水,会观察到黑色粉末溶解,溶液变蓝色)。
【答案】(1)HCl+NaOH=NaCl+H2O (2)石蕊溶液(或Zn、Na2CO3、CuO、Cu(OH)2等)
【解析】(1)若发生化学消化,则铁笼中的肉块能被消化,则现象为肉块消失或明显变小; (2)实验甲更合理,选取实验对象充足样本数大,又使研究对象一晚饥饿,排尽胃内物体,避免干扰(合理答案均可); (3)设计实验方案:取同样大小(同样质量)的面包、脂肪块和蛋白块,切成同样大小的小块,浸泡在相同胃液里,观察消失情况(或观察消失的时间长短); (4)观察图可看出胃蛋白酶的催化作用与pH有关。当pH约等于2时,胃蛋白酶的催化作用最强。 故答案为:(1)肉块消失或明显变小;(2)实验甲,样本数大,又使研究对象一晚饥饿,排尽胃内物体(合理答案均可);(3)取同样大小(同样质量)的面包、脂肪块和蛋白块,切成同样大小的小块,浸泡在相同胃液里,观察消失情况(或观察消失的时间长短);(4)胃蛋白酶的催化作用与pH有关。当pH约等于2时,胃蛋白酶的催化作用最强。????
【答案】(1)肉块消失或明显变小
(2)实验甲,样本数大,又使研究对象一晚饥饿,排尽胃内物体(合理答案均可)
(3)取同样大小(同样质量)的面包、脂肪块和蛋白块,切成同样大小的小块,浸泡在相同胃液里,观察消失情况(或观察消失的时间长短)
(4)胃蛋白酶的催化作用与PH有关。当PH约等于2时,胃蛋白酶的催化作用最强(合理答案均可)
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
