培优学案:第三单元 到实验室中去:配制一定溶质质量分数的溶液(含单元复习)
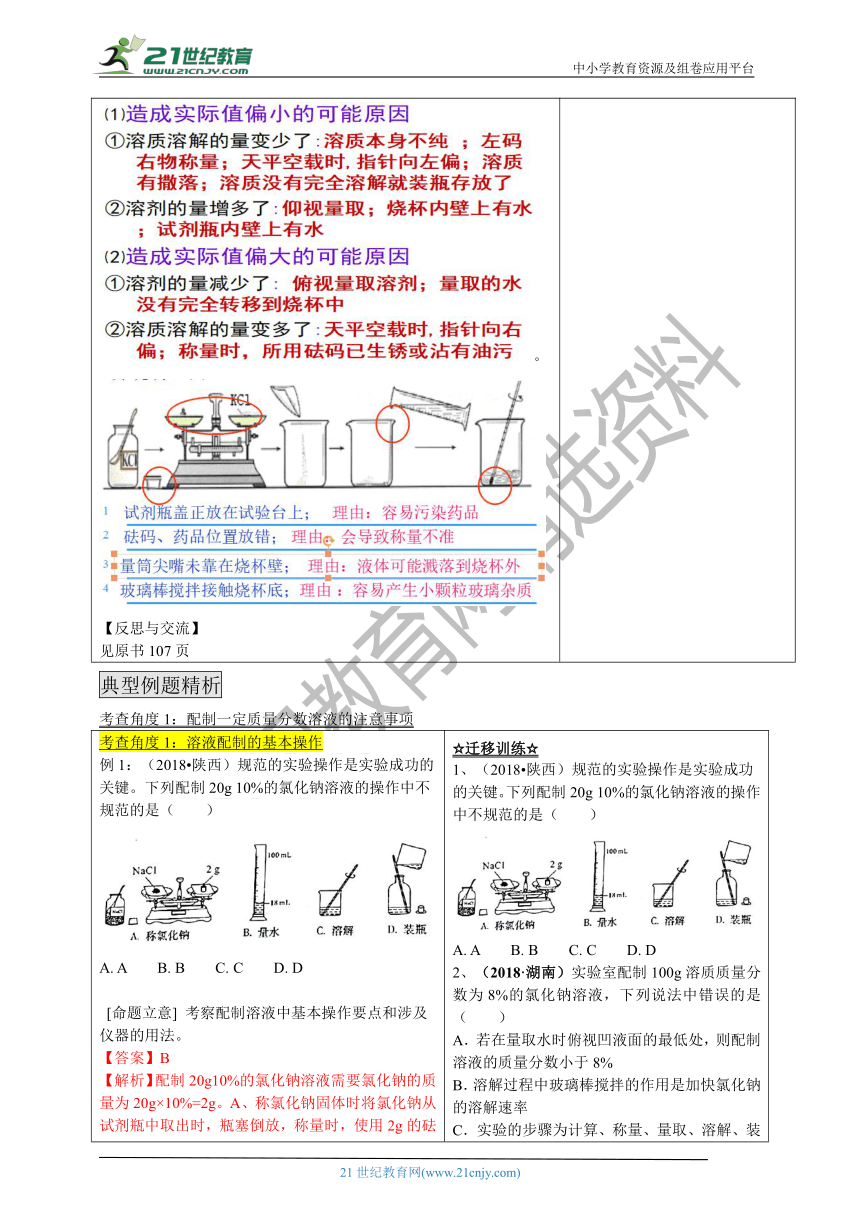
文档属性
| 名称 | 培优学案:第三单元 到实验室中去:配制一定溶质质量分数的溶液(含单元复习) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-26 10:33:42 | ||
图片预览



文档简介
第三单元 溶液
到实验室中去:配制一定质量分数的溶液
实验全面解读
【实验目的】
1、与同学合作配制80g溶质的质量分数为10%的氯化钠溶液,
初步学会配制一定溶质质量分数的溶液的方法
2、加深对溶质的质量分数概念的理解。
3、进一步练习、巩固托盘天平、量筒、玻璃棒、胶头滴管的使用和基本实验操作
4、探究导致实验结果偏大或偏小的原因
【实验用品】
托盘天平、烧杯、玻璃棒、药匙、量筒(10mL、
100 mL);氯化钠、蒸馏水。
【实验过程】
复习回顾托盘天平(或电子秤)的使用方法,以及量取和搅拌液体等操作方法。
【动手实验】
步骤名称
操作方法
1.计算
⑴所需氯化钠的质量:80g×10%=8g
⑵所需水的质量:80g-8g=72g,需水的体积为72mL
2.称量
⑴用托盘天平称量8g氯化钠
⑵用100mL的量筒量取72mL蒸馏水
3.溶解
将称得的8g食盐放入量取的72mL蒸馏水中,并用玻璃棒搅拌,至氯化钠完全溶解
4.装瓶存放
将步骤3所得溶液,用玻璃棒引流,倒入细口瓶中,盖上瓶塞,并贴上标签。
【误差分析】
。
【反思与交流】
见原书107页
【巧记】量取液体时读数方法和所得溶质的质量分数的关系:俯大仰小
典型例题精析
考查角度1:配制一定质量分数溶液的注意事项
考查角度1:溶液配制的基本操作
例1:(2018?陕西)规范的实验操作是实验成功的关键。下列配制20g?10%的氯化钠溶液的操作中不规范的是( )
A. A B. B C. C D. D
[命题立意] 考察配制溶液中基本操作要点和涉及仪器的用法。
【答案】B
【解析】配制20g10%的氯化钠溶液需要氯化钠的质量为20g×10%=2g。A、称氯化钠固体时将氯化钠从试剂瓶中取出时,瓶塞倒放,称量时,使用2g的砝码,天平左右两边各放一张大小相同的干净纸片,正确;B、量取18mL水的体积应使用能一次量取最小规格的量筒,应选用20mL量筒进行量取,错误;C、溶解时使用玻璃棒搅拌,加速氯化钠的溶解,正确;D、装瓶时,瓶塞倒放,用玻璃棒引流,慢慢将配置好的氯化钠溶液注入试剂瓶中,正确。故选B。
【解法指导】取固体时应该用药匙,且瓶盖倒放;量筒量取时要选择合适量程的量筒,读数时平视凹液面的最低处;溶解时要用玻璃棒不断搅拌,以加速溶解;称量固体时要遵循左物右码的原则。
☆迁移训练☆
1、(2018?陕西)规范的实验操作是实验成功的关键。下列配制20g?10%的氯化钠溶液的操作中不规范的是( )
A. A B. B C. C D. D
2、(2018·湖南)实验室配制100g溶质质量分数为8%的氯化钠溶液,下列说法中错误的是( )
A.若在量取水时俯视凹液面的最低处,则配制溶液的质量分数小于8%
B.溶解过程中玻璃棒搅拌的作用是加快氯化钠的溶解速率
C.实验的步骤为计算、称量、量取、溶解、装瓶贴标签
D.量取水时,用规格为l00mL的量筒
字
考查角度2:配制溶液的误差分析
例2:(2018?河南)实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏小的是( )
①称量的氯化钠固体中含有不溶性杂质;
②用量筒量取水时仰视读数;
③往烧杯中加水时有水洒出;
④将配制好的溶液装入试剂瓶中时有少量溅出。
A.①② B.①③ C.②④ D.③④
【命题立意】
结合配制溶液时所用药品及基本操作分析导致配制结果不准确的原因。
【解答】①称量的氯化钠固体中含有不溶性杂质,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小。
②用量筒量取水时仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小。
③往烧杯中加水时有水洒出,会造成实际量取的水的体积偏小,则使溶质质量分数偏大。
④将配制好的溶液装入试剂瓶中时有少量溅出,溶液具有均一性,溶质质量分数不变。
故①②操作会导致结果偏小。
【答案】A。
【解法指导】溶质的质量分数偏小的原因:溶质少了或溶剂多了;常见具体原因有:称量物质不纯、转移时洒在烧杯外边、量取水时仰视读数。溶质的质量分数偏大的原因:溶质多了或溶剂少了。如:砝码生锈了、量取水时俯视读数了。
☆迁移训练☆
3、(2018?雅安)(1)下图是配制过程,正确的操作顺序为_______(填字母) 。
A.①②③④ B.②①④③ C.②④①③
(2) 在其它操作均正确的情况下,若在配制溶液过程中,仰视刻度量取蒸馏水,则所配制溶液中,谷氨酸钠的质量分数____(填“偏大”、“偏小”或“无影响”),所测定的味精中NaCI的质量分数___(填“偏大”、“偏小”或“无影响”)。
考查角度3:配制、计算、误差分析的综合考察
例3:(2018?滨州)小芳在配制一定溶质质量分数的氯化钠溶液时,没有按照正确的称量氯化钠。量取水的操作规程进行操作(图示为小芳操作时的读数,其它操作都正确)。小芳实际配制的氯化钠溶液的溶质质量分数(水的密度为1g/cm3)约为( )
A.12.4% B.17.2% C.16.9% D.12.5%
【命题立意】综合考察溶液的溶质质量分数的计算、溶液配制,及引起结果偏大或偏小的原因。
【解答】解:小芳用托盘天平称量时,将药品与砝码的位置放反了,使用的是10g和5g的砝码和2.7g的游码;由左盘的质量=右盘的质量+游码的质量可知:砝码质量=药品质量+游码的质量,所以药品质量=砝码质量﹣游码质量,即药品质量=10g+5g﹣2.7g=12.3g。
量取的水的实际体积为87mL(合87g)。
小芳实际配制的氯化钠溶液的溶质质量分数为×100%≈12.4%。
【答案】A。
【解法指导】1、熟记配制溶液的步骤和仪器即基本操作;2、熟练掌握溶液的计算公式,并能熟练计算。结合溶液的配制过程中的具体操作,分析某具体操作所得溶液中溶质的质量分数。3、知道称量固体、量取液体时错误操作的后果。
☆迁移训练☆
4、(2018?山东泰安)以下是初中化学一些基本实验,请根据实验内容回答下列问题:
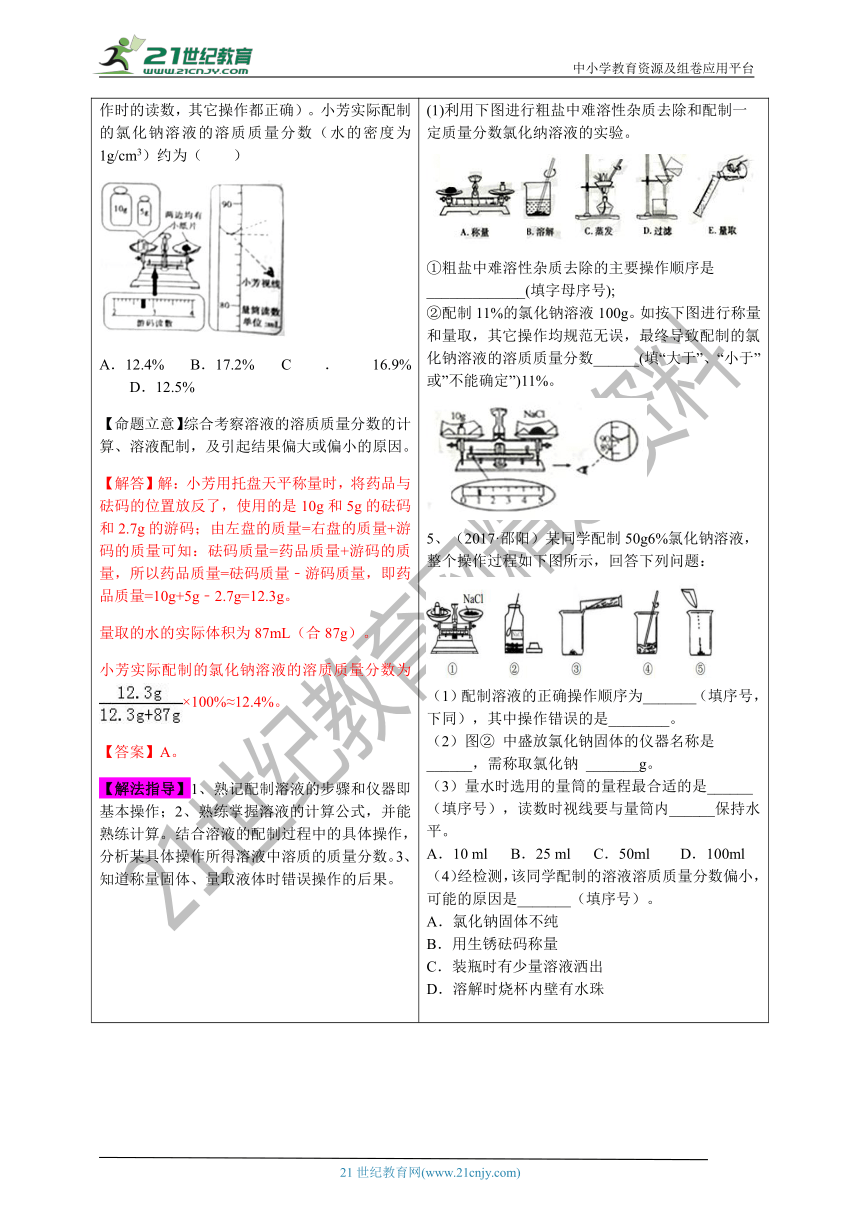
(1)利用下图进行粗盐中难溶性杂质去除和配制一定质量分数氯化纳溶液的实验。
①粗盐中难溶性杂质去除的主要操作顺序是_____________(填字母序号);
②配制11%的氯化钠溶液100g。如按下图进行称量和量取,其它操作均规范无误,最终导致配制的氯化钠溶液的溶质质量分数______(填“大于”、“小于”或”不能确定”)11%。
5、(2017·邵阳)某同学配制50g6%氯化钠溶液,整个操作过程如下图所示,回答下列问题:
(1)配制溶液的正确操作顺序为_______(填序号,下同),其中操作错误的是________。
(2)图② 中盛放氯化钠固体的仪器名称是 ______,需称取氯化钠 _______g。
(3)量水时选用的量筒的量程最合适的是______(填序号),读数时视线要与量筒内______保持水平。
A.10 ml B.25 ml C.50ml D.100ml
(4)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是_______(填序号)。
A.氯化钠固体不纯
B.用生锈砝码称量
C.装瓶时有少量溶液洒出
D.溶解时烧杯内壁有水珠
单元复习课
知识体系
专题归纳
专题1:溶液的组成
【专题突破】
【典例精析】
例1: (2018?益阳)如表是NaCl、NH4Cl在不同温度时的溶解度(一定温度下,100g水中溶解的最大量)。
温度/℃
0
20
40
60
80
溶解度/g
NaCl
35.7
36.0
36.6
37.3
38.4
NH4Cl
29.4
37.2
45.8
55.2
65.6
(1)以上两种物质的溶解度受温度影响较大的是 。
(2)40℃时,将40.6gNaCl加入到100g水中,充分搅拌使之溶解,所得溶液的质量为 。
(3)20℃时,NaCl饱和溶液的溶质质量分数为(精确到小数点后1位) 。
【答案】(1)NH4Cl;(2)136.6g;(3)26.5%。
【解答】解:(1)由NaCl、NH4Cl 在不同温度时的溶解度表,两种物质的溶解度受温度影响较大的是NH4Cl。
(2)40℃时,NaCl的溶解度是36.6g,40℃时,将 40.6g NaCl 加入到 100g 水中,充分搅拌使之溶解,最多能溶解36.6g,则所得溶液的质量为36.6g+100g=136.6g。
(3)饱和溶液中溶质质量分数=溶解度
溶解度+100g
×100%,20℃时,NaCl 饱和溶液的溶质质量分数为36.0g
36.0g+100g
×100%≈26.5%。
例2:(2017?沈阳)按下列方法配制的溶液,其溶质质量分数为5%的是( )A.称取5.0g氯化钾,溶解在95mL水中,充分搅拌
B.称取5.0g生石灰,放入95mL水中,充分搅拌
C.量取5.0mL浓盐酸,倒入95mL水中,充分搅拌
D.称取5.0g二氧化锰,放入95mL水中,充分搅拌
【答案】A
【解答】解:A.氯化钾能溶解于水,5.0g氯化钾,溶解在95mL.水中计算溶质质量分数为5g÷(5g+95g)×100% =5%,故正确;
B.生石灰与水反应生成熟石灰,熟石灰微溶于水,故错误;
C.5.0mL浓盐酸是溶液的体积不能得出溶质氯化氢的质量,故不能求得溶质质量分数,故错误;
D.二氧化锰不溶于水,得不到溶液,故错误;
例3:(2018?丽水、金华)12.20℃时,在各盛有100克水的烧杯中,分别加入10克甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。下列说法正确的是( )
A.所得溶液可能都是饱和溶液
B.20℃时,乙溶液的溶质质量最小
C.溶液溶质的质量分数:甲>丙>乙
D.升高温度,溶液溶质的质量分数一定变大
【答案】A
【解析】A.甲和丙中均有不溶解的溶质存在,说明二者均已饱和,根据乙物质没有未溶解的固体,可知乙溶液可能为饱和溶液,也可能为不饱和溶液,故A正确;
B. 20℃时,据图可知,在三个各盛有100g水中,所溶解的三种物质的质量由大到小的顺序为:乙>丙>甲,乙溶液中溶质的质量最大,故B错误;
C. 20℃时,据图可知,在三个各盛有100g水中,所溶解的三种物质的质量由大到小的顺序为:乙>丙>甲,所以三溶液中溶质的质量分数乙>丙>甲,,故C错误;
D.乙物质已经完全溶解在水中,如升高温度可能不会对溶质的质量产生影响,所以乙溶液中溶质的质量分数不一定改变,故D错误。
故选:A。
【迁移训练】
1、(2017?资阳)20℃时,有质量分数为5%的食盐溶液A和质量分数为26.47%的食盐溶液B,下列有关A、B两种食盐溶液的判断正确的是( )
A.向m g溶液B中加入x g食盐,振荡后,溶液的质量不变,则食盐在20℃时的溶解度为36
B.等质量的A、B中,溶剂质量:B>A
C.m g溶液B中的溶质质量为100m/26.47 g
D.向m g溶液A中加入x g食盐,振荡后,溶液的质量>m g
2、(2018?泰州)实验室用氯化钠固体配制50g15%的氯化钠溶液的步骤有:计算、称取氯化钠、量取水、溶解、转移。
①在溶解过程中,玻璃棒的作用是_____________________。
②下列操作中,可能导致配制氯化钠溶液的溶质质量分数偏大的是_______(填序号)。
a.称取时,将氯化钠置于托盘天平的右盘
?b.量取水时俯视读数
?c.用已有少量水的烧杯溶解氯化钠
?d.转移时,有少量溶液溅出
3、(2018湖南省衡阳市,题号10,分值2)实验室配制100g溶质质量分数为8%的氯化钠溶液,下列说法中错误的是( )
A.若在量取水时俯视凹液面的最低处,则配制溶液的质量分数小于8%
B.溶解过程中玻璃棒搅拌的作用是加快氯化钠的溶解速率
C.实验的步骤为计算、称量、量取、溶解、装瓶贴标签
D.量取水时,用规格为l00mL的量筒
4、(2018·雅安)ZnSO4饱和溶液的溶质质量分数随温度变化的曲线如图所示。下列说法正确的是
A. N点对应的ZnSO4溶液升温或降温均都可能析出晶体
B. M点对应的ZnSO4溶液是不饱和溶液
C. ZnSO4饱和溶液的溶质质量分数随温度升高而增大
D. 40℃时,ZnSO4的溶解度为41g
5、(2018?嘉兴)硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是
A. 操作I一定是降温 B. 操作I一定是加溶质
C. ①与③的溶质质量一定相等 D. ②与③的溶质质量分数一定相等
专题2:溶液的配制
【专题突破】
※※ 用浓溶液稀释配制,步骤是:计算、量取、混匀、装瓶贴标签。
例1、(2018·辽阳)小丽在配制一定溶质质量分数的氯化钠溶液时,计算所需氯化钠的质量和水的体积后,进行了如图所示的实验:
请回答:
(1)操作中不规范的步骤是_____(填序号)。
(2)改正后,图示实验中正确的操作顺序是_____(填字号)。
(3)⑤中玻璃棒作用是_____。
(4)小丽发现图示实验操作步骤不完整,应补充的是_____。
【答案】(1)③(2)②①④③⑤(3)搅拌,加速溶解(4)装瓶贴标签
【解析】(1)操作中不规范的步骤是③,在倾倒液体时应沿烧杯壁倒入;
(2)在配制一定溶质质量分数的氯化钠溶液时应先计算,称量食盐,加入到烧杯中,再量取水,倒入烧杯中搅拌溶解,所以正确的操作顺序是:②①④③⑤;
(3)⑤溶解,玻璃棒的作用是搅拌,加速溶解;
(4)小丽发现图示实验操作步骤不完整,应补充的是装瓶贴标签。
【迁移训练】
6、(2018·雅安))味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl,其它成分不考虑。请回答下列问题:
(1)味精中至少含有 (填数字)种元素。
(2)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是 (填字母)。
A.5mL B. 10 mL C. 50 mL D. 100 mL
(3)下图是配制过程,正确的操作顺序为 (填字母) 。
A.①②③④ B.②①④③ C.②④①③
7、(海淀区练习题)20 ℃时氯化钾的溶解度为34g。下列是四位同学在20 ℃时配制的氯化钾溶液,其中一定达到饱和的是( )
A.B.C.D.
8、(2017?成都)根据图示实验,下列说法正确的是
A. 氯化钠溶液不能溶解其他溶质
B. 20ml水中溶解氯化钠的最大质量是定值
C. 加热后溶液中硝酸钾的质量分数变大
D. 加热后硝酸钾溶液是不饱和溶液
思想方法
控制变量原法探究影响溶解速率的因素
内容
探究方法
现象
结论
颗粒大小对溶解速率的影响
取大、中、小三块相同质量的KNO3固体分别放入相同质量的水中
小块KNO3固体首先溶解完
_①______________
水温对溶解速率的影响
_②______________
③_________
④_________
搅拌对溶解速率的影响
⑤_________________
⑥______
⑦__________
突破压轴题
(2017?苏州)探究相同条件下同种溶质在不同溶剂中的溶解性,某兴趣小组同学进行如下两组实验。(提示:本实验所川汽油与KMnO4、碘均不发生化学反应)
【实验l】KMnO4晶体在不同溶剂中的溶解实验
根据实验步骤、实验操作图示填写相关实验现象。
实验步骤
实验操作图示
实验操作及现象
步骤1
振荡后静置:
(1)A试管中晶体全部溶解,溶液呈________色;B试管中晶体不溶解,汽油不变色。
步骤2
将步骤1中A试管内溶液倒人B试管中,振荡后静置:(2)B试管中观察到的现象为__________。
【实验2]碘在不同溶剂中的溶解实验
根据实验操作图示回答相关问题。
实验操作图示
实验结论或解释
(3)由图2所示现象叮知:碘_____(选填“不”、“微”或“易”)溶于水
(4)图3所示试管中液体分层。上层紫红色溶液的名称是________。说明碘在汽油中的溶解性比在水中_____(选填“强”或“弱”)
【反思与应用】
(5)①碘易溶于酒精。若【实验2】中汽油用酒精代替,振荡后静置,最终所得液体______(选填“分层”或“小分层”)。
②“从稀碘水巾提取碘”是“海带提碘”工艺巾的一个重要步骤,其原理类似【实验2]中第二步操作。工业实际生产时使用其他挥发性液体代替汽油,这种挥发性液体必须具备的条件是________。
参考答案与提示
典型例题精析
【迁移训练】
1、【答案】B
【解析】配制20g10%的氯化钠溶液需要氯化钠的质量为20g×10%=2g。A、称氯化钠固体时将氯化钠从试剂瓶中取出时,瓶塞倒放,称量时,使用2g的砝码,天平左右两边各放一张大小相同的干净纸片,正确;B、量取18mL水的体积应使用能一次量取最小规格的量筒,应选用20mL量筒进行量取,错误;C、溶解时使用玻璃棒搅拌,加速氯化钠的溶解,正确;D、装瓶时,瓶塞倒放,用玻璃棒引流,慢慢将配置好的氯化钠溶液注入试剂瓶中,正确。故选B。
2、【答案】A
【解析】此题主要考查的是一定溶质的质量分数溶液的配制。用量筒量取水时俯视读数,会使量取的水体积偏小。
A.用量筒量取水时俯视读数,会使量取的水体积偏小,溶质的质量分数偏大,故说法错误;
B.溶解过程中玻璃棒的作用是搅拌,加快溶解速率,故说法正确;
C.实验室配制一定溶质质量分数的溶液,实验步骤为计算、称量、量取、溶解、装瓶贴标签,故说法正确;
D.本实验中要量取92mL水,应使用规格为l00mL的量筒,故说法正确
3、【答案】 (1). B (2). 偏小
【解析】味精是常用的调味品,化学式是C5H8NO4Na。(1)味精中至少含有碳、氢、氧、氮、钠和氯6种元素。(2)称取5.0g味精配制成50g溶液,根据就近原则,量取蒸馏水的量筒规格是50 mL,故选C。(3)配制过程,正确的操作顺序为②①④③,故选B。(4)测定NaCl在味精中的质量分数。①向所配制的50g溶液中加入AgNO3溶液充分反应,检验沉淀是否完全的方法是:静置后,在上层清液中加入AgNO3溶液,与氯化钠反应生成氯化银白色沉淀,观察是否有沉淀生成。②在配制溶液过程中,仰视刻度量取蒸馏水,读数比实际少,则所配制溶液中,谷氨酸钠的质量分数偏小。
4、【答案】 (1). BDC (2). 小于
【解析】
(1)①粗盐中难溶性杂质去除的主要操作顺序为溶解、过滤、蒸发。故填:BDC;
②如图量取蒸馏水时,仰视读数,会导致量取的水的体积偏大,导致配制的溶液中溶质质量分数小于11%
5、【答案】(1)②①⑤③④ ① (2)广口瓶3或3.0 (3)C 凹液面最低处 (4) AD
【解析】(1)配制溶液的正确操作顺序为计算、称量、溶解、装瓶存放,即②①⑤③
④ ;称量固体时,应遵循左物右码的原则;
(2)图②中盛放氯化钠固体的仪器名称是广口瓶,氯化钠的质量是50g×6%=3g (3)取水的量为47mL,所以应用50mL的量筒;量取液体视线应平视凹液面最低处 (4) 配制的溶液溶质质量分数偏小的原因是溶质偏少或者溶剂偏多。氯化钠固体不纯,导致氯化钠偏少;溶解时烧杯内壁有水珠,导致水的量偏多。
单元复习课
【迁移训练】
1、【答案】D。
【解答】解:A、向mg溶液B中加入xg食盐,振荡后,溶液的质量不变,则食盐在20℃时的溶解度为36g,不是36;故选项错误;
B、等质量的A、B中,溶剂质量:B<A,B>A错误;故选项错误;
C、mg溶液B中的溶质质量为26.47m/100g,100m/26.47g错误;故选项错误;
D、向mg溶液A中加入xg食盐,振荡后,溶液的质量>mg正确,因为mg溶液中又溶解了食盐;故选项正确;
2、【答案】 (1).搅拌加速溶解 (2). b
【解析】(1).实验室用氯化钠固体配制50g15%的氯化钠溶液的步骤有:计算、称取氯化钠、量取水、溶解、转移。①在溶解过程中,玻璃棒的作用是搅拌加速溶解速率。②可能导致配制氯化钠溶液的溶质质量分数偏大的是b,量筒俯视读数比实际大。
3、【答案】A
【解析】此题主要考查的是一定溶质的质量分数溶液的配制。用量筒量取水时俯视读数,会使量取的水体积偏小。
A.用量筒量取水时俯视读数,会使量取的水体积偏小,溶质的质量分数偏大,故说法错误;
B.溶解过程中玻璃棒的作用是搅拌,加快溶解速率,故说法正确;
C.实验室配制一定溶质质量分数的溶液,实验步骤为计算、称量、量取、溶解、装瓶贴标签,故说法正确;
D.本实验中要量取92mL水,应使用规格为l00mL的量筒,故说法正确。
4、【答案】A
【解析】根据硫酸锌的饱和溶液的溶质质量分数随温度变化的曲线可知,在0°到70°之间,硫酸锌饱和溶液的溶质质量分数随温度的升高而增大,所以它的溶解能力(溶解度)随温度的升高而增大,在70°时,溶解度是最大的;大于70°时,硫酸锌饱和溶液的溶质质量分数随温度的升高而降低,所以硫酸锌的溶解度随着温度的升高而降低。
A.根据曲线分析可知,硫酸锌的溶质质量分数先升高后降低,70°时硫酸锌的溶解度最大(70°为拐点),大于70°或者小于70°,硫酸锌的溶质质量分数都会减小,所以 N点对应的ZnSO4溶液升温或降温均都可能析出晶体,这个说法是正确的,所以A正确;
B.M点是硫酸锌的饱和溶液的溶质质量分数随温度变化的曲线上的点,所以M点对应的ZnSO4溶液是饱和溶液,所以B错误;
C.根据曲线分析可知,硫酸锌的溶质质量分数随温度先升高后降低,70°时硫酸锌的溶解度最大(70°为拐点)。在0°到70°之间,ZnSO4饱和溶液的溶质质量分数随温度升高而升高;大于70°时,ZnSO4饱和溶液会有晶体析出,溶质的质量分数随温度升高而降低,所以C错误;
D.根据曲线分析可知,40℃时,ZnSO4饱和溶液的溶质质量分数为41%,并不是溶解度是41g,,所以D错误。
5、【答案】D
【解析】A.饱和溶液是:在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。要使固体物质的不饱和溶液变为饱和溶液,常用方法有:增加溶质、减少溶剂、降低温度。所以操作I不一定是降温,错误;B. 操作I不一定是加溶质,错误;C.被溶解的物质叫溶质, ①至③的过程中有固体析出,溶质质量减少,①比③的溶质多,错误; D. ,②与③是同种物质在同种溶剂、同一温度下的饱和溶液,溶质质量分数一定相等,正确。故选D。
6、【答案】(1) 5;(2) C;(3) B;
【解析】(1) “谷氨酸钠”化学式是C5H8NO4Na,有5种元素组成;
(2)称取5.0g味精配制成50g溶液,需要水的质量为50g-5g=45g,体积是45.0mL,实验中应根据所取溶液的体积,尽可能选用一次量取的最小规格的量筒,量取45.0mL蒸馏水最好选用50mL的量筒,所以本题填C;
(3)配置溶液的正确顺序是1.称量;2.把固体倒入容器内;3. 把水倒入容器内4.搅拌,所以②①④③是正确的,本题填B;
7、【答案】B
【解析】A、20℃时氯化钾的溶解度为34g,含义是20℃时,100g水中最多能溶解氯化钾34g,溶液达到饱和状态,则20℃时,50g水中最多能溶解氯化钾17g,溶液达到饱和状态,向50g水中加入10g氯化钾,所得溶液是不饱和溶液,错误;B、20℃时氯化钾的溶解度为34g,含义是20℃时,100g水中最多能溶解氯化钾34g,溶液达到饱和状态,则20℃时,50g水中最多能溶解氯化钾17g,溶液达到饱和状态,向50g水中加入17g氯化钾,所得溶液是恰好是饱和溶液,正确;C、20℃时氯化钾的溶解度为34g,含义是20℃时,100g水中最多能溶解氯化钾34g,溶液达到饱和状态,20℃时,向100g水中加入20g氯化钾,所得溶液是不饱和溶液,错误;D、20℃时氯化钾的溶解度为34g,含义是20℃时,100g水中最多能溶解氯化钾34g,溶液达到饱和状态,20℃时,向100g水中加入33g氯化钾,所得溶液是不饱和溶液,错误。故选B。
8、【答案】C
【解析】A、饱和溶液只对某种溶质而言是饱和的,而对于其他的物质是不饱和的,故氯化钠溶液可以溶解其他的物质,故错误;
B、20ml水中溶解氯化钠的最大质量与溶液的温度有关,故不是定值,错误;
C、加热后溶液中水蒸发,故硝酸钾的质量分数变大,正确;
D、加热后硝酸钾溶液中的水蒸发,溶液变为饱和溶液,错误。故选C。
思想方法
【答案】①固体物质颗粒越小溶解速率越快
②取两份大小、质量相同的KNO3固体,分别放入盛有同量水的烧杯中,给其中一只烧杯加热,一只静置,均不搅拌
③加热的烧杯中KNO3固体先溶解完
④加热可以加速物质的溶解速率
⑤取两份大小、质量相同的KNO3固体,分别放入盛有同质量同温度水的烧杯中,其中一只烧杯用玻璃棒搅拌 ⑥用玻璃棒搅拌烧杯中KNO3固体先溶解完
⑦搅拌可以加速物质的溶解速率
【解析】根据只要能改变固体与水的接触就能改变固体的溶解速率分析解答。颗粒大小对溶解速率的影响:根据小块KNO3固体首先溶解完得出的结论是固体物质颗粒越小溶解速率越快;水温对溶解速率的影响:探究方法是取两份大小、质量相同的KNO3固体,分别放入盛有同量水的烧杯中,给其中一只烧杯加热,一只静置,均不搅拌;现象是加热的烧杯中KNO3固体先溶解完;结论是加热可以加速物质的溶解速率;搅拌对溶解速率的影响:探究方法是取两份大小、质量相同的KNO3固体,分别放入盛有同质量同温度水的烧杯中,其中一只烧杯用玻璃棒搅拌;现象是用玻璃棒搅拌烧杯中KNO3固体先溶解完;结论是搅拌可以加速物质的溶解速率。
突破压轴题
【答案】(1)紫(紫红、红)
(2)液体分层,上层为无色,下层为紫红色,试管底部无固体残留
(3)微(4)碘的汽油溶液强(5)①不分层 ②与水不互溶,碘在这种液体中的溶解度远大于在水中的溶解度
【解析】(1)高锰酸钾能溶解在水中形成紫红色的溶液;将高锰酸钾溶液倒入汽油中,B试管中的高锰酸钾会溶解在水中,且还会发生分层现象,即液体分层,上层为无色,下层为紫红色,试管底部无固体残留;(3)由图可知,加入水后变成了淡黄色,故碘微溶与水;(4)碘微溶于水,但能溶解在汽油中形成碘的汽油溶液;(5)①汽油和酒精均属有机溶剂,有机物能溶解在有机溶剂中,即碘能溶解在酒精中形成碘酒溶液,故若【实验2】中汽油用酒精代替,振荡后静置,最终所得液体不分层;②“从稀碘水巾提取碘”,使用其他挥发性液体代替汽油,这种挥发性液体必须与水不互溶,碘在这种液体中的溶解能力远大于在水中的溶解能力
到实验室中去:配制一定质量分数的溶液
实验全面解读
【实验目的】
1、与同学合作配制80g溶质的质量分数为10%的氯化钠溶液,
初步学会配制一定溶质质量分数的溶液的方法
2、加深对溶质的质量分数概念的理解。
3、进一步练习、巩固托盘天平、量筒、玻璃棒、胶头滴管的使用和基本实验操作
4、探究导致实验结果偏大或偏小的原因
【实验用品】
托盘天平、烧杯、玻璃棒、药匙、量筒(10mL、
100 mL);氯化钠、蒸馏水。
【实验过程】
复习回顾托盘天平(或电子秤)的使用方法,以及量取和搅拌液体等操作方法。
【动手实验】
步骤名称
操作方法
1.计算
⑴所需氯化钠的质量:80g×10%=8g
⑵所需水的质量:80g-8g=72g,需水的体积为72mL
2.称量
⑴用托盘天平称量8g氯化钠
⑵用100mL的量筒量取72mL蒸馏水
3.溶解
将称得的8g食盐放入量取的72mL蒸馏水中,并用玻璃棒搅拌,至氯化钠完全溶解
4.装瓶存放
将步骤3所得溶液,用玻璃棒引流,倒入细口瓶中,盖上瓶塞,并贴上标签。
【误差分析】
。
【反思与交流】
见原书107页
【巧记】量取液体时读数方法和所得溶质的质量分数的关系:俯大仰小
典型例题精析
考查角度1:配制一定质量分数溶液的注意事项
考查角度1:溶液配制的基本操作
例1:(2018?陕西)规范的实验操作是实验成功的关键。下列配制20g?10%的氯化钠溶液的操作中不规范的是( )
A. A B. B C. C D. D
[命题立意] 考察配制溶液中基本操作要点和涉及仪器的用法。
【答案】B
【解析】配制20g10%的氯化钠溶液需要氯化钠的质量为20g×10%=2g。A、称氯化钠固体时将氯化钠从试剂瓶中取出时,瓶塞倒放,称量时,使用2g的砝码,天平左右两边各放一张大小相同的干净纸片,正确;B、量取18mL水的体积应使用能一次量取最小规格的量筒,应选用20mL量筒进行量取,错误;C、溶解时使用玻璃棒搅拌,加速氯化钠的溶解,正确;D、装瓶时,瓶塞倒放,用玻璃棒引流,慢慢将配置好的氯化钠溶液注入试剂瓶中,正确。故选B。
【解法指导】取固体时应该用药匙,且瓶盖倒放;量筒量取时要选择合适量程的量筒,读数时平视凹液面的最低处;溶解时要用玻璃棒不断搅拌,以加速溶解;称量固体时要遵循左物右码的原则。
☆迁移训练☆
1、(2018?陕西)规范的实验操作是实验成功的关键。下列配制20g?10%的氯化钠溶液的操作中不规范的是( )
A. A B. B C. C D. D
2、(2018·湖南)实验室配制100g溶质质量分数为8%的氯化钠溶液,下列说法中错误的是( )
A.若在量取水时俯视凹液面的最低处,则配制溶液的质量分数小于8%
B.溶解过程中玻璃棒搅拌的作用是加快氯化钠的溶解速率
C.实验的步骤为计算、称量、量取、溶解、装瓶贴标签
D.量取水时,用规格为l00mL的量筒
字
考查角度2:配制溶液的误差分析
例2:(2018?河南)实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏小的是( )
①称量的氯化钠固体中含有不溶性杂质;
②用量筒量取水时仰视读数;
③往烧杯中加水时有水洒出;
④将配制好的溶液装入试剂瓶中时有少量溅出。
A.①② B.①③ C.②④ D.③④
【命题立意】
结合配制溶液时所用药品及基本操作分析导致配制结果不准确的原因。
【解答】①称量的氯化钠固体中含有不溶性杂质,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小。
②用量筒量取水时仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小。
③往烧杯中加水时有水洒出,会造成实际量取的水的体积偏小,则使溶质质量分数偏大。
④将配制好的溶液装入试剂瓶中时有少量溅出,溶液具有均一性,溶质质量分数不变。
故①②操作会导致结果偏小。
【答案】A。
【解法指导】溶质的质量分数偏小的原因:溶质少了或溶剂多了;常见具体原因有:称量物质不纯、转移时洒在烧杯外边、量取水时仰视读数。溶质的质量分数偏大的原因:溶质多了或溶剂少了。如:砝码生锈了、量取水时俯视读数了。
☆迁移训练☆
3、(2018?雅安)(1)下图是配制过程,正确的操作顺序为_______(填字母) 。
A.①②③④ B.②①④③ C.②④①③
(2) 在其它操作均正确的情况下,若在配制溶液过程中,仰视刻度量取蒸馏水,则所配制溶液中,谷氨酸钠的质量分数____(填“偏大”、“偏小”或“无影响”),所测定的味精中NaCI的质量分数___(填“偏大”、“偏小”或“无影响”)。
考查角度3:配制、计算、误差分析的综合考察
例3:(2018?滨州)小芳在配制一定溶质质量分数的氯化钠溶液时,没有按照正确的称量氯化钠。量取水的操作规程进行操作(图示为小芳操作时的读数,其它操作都正确)。小芳实际配制的氯化钠溶液的溶质质量分数(水的密度为1g/cm3)约为( )
A.12.4% B.17.2% C.16.9% D.12.5%
【命题立意】综合考察溶液的溶质质量分数的计算、溶液配制,及引起结果偏大或偏小的原因。
【解答】解:小芳用托盘天平称量时,将药品与砝码的位置放反了,使用的是10g和5g的砝码和2.7g的游码;由左盘的质量=右盘的质量+游码的质量可知:砝码质量=药品质量+游码的质量,所以药品质量=砝码质量﹣游码质量,即药品质量=10g+5g﹣2.7g=12.3g。
量取的水的实际体积为87mL(合87g)。
小芳实际配制的氯化钠溶液的溶质质量分数为×100%≈12.4%。
【答案】A。
【解法指导】1、熟记配制溶液的步骤和仪器即基本操作;2、熟练掌握溶液的计算公式,并能熟练计算。结合溶液的配制过程中的具体操作,分析某具体操作所得溶液中溶质的质量分数。3、知道称量固体、量取液体时错误操作的后果。
☆迁移训练☆
4、(2018?山东泰安)以下是初中化学一些基本实验,请根据实验内容回答下列问题:
(1)利用下图进行粗盐中难溶性杂质去除和配制一定质量分数氯化纳溶液的实验。
①粗盐中难溶性杂质去除的主要操作顺序是_____________(填字母序号);
②配制11%的氯化钠溶液100g。如按下图进行称量和量取,其它操作均规范无误,最终导致配制的氯化钠溶液的溶质质量分数______(填“大于”、“小于”或”不能确定”)11%。
5、(2017·邵阳)某同学配制50g6%氯化钠溶液,整个操作过程如下图所示,回答下列问题:
(1)配制溶液的正确操作顺序为_______(填序号,下同),其中操作错误的是________。
(2)图② 中盛放氯化钠固体的仪器名称是 ______,需称取氯化钠 _______g。
(3)量水时选用的量筒的量程最合适的是______(填序号),读数时视线要与量筒内______保持水平。
A.10 ml B.25 ml C.50ml D.100ml
(4)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是_______(填序号)。
A.氯化钠固体不纯
B.用生锈砝码称量
C.装瓶时有少量溶液洒出
D.溶解时烧杯内壁有水珠
单元复习课
知识体系
专题归纳
专题1:溶液的组成
【专题突破】
【典例精析】
例1: (2018?益阳)如表是NaCl、NH4Cl在不同温度时的溶解度(一定温度下,100g水中溶解的最大量)。
温度/℃
0
20
40
60
80
溶解度/g
NaCl
35.7
36.0
36.6
37.3
38.4
NH4Cl
29.4
37.2
45.8
55.2
65.6
(1)以上两种物质的溶解度受温度影响较大的是 。
(2)40℃时,将40.6gNaCl加入到100g水中,充分搅拌使之溶解,所得溶液的质量为 。
(3)20℃时,NaCl饱和溶液的溶质质量分数为(精确到小数点后1位) 。
【答案】(1)NH4Cl;(2)136.6g;(3)26.5%。
【解答】解:(1)由NaCl、NH4Cl 在不同温度时的溶解度表,两种物质的溶解度受温度影响较大的是NH4Cl。
(2)40℃时,NaCl的溶解度是36.6g,40℃时,将 40.6g NaCl 加入到 100g 水中,充分搅拌使之溶解,最多能溶解36.6g,则所得溶液的质量为36.6g+100g=136.6g。
(3)饱和溶液中溶质质量分数=溶解度
溶解度+100g
×100%,20℃时,NaCl 饱和溶液的溶质质量分数为36.0g
36.0g+100g
×100%≈26.5%。
例2:(2017?沈阳)按下列方法配制的溶液,其溶质质量分数为5%的是( )A.称取5.0g氯化钾,溶解在95mL水中,充分搅拌
B.称取5.0g生石灰,放入95mL水中,充分搅拌
C.量取5.0mL浓盐酸,倒入95mL水中,充分搅拌
D.称取5.0g二氧化锰,放入95mL水中,充分搅拌
【答案】A
【解答】解:A.氯化钾能溶解于水,5.0g氯化钾,溶解在95mL.水中计算溶质质量分数为5g÷(5g+95g)×100% =5%,故正确;
B.生石灰与水反应生成熟石灰,熟石灰微溶于水,故错误;
C.5.0mL浓盐酸是溶液的体积不能得出溶质氯化氢的质量,故不能求得溶质质量分数,故错误;
D.二氧化锰不溶于水,得不到溶液,故错误;
例3:(2018?丽水、金华)12.20℃时,在各盛有100克水的烧杯中,分别加入10克甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。下列说法正确的是( )
A.所得溶液可能都是饱和溶液
B.20℃时,乙溶液的溶质质量最小
C.溶液溶质的质量分数:甲>丙>乙
D.升高温度,溶液溶质的质量分数一定变大
【答案】A
【解析】A.甲和丙中均有不溶解的溶质存在,说明二者均已饱和,根据乙物质没有未溶解的固体,可知乙溶液可能为饱和溶液,也可能为不饱和溶液,故A正确;
B. 20℃时,据图可知,在三个各盛有100g水中,所溶解的三种物质的质量由大到小的顺序为:乙>丙>甲,乙溶液中溶质的质量最大,故B错误;
C. 20℃时,据图可知,在三个各盛有100g水中,所溶解的三种物质的质量由大到小的顺序为:乙>丙>甲,所以三溶液中溶质的质量分数乙>丙>甲,,故C错误;
D.乙物质已经完全溶解在水中,如升高温度可能不会对溶质的质量产生影响,所以乙溶液中溶质的质量分数不一定改变,故D错误。
故选:A。
【迁移训练】
1、(2017?资阳)20℃时,有质量分数为5%的食盐溶液A和质量分数为26.47%的食盐溶液B,下列有关A、B两种食盐溶液的判断正确的是( )
A.向m g溶液B中加入x g食盐,振荡后,溶液的质量不变,则食盐在20℃时的溶解度为36
B.等质量的A、B中,溶剂质量:B>A
C.m g溶液B中的溶质质量为100m/26.47 g
D.向m g溶液A中加入x g食盐,振荡后,溶液的质量>m g
2、(2018?泰州)实验室用氯化钠固体配制50g15%的氯化钠溶液的步骤有:计算、称取氯化钠、量取水、溶解、转移。
①在溶解过程中,玻璃棒的作用是_____________________。
②下列操作中,可能导致配制氯化钠溶液的溶质质量分数偏大的是_______(填序号)。
a.称取时,将氯化钠置于托盘天平的右盘
?b.量取水时俯视读数
?c.用已有少量水的烧杯溶解氯化钠
?d.转移时,有少量溶液溅出
3、(2018湖南省衡阳市,题号10,分值2)实验室配制100g溶质质量分数为8%的氯化钠溶液,下列说法中错误的是( )
A.若在量取水时俯视凹液面的最低处,则配制溶液的质量分数小于8%
B.溶解过程中玻璃棒搅拌的作用是加快氯化钠的溶解速率
C.实验的步骤为计算、称量、量取、溶解、装瓶贴标签
D.量取水时,用规格为l00mL的量筒
4、(2018·雅安)ZnSO4饱和溶液的溶质质量分数随温度变化的曲线如图所示。下列说法正确的是
A. N点对应的ZnSO4溶液升温或降温均都可能析出晶体
B. M点对应的ZnSO4溶液是不饱和溶液
C. ZnSO4饱和溶液的溶质质量分数随温度升高而增大
D. 40℃时,ZnSO4的溶解度为41g
5、(2018?嘉兴)硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是
A. 操作I一定是降温 B. 操作I一定是加溶质
C. ①与③的溶质质量一定相等 D. ②与③的溶质质量分数一定相等
专题2:溶液的配制
【专题突破】
※※ 用浓溶液稀释配制,步骤是:计算、量取、混匀、装瓶贴标签。
例1、(2018·辽阳)小丽在配制一定溶质质量分数的氯化钠溶液时,计算所需氯化钠的质量和水的体积后,进行了如图所示的实验:
请回答:
(1)操作中不规范的步骤是_____(填序号)。
(2)改正后,图示实验中正确的操作顺序是_____(填字号)。
(3)⑤中玻璃棒作用是_____。
(4)小丽发现图示实验操作步骤不完整,应补充的是_____。
【答案】(1)③(2)②①④③⑤(3)搅拌,加速溶解(4)装瓶贴标签
【解析】(1)操作中不规范的步骤是③,在倾倒液体时应沿烧杯壁倒入;
(2)在配制一定溶质质量分数的氯化钠溶液时应先计算,称量食盐,加入到烧杯中,再量取水,倒入烧杯中搅拌溶解,所以正确的操作顺序是:②①④③⑤;
(3)⑤溶解,玻璃棒的作用是搅拌,加速溶解;
(4)小丽发现图示实验操作步骤不完整,应补充的是装瓶贴标签。
【迁移训练】
6、(2018·雅安))味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl,其它成分不考虑。请回答下列问题:
(1)味精中至少含有 (填数字)种元素。
(2)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是 (填字母)。
A.5mL B. 10 mL C. 50 mL D. 100 mL
(3)下图是配制过程,正确的操作顺序为 (填字母) 。
A.①②③④ B.②①④③ C.②④①③
7、(海淀区练习题)20 ℃时氯化钾的溶解度为34g。下列是四位同学在20 ℃时配制的氯化钾溶液,其中一定达到饱和的是( )
A.B.C.D.
8、(2017?成都)根据图示实验,下列说法正确的是
A. 氯化钠溶液不能溶解其他溶质
B. 20ml水中溶解氯化钠的最大质量是定值
C. 加热后溶液中硝酸钾的质量分数变大
D. 加热后硝酸钾溶液是不饱和溶液
思想方法
控制变量原法探究影响溶解速率的因素
内容
探究方法
现象
结论
颗粒大小对溶解速率的影响
取大、中、小三块相同质量的KNO3固体分别放入相同质量的水中
小块KNO3固体首先溶解完
_①______________
水温对溶解速率的影响
_②______________
③_________
④_________
搅拌对溶解速率的影响
⑤_________________
⑥______
⑦__________
突破压轴题
(2017?苏州)探究相同条件下同种溶质在不同溶剂中的溶解性,某兴趣小组同学进行如下两组实验。(提示:本实验所川汽油与KMnO4、碘均不发生化学反应)
【实验l】KMnO4晶体在不同溶剂中的溶解实验
根据实验步骤、实验操作图示填写相关实验现象。
实验步骤
实验操作图示
实验操作及现象
步骤1
振荡后静置:
(1)A试管中晶体全部溶解,溶液呈________色;B试管中晶体不溶解,汽油不变色。
步骤2
将步骤1中A试管内溶液倒人B试管中,振荡后静置:(2)B试管中观察到的现象为__________。
【实验2]碘在不同溶剂中的溶解实验
根据实验操作图示回答相关问题。
实验操作图示
实验结论或解释
(3)由图2所示现象叮知:碘_____(选填“不”、“微”或“易”)溶于水
(4)图3所示试管中液体分层。上层紫红色溶液的名称是________。说明碘在汽油中的溶解性比在水中_____(选填“强”或“弱”)
【反思与应用】
(5)①碘易溶于酒精。若【实验2】中汽油用酒精代替,振荡后静置,最终所得液体______(选填“分层”或“小分层”)。
②“从稀碘水巾提取碘”是“海带提碘”工艺巾的一个重要步骤,其原理类似【实验2]中第二步操作。工业实际生产时使用其他挥发性液体代替汽油,这种挥发性液体必须具备的条件是________。
参考答案与提示
典型例题精析
【迁移训练】
1、【答案】B
【解析】配制20g10%的氯化钠溶液需要氯化钠的质量为20g×10%=2g。A、称氯化钠固体时将氯化钠从试剂瓶中取出时,瓶塞倒放,称量时,使用2g的砝码,天平左右两边各放一张大小相同的干净纸片,正确;B、量取18mL水的体积应使用能一次量取最小规格的量筒,应选用20mL量筒进行量取,错误;C、溶解时使用玻璃棒搅拌,加速氯化钠的溶解,正确;D、装瓶时,瓶塞倒放,用玻璃棒引流,慢慢将配置好的氯化钠溶液注入试剂瓶中,正确。故选B。
2、【答案】A
【解析】此题主要考查的是一定溶质的质量分数溶液的配制。用量筒量取水时俯视读数,会使量取的水体积偏小。
A.用量筒量取水时俯视读数,会使量取的水体积偏小,溶质的质量分数偏大,故说法错误;
B.溶解过程中玻璃棒的作用是搅拌,加快溶解速率,故说法正确;
C.实验室配制一定溶质质量分数的溶液,实验步骤为计算、称量、量取、溶解、装瓶贴标签,故说法正确;
D.本实验中要量取92mL水,应使用规格为l00mL的量筒,故说法正确
3、【答案】 (1). B (2). 偏小
【解析】味精是常用的调味品,化学式是C5H8NO4Na。(1)味精中至少含有碳、氢、氧、氮、钠和氯6种元素。(2)称取5.0g味精配制成50g溶液,根据就近原则,量取蒸馏水的量筒规格是50 mL,故选C。(3)配制过程,正确的操作顺序为②①④③,故选B。(4)测定NaCl在味精中的质量分数。①向所配制的50g溶液中加入AgNO3溶液充分反应,检验沉淀是否完全的方法是:静置后,在上层清液中加入AgNO3溶液,与氯化钠反应生成氯化银白色沉淀,观察是否有沉淀生成。②在配制溶液过程中,仰视刻度量取蒸馏水,读数比实际少,则所配制溶液中,谷氨酸钠的质量分数偏小。
4、【答案】 (1). BDC (2). 小于
【解析】
(1)①粗盐中难溶性杂质去除的主要操作顺序为溶解、过滤、蒸发。故填:BDC;
②如图量取蒸馏水时,仰视读数,会导致量取的水的体积偏大,导致配制的溶液中溶质质量分数小于11%
5、【答案】(1)②①⑤③④ ① (2)广口瓶3或3.0 (3)C 凹液面最低处 (4) AD
【解析】(1)配制溶液的正确操作顺序为计算、称量、溶解、装瓶存放,即②①⑤③
④ ;称量固体时,应遵循左物右码的原则;
(2)图②中盛放氯化钠固体的仪器名称是广口瓶,氯化钠的质量是50g×6%=3g (3)取水的量为47mL,所以应用50mL的量筒;量取液体视线应平视凹液面最低处 (4) 配制的溶液溶质质量分数偏小的原因是溶质偏少或者溶剂偏多。氯化钠固体不纯,导致氯化钠偏少;溶解时烧杯内壁有水珠,导致水的量偏多。
单元复习课
【迁移训练】
1、【答案】D。
【解答】解:A、向mg溶液B中加入xg食盐,振荡后,溶液的质量不变,则食盐在20℃时的溶解度为36g,不是36;故选项错误;
B、等质量的A、B中,溶剂质量:B<A,B>A错误;故选项错误;
C、mg溶液B中的溶质质量为26.47m/100g,100m/26.47g错误;故选项错误;
D、向mg溶液A中加入xg食盐,振荡后,溶液的质量>mg正确,因为mg溶液中又溶解了食盐;故选项正确;
2、【答案】 (1).搅拌加速溶解 (2). b
【解析】(1).实验室用氯化钠固体配制50g15%的氯化钠溶液的步骤有:计算、称取氯化钠、量取水、溶解、转移。①在溶解过程中,玻璃棒的作用是搅拌加速溶解速率。②可能导致配制氯化钠溶液的溶质质量分数偏大的是b,量筒俯视读数比实际大。
3、【答案】A
【解析】此题主要考查的是一定溶质的质量分数溶液的配制。用量筒量取水时俯视读数,会使量取的水体积偏小。
A.用量筒量取水时俯视读数,会使量取的水体积偏小,溶质的质量分数偏大,故说法错误;
B.溶解过程中玻璃棒的作用是搅拌,加快溶解速率,故说法正确;
C.实验室配制一定溶质质量分数的溶液,实验步骤为计算、称量、量取、溶解、装瓶贴标签,故说法正确;
D.本实验中要量取92mL水,应使用规格为l00mL的量筒,故说法正确。
4、【答案】A
【解析】根据硫酸锌的饱和溶液的溶质质量分数随温度变化的曲线可知,在0°到70°之间,硫酸锌饱和溶液的溶质质量分数随温度的升高而增大,所以它的溶解能力(溶解度)随温度的升高而增大,在70°时,溶解度是最大的;大于70°时,硫酸锌饱和溶液的溶质质量分数随温度的升高而降低,所以硫酸锌的溶解度随着温度的升高而降低。
A.根据曲线分析可知,硫酸锌的溶质质量分数先升高后降低,70°时硫酸锌的溶解度最大(70°为拐点),大于70°或者小于70°,硫酸锌的溶质质量分数都会减小,所以 N点对应的ZnSO4溶液升温或降温均都可能析出晶体,这个说法是正确的,所以A正确;
B.M点是硫酸锌的饱和溶液的溶质质量分数随温度变化的曲线上的点,所以M点对应的ZnSO4溶液是饱和溶液,所以B错误;
C.根据曲线分析可知,硫酸锌的溶质质量分数随温度先升高后降低,70°时硫酸锌的溶解度最大(70°为拐点)。在0°到70°之间,ZnSO4饱和溶液的溶质质量分数随温度升高而升高;大于70°时,ZnSO4饱和溶液会有晶体析出,溶质的质量分数随温度升高而降低,所以C错误;
D.根据曲线分析可知,40℃时,ZnSO4饱和溶液的溶质质量分数为41%,并不是溶解度是41g,,所以D错误。
5、【答案】D
【解析】A.饱和溶液是:在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。要使固体物质的不饱和溶液变为饱和溶液,常用方法有:增加溶质、减少溶剂、降低温度。所以操作I不一定是降温,错误;B. 操作I不一定是加溶质,错误;C.被溶解的物质叫溶质, ①至③的过程中有固体析出,溶质质量减少,①比③的溶质多,错误; D. ,②与③是同种物质在同种溶剂、同一温度下的饱和溶液,溶质质量分数一定相等,正确。故选D。
6、【答案】(1) 5;(2) C;(3) B;
【解析】(1) “谷氨酸钠”化学式是C5H8NO4Na,有5种元素组成;
(2)称取5.0g味精配制成50g溶液,需要水的质量为50g-5g=45g,体积是45.0mL,实验中应根据所取溶液的体积,尽可能选用一次量取的最小规格的量筒,量取45.0mL蒸馏水最好选用50mL的量筒,所以本题填C;
(3)配置溶液的正确顺序是1.称量;2.把固体倒入容器内;3. 把水倒入容器内4.搅拌,所以②①④③是正确的,本题填B;
7、【答案】B
【解析】A、20℃时氯化钾的溶解度为34g,含义是20℃时,100g水中最多能溶解氯化钾34g,溶液达到饱和状态,则20℃时,50g水中最多能溶解氯化钾17g,溶液达到饱和状态,向50g水中加入10g氯化钾,所得溶液是不饱和溶液,错误;B、20℃时氯化钾的溶解度为34g,含义是20℃时,100g水中最多能溶解氯化钾34g,溶液达到饱和状态,则20℃时,50g水中最多能溶解氯化钾17g,溶液达到饱和状态,向50g水中加入17g氯化钾,所得溶液是恰好是饱和溶液,正确;C、20℃时氯化钾的溶解度为34g,含义是20℃时,100g水中最多能溶解氯化钾34g,溶液达到饱和状态,20℃时,向100g水中加入20g氯化钾,所得溶液是不饱和溶液,错误;D、20℃时氯化钾的溶解度为34g,含义是20℃时,100g水中最多能溶解氯化钾34g,溶液达到饱和状态,20℃时,向100g水中加入33g氯化钾,所得溶液是不饱和溶液,错误。故选B。
8、【答案】C
【解析】A、饱和溶液只对某种溶质而言是饱和的,而对于其他的物质是不饱和的,故氯化钠溶液可以溶解其他的物质,故错误;
B、20ml水中溶解氯化钠的最大质量与溶液的温度有关,故不是定值,错误;
C、加热后溶液中水蒸发,故硝酸钾的质量分数变大,正确;
D、加热后硝酸钾溶液中的水蒸发,溶液变为饱和溶液,错误。故选C。
思想方法
【答案】①固体物质颗粒越小溶解速率越快
②取两份大小、质量相同的KNO3固体,分别放入盛有同量水的烧杯中,给其中一只烧杯加热,一只静置,均不搅拌
③加热的烧杯中KNO3固体先溶解完
④加热可以加速物质的溶解速率
⑤取两份大小、质量相同的KNO3固体,分别放入盛有同质量同温度水的烧杯中,其中一只烧杯用玻璃棒搅拌 ⑥用玻璃棒搅拌烧杯中KNO3固体先溶解完
⑦搅拌可以加速物质的溶解速率
【解析】根据只要能改变固体与水的接触就能改变固体的溶解速率分析解答。颗粒大小对溶解速率的影响:根据小块KNO3固体首先溶解完得出的结论是固体物质颗粒越小溶解速率越快;水温对溶解速率的影响:探究方法是取两份大小、质量相同的KNO3固体,分别放入盛有同量水的烧杯中,给其中一只烧杯加热,一只静置,均不搅拌;现象是加热的烧杯中KNO3固体先溶解完;结论是加热可以加速物质的溶解速率;搅拌对溶解速率的影响:探究方法是取两份大小、质量相同的KNO3固体,分别放入盛有同质量同温度水的烧杯中,其中一只烧杯用玻璃棒搅拌;现象是用玻璃棒搅拌烧杯中KNO3固体先溶解完;结论是搅拌可以加速物质的溶解速率。
突破压轴题
【答案】(1)紫(紫红、红)
(2)液体分层,上层为无色,下层为紫红色,试管底部无固体残留
(3)微(4)碘的汽油溶液强(5)①不分层 ②与水不互溶,碘在这种液体中的溶解度远大于在水中的溶解度
【解析】(1)高锰酸钾能溶解在水中形成紫红色的溶液;将高锰酸钾溶液倒入汽油中,B试管中的高锰酸钾会溶解在水中,且还会发生分层现象,即液体分层,上层为无色,下层为紫红色,试管底部无固体残留;(3)由图可知,加入水后变成了淡黄色,故碘微溶与水;(4)碘微溶于水,但能溶解在汽油中形成碘的汽油溶液;(5)①汽油和酒精均属有机溶剂,有机物能溶解在有机溶剂中,即碘能溶解在酒精中形成碘酒溶液,故若【实验2】中汽油用酒精代替,振荡后静置,最终所得液体不分层;②“从稀碘水巾提取碘”,使用其他挥发性液体代替汽油,这种挥发性液体必须与水不互溶,碘在这种液体中的溶解能力远大于在水中的溶解能力
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
