1.2.2 元素周期表和元素周期律的应用
文档属性
| 名称 | 1.2.2 元素周期表和元素周期律的应用 |  | |
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-14 11:53:17 | ||
图片预览




文档简介
第二节 元素周期律
1.2.2元素周期表和元素周期律的应用
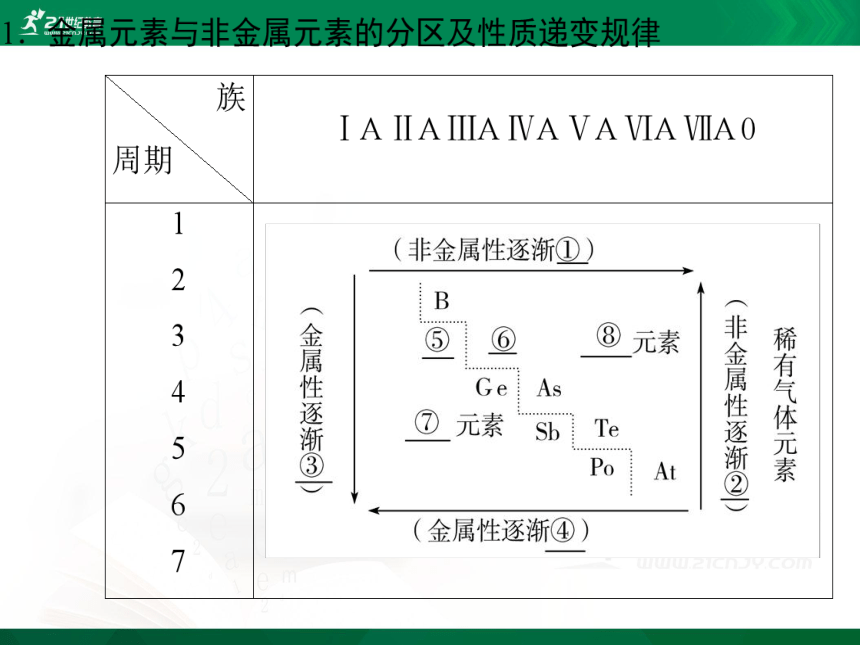
(1)金属元素与非金属元素的分区及性质递变:
请填写出图中序号所示内容:
① ② ③ ④ ---
⑤ ⑥ ⑦ ⑧ ---
(2)第2、3、4、5、6周期除过渡元素外,依次有 、 、 、 、 种金属元素,有 、 、 、 、 种非金属元素(含稀有气体)。
(3)分界线附近元素的性质:既表现出 元素的性质,又表现出 元素的性质。
增强
增强
增强
增强
Al
Si
金属
非金属
2
3
4
5
6
6
5
4
3
2
金属
非金属
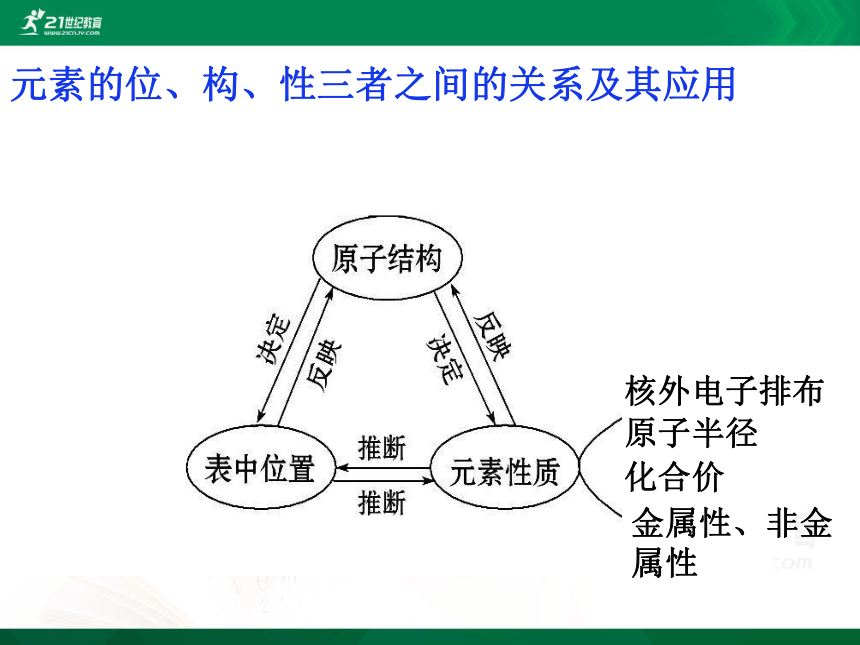
你能理解“位(位置)——构(结构)——性(性质)”三者之间的关系吗?
思考与交流
元素的位、构、性三者之间的关系及其应用
核外电子排布
原子半径
化合价
金属性、非金属性
具体表现为
(1).结构与位置的关系:
(2).结构与性质的关系:
电子层数=周期序数
最外层电子数=主族序数
结构 位置
最外层电子数越少
电子层数越大
最外层电子数越多
电子层数越少
结构
越易失电子
还原性越强
越易得电子
氧化性越强
性质
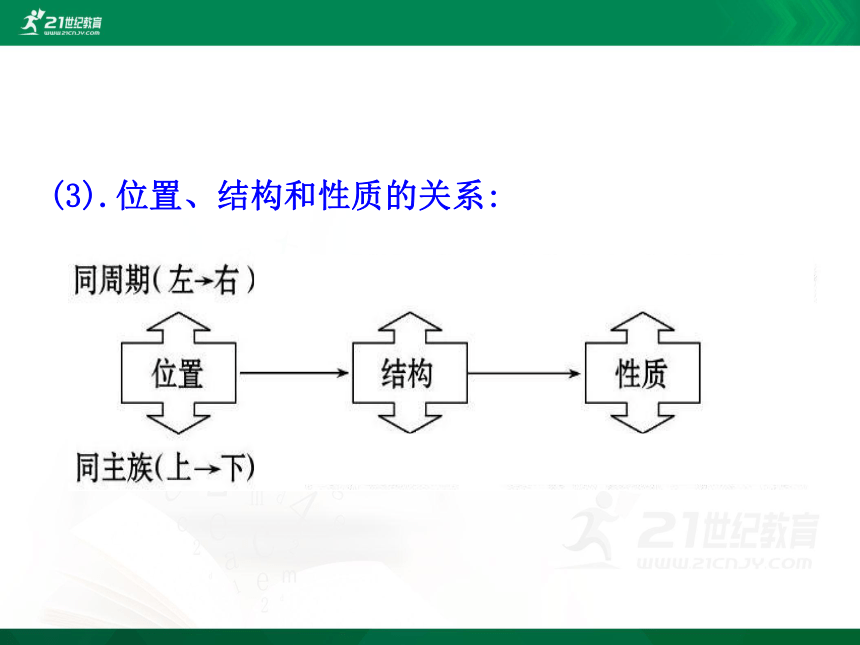
(3).位置、结构和性质的关系:
原子半径依次减小
原子半径依次减小
原子半径依次增大
原子半径依次增大
失电子能力依次增强
失电子能力依次增强
非金属性依次增强
得电子能力依次增强
得电子能力依次增强
非金属性依次增强
金属性依次增强
金属性依次增强
1.什么元素(放射性元素除外)的金属性最强?什么元素的非金属性最强?分别位于元素周期表的什么位置?
思考感悟
2.元素的化合价和位置、结构有什么关系?
①根据同周期、同主族元素性质的递变规律可推知:金属性最强的元素是铯(Cs),位于第六周期第ⅠA族(左下角),非金属性最强的元素是氟(F),位于第二周期第ⅦA族(右上角)。
②位于分界线附近的元素既有一定的金属性,又有一定的非金属性,如Be、Al、Si、Ge等。
2、元素的化合价与位置、结构的关系
(1)最高正价数=主族序数=最外层电子数(O、F无正价)
(2)最低负价=主族序数 - 8
=最外层电子数 - 8
(2)根据元素的原子结构推测它在周期表中的位置。
(1)根据元素在周期表中的位置可推测元素的原子结构和性质
(3)指导新元素的发现及推测它们的原子结构和性质。
3、元素周期律的应用和意义
(4)指导其他与化学相关的科学技术,如在周期表中金属和非金属的分界处,可以找到半导体材料如Ge、Si、Ga、Se等。。从ⅢB到ⅥB的过渡元素中寻找催化剂(如铁、镍)和耐高温、耐腐蚀的合金材料(如钛、钽、钼、钨、铬)。
题1:X、Y两元素处于同一主族相邻周期,则X、Y两元素的原子序数相差不可能为下列哪一数值
( )
A.2 B.8 C.10 D.18
题2:第114号元素是化学家和物理学家很感兴趣的元素,试推测此元素在周期表中的位置 ( )
A.第八周期ⅢA族 B.第六周期ⅤA族
C.第七周期ⅣB族 D.第七周期ⅣA族
例题选讲
1.主族元素的最高正化合价一般等于其_____序数,非金属元素的负化合价等于_____________________。
2.卤族元素的原子最外层上的电子数是____,其中,非金属性最强的是____。卤素的最高价氧化物对应水化物的化学式是______(以X表示卤素)。
主族
8-主族序数(8-最高正价)
7
F
HXO
注:氟元素无最高价氧化物及其水合物,因为氟元素无正化合价
课堂练习
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
1.2.2元素周期表和元素周期律的应用
(1)金属元素与非金属元素的分区及性质递变:
请填写出图中序号所示内容:
① ② ③ ④ ---
⑤ ⑥ ⑦ ⑧ ---
(2)第2、3、4、5、6周期除过渡元素外,依次有 、 、 、 、 种金属元素,有 、 、 、 、 种非金属元素(含稀有气体)。
(3)分界线附近元素的性质:既表现出 元素的性质,又表现出 元素的性质。
增强
增强
增强
增强
Al
Si
金属
非金属
2
3
4
5
6
6
5
4
3
2
金属
非金属
你能理解“位(位置)——构(结构)——性(性质)”三者之间的关系吗?
思考与交流
元素的位、构、性三者之间的关系及其应用
核外电子排布
原子半径
化合价
金属性、非金属性
具体表现为
(1).结构与位置的关系:
(2).结构与性质的关系:
电子层数=周期序数
最外层电子数=主族序数
结构 位置
最外层电子数越少
电子层数越大
最外层电子数越多
电子层数越少
结构
越易失电子
还原性越强
越易得电子
氧化性越强
性质
(3).位置、结构和性质的关系:
原子半径依次减小
原子半径依次减小
原子半径依次增大
原子半径依次增大
失电子能力依次增强
失电子能力依次增强
非金属性依次增强
得电子能力依次增强
得电子能力依次增强
非金属性依次增强
金属性依次增强
金属性依次增强
1.什么元素(放射性元素除外)的金属性最强?什么元素的非金属性最强?分别位于元素周期表的什么位置?
思考感悟
2.元素的化合价和位置、结构有什么关系?
①根据同周期、同主族元素性质的递变规律可推知:金属性最强的元素是铯(Cs),位于第六周期第ⅠA族(左下角),非金属性最强的元素是氟(F),位于第二周期第ⅦA族(右上角)。
②位于分界线附近的元素既有一定的金属性,又有一定的非金属性,如Be、Al、Si、Ge等。
2、元素的化合价与位置、结构的关系
(1)最高正价数=主族序数=最外层电子数(O、F无正价)
(2)最低负价=主族序数 - 8
=最外层电子数 - 8
(2)根据元素的原子结构推测它在周期表中的位置。
(1)根据元素在周期表中的位置可推测元素的原子结构和性质
(3)指导新元素的发现及推测它们的原子结构和性质。
3、元素周期律的应用和意义
(4)指导其他与化学相关的科学技术,如在周期表中金属和非金属的分界处,可以找到半导体材料如Ge、Si、Ga、Se等。。从ⅢB到ⅥB的过渡元素中寻找催化剂(如铁、镍)和耐高温、耐腐蚀的合金材料(如钛、钽、钼、钨、铬)。
题1:X、Y两元素处于同一主族相邻周期,则X、Y两元素的原子序数相差不可能为下列哪一数值
( )
A.2 B.8 C.10 D.18
题2:第114号元素是化学家和物理学家很感兴趣的元素,试推测此元素在周期表中的位置 ( )
A.第八周期ⅢA族 B.第六周期ⅤA族
C.第七周期ⅣB族 D.第七周期ⅣA族
例题选讲
1.主族元素的最高正化合价一般等于其_____序数,非金属元素的负化合价等于_____________________。
2.卤族元素的原子最外层上的电子数是____,其中,非金属性最强的是____。卤素的最高价氧化物对应水化物的化学式是______(以X表示卤素)。
主族
8-主族序数(8-最高正价)
7
F
HXO
注:氟元素无最高价氧化物及其水合物,因为氟元素无正化合价
课堂练习
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
