2019年中考科学复习-化学-4、化学综合实验
文档属性
| 名称 | 2019年中考科学复习-化学-4、化学综合实验 |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-03-13 21:56:55 | ||
图片预览

文档简介
浙教版中考复习化学-4、化学综合实验
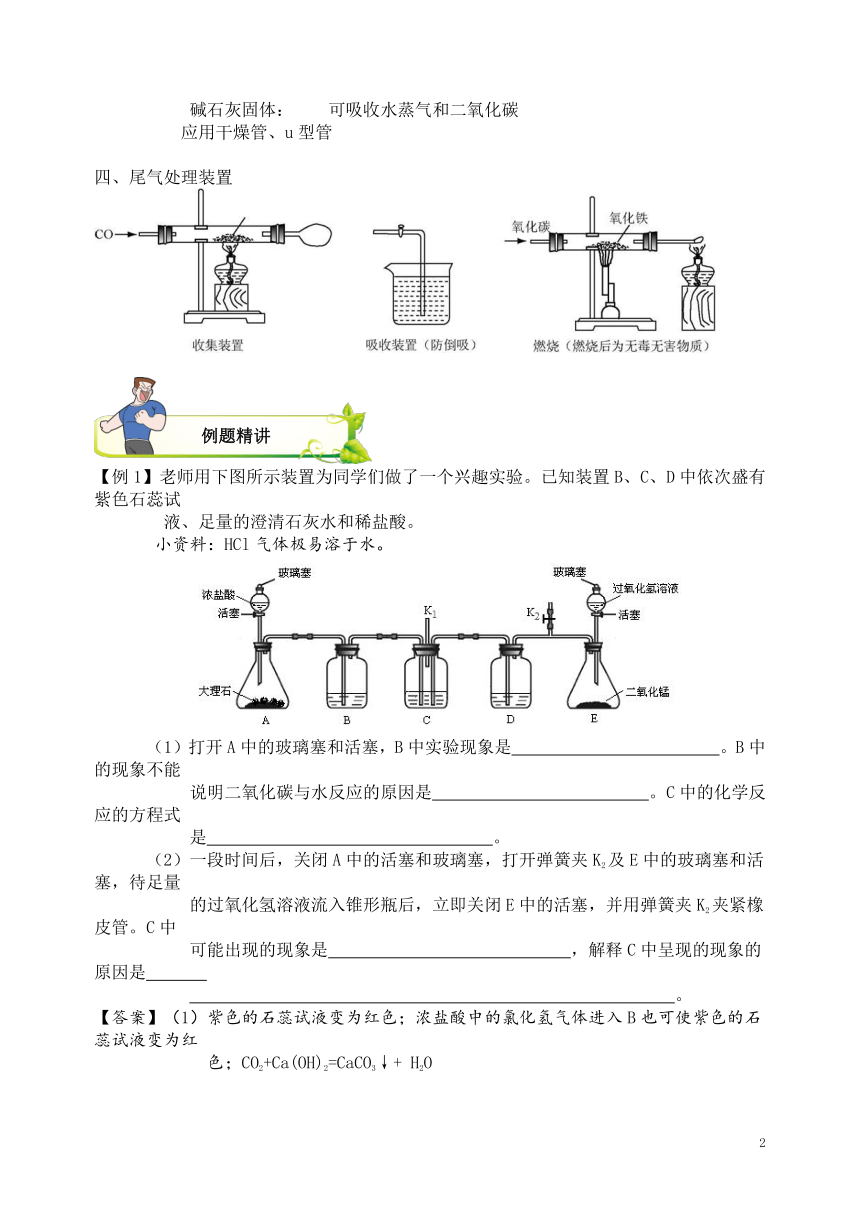
初中化学实验几大装置
一、气体的发生装置 二、气体的收集装置
固体加热型 固液常温型 排水法 向上排空气法 向下排空气法
三、除杂装置
主要作用检验二氧化碳
Ca(OH)2溶液 可除去少量的二氧化碳
应用洗气瓶 检验二氧化碳是否完全除尽
主要作用吸收二氧化碳
NaOH溶液
应用洗气瓶 可检验二氧化碳(测溶液质量的变化)
主要作用吸收水蒸气
浓硫酸
应用洗气瓶 可检验水蒸气(测溶液质量变化)
主要作用检验水蒸气
无水硫酸铜固体 可吸收少量的水蒸气
应用干燥管、u型管 检验水蒸气是否完全除尽
碱石灰固体: 可吸收水蒸气和二氧化碳
应用干燥管、u型管
四、尾气处理装置
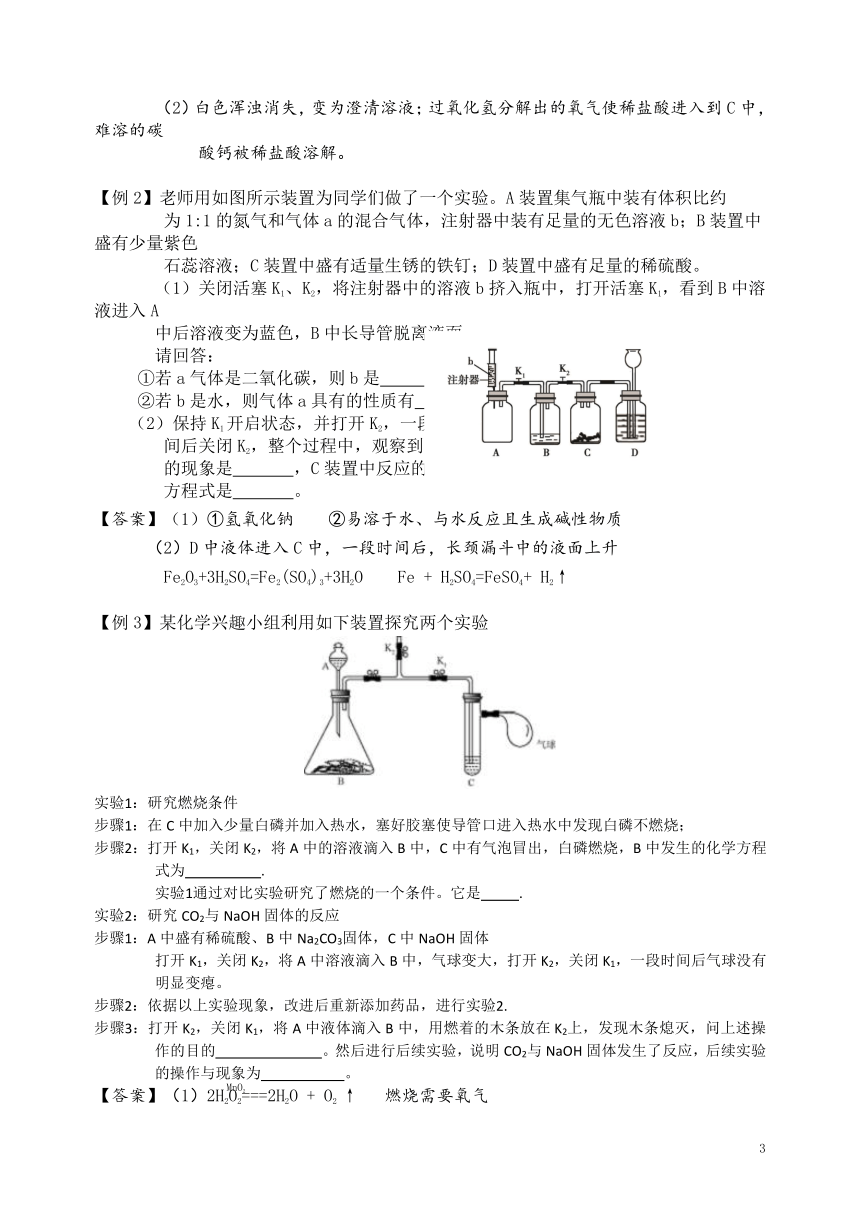
【例1】老师用下图所示装置为同学们做了一个兴趣实验。已知装置B、C、D中依次盛有紫色石蕊试
液、足量的澄清石灰水和稀盐酸。
小资料:HCl气体极易溶于水。
(1)打开A中的玻璃塞和活塞,B中实验现象是 。B中的现象不能
说明二氧化碳与水反应的原因是 。C中的化学反应的方程式
是 。
(2)一段时间后,关闭A中的活塞和玻璃塞,打开弹簧夹K2及E中的玻璃塞和活塞,待足量
的过氧化氢溶液流入锥形瓶后,立即关闭E中的活塞,并用弹簧夹K2夹紧橡皮管。C中
可能出现的现象是 ,解释C中呈现的现象的原因是
。
【答案】(1)紫色的石蕊试液变为红色;浓盐酸中的氯化氢气体进入B也可使紫色的石蕊试液变为红
色;CO2+Ca(OH)2=CaCO3↓+ H2O
(2)白色浑浊消失,变为澄清溶液;过氧化氢分解出的氧气使稀盐酸进入到C中,难溶的碳
酸钙被稀盐酸溶解。
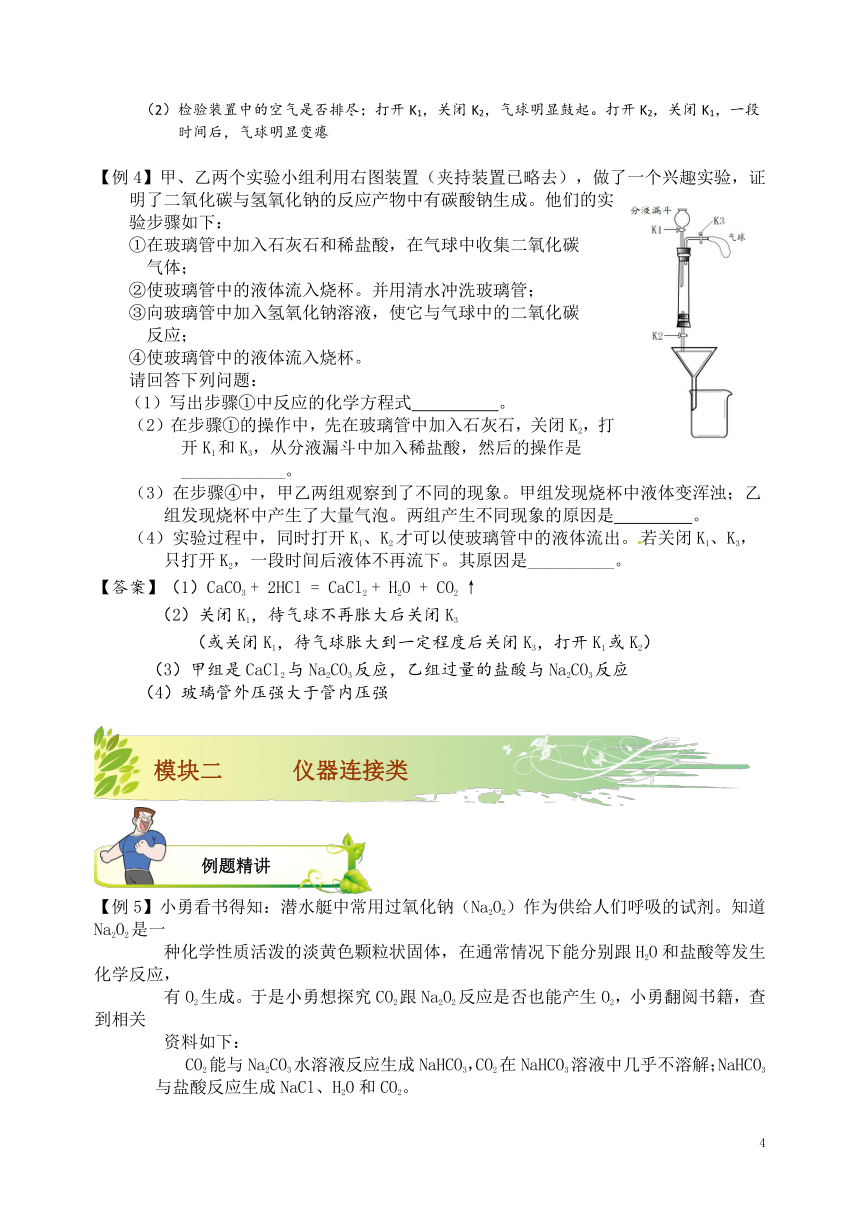
【例2】老师用如图所示装置为同学们做了一个实验。A装置集气瓶中装有体积比约
为1:1的氮气和气体a的混合气体,注射器中装有足量的无色溶液b;B装置中盛有少量紫色
石蕊溶液;C装置中盛有适量生锈的铁钉;D装置中盛有足量的稀硫酸。
(1)关闭活塞K1、K2,将注射器中的溶液b挤入瓶中,打开活塞K1,看到B中溶液进入A
中后溶液变为蓝色,B中长导管脱离液面。
请回答:
①若a气体是二氧化碳,则b是 溶液。
②若b是水,则气体a具有的性质有 。
(2)保持K1开启状态,并打开K2,一段时
间后关闭K2,整个过程中,观察到D中
的现象是 ,C装置中反应的化学
方程式是 。
【答案】(1)①氢氧化钠 ②易溶于水、与水反应且生成碱性物质
(2)D中液体进入C中,一段时间后,长颈漏斗中的液面上升
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O Fe + H2SO4=FeSO4+ H2↑
【例3】某化学兴趣小组利用如下装置探究两个实验
实验1:研究燃烧条件
步骤1:在C中加入少量白磷并加入热水,塞好胶塞使导管口进入热水中发现白磷不燃烧;
步骤2:打开K1,关闭K2,将A中的溶液滴入B中,C中有气泡冒出,白磷燃烧,B中发生的化学方程式为 .
实验1通过对比实验研究了燃烧的一个条件。它是 .
实验2:研究CO2与NaOH固体的反应
步骤1:A中盛有稀硫酸、B中Na2CO3固体,C中NaOH固体
打开K1,关闭K2,将A中溶液滴入B中,气球变大,打开K2,关闭K1,一段时间后气球没有明显变瘪。
步骤2:依据以上实验现象,改进后重新添加药品,进行实验2.
步骤3:打开K2,关闭K1,将A中液体滴入B中,用燃着的木条放在K2上,发现木条熄灭,问上述操作的目的 。然后进行后续实验,说明CO2与NaOH固体发生了反应,后续实验的操作与现象为 。
【答案】(1)2H2O2===2H2O + O2 ↑ 燃烧需要氧气
(2)检验装置中的空气是否排尽;打开K1,关闭K2,气球明显鼓起。打开K2,关闭K1,一段
时间后,气球明显变瘪
【例4】甲、乙两个实验小组利用右图装置(夹持装置已略去),做了一个兴趣实验,证明了二氧化碳与氢氧化钠的反应产物中有碳酸钠生成。他们的实验步骤如下:
①在玻璃管中加入石灰石和稀盐酸,在气球中收集二氧化碳
气体;
②使玻璃管中的液体流入烧杯。并用清水冲洗玻璃管;
③向玻璃管中加入氢氧化钠溶液,使它与气球中的二氧化碳
反应;
④使玻璃管中的液体流入烧杯。
请回答下列问题:
(1)写出步骤①中反应的化学方程式 。
(2)在步骤①的操作中,先在玻璃管中加入石灰石,关闭K2,打开K1和K3,从分液漏斗中加入稀盐酸,然后的操作是____________。
(3)在步骤④中,甲乙两组观察到了不同的现象。甲组发现烧杯中液体变浑浊;乙组发现烧杯中产生了大量气泡。两组产生不同现象的原因是 。
(4)实验过程中,同时打开K1、K2才可以使玻璃管中的液体流出。若关闭K1、K3,只打开K2,一段时间后液体不再流下。其原因是__________。
【答案】(1)CaCO3 + 2HCl = CaCl2 + H2O + CO2 ↑
(2)关闭K1,待气球不再胀大后关闭K3
(或关闭K1,待气球胀大到一定程度后关闭K3,打开K1或K2)
(3)甲组是CaCl2与Na2CO3反应,乙组过量的盐酸与Na2CO3反应
(4)玻璃管外压强大于管内压强
【例5】小勇看书得知:潜水艇中常用过氧化钠(Na2O2)作为供给人们呼吸的试剂。知道Na2O2是一
种化学性质活泼的淡黄色颗粒状固体,在通常情况下能分别跟H2O和盐酸等发生化学反应,
有O2生成。于是小勇想探究CO2跟Na2O2反应是否也能产生O2,小勇翻阅书籍,查到相关
资料如下:
CO2能与Na2CO3水溶液反应生成NaHCO3,CO2在NaHCO3溶液中几乎不溶解;NaHCO3与盐酸反应生成NaCl、H2O和CO2。
并设计了实验方案:①用石灰石和浓盐酸制取二氧化碳;②将纯净、干燥的二氧化碳通过过氧化钠(Na2O2)粉末;③验证产生的气体中是否含有O2;在实验室中准备了如下图所示的装置,请你一起参与完成:
SHAPE \* MERGEFORMAT
(1)欲得到纯净干燥的二氧化碳应选择 装置,所发生反应的化学方程式为 。
(2)完成整个实验的装置接口顺序是 。
(3)G洗气瓶中应盛放 ,作用是 。(用化学方程式回答)
(4)为确证是否有氧气生成,还应进行的实验是 。
【答案】(1)BDE, CaCO3 + 2HCl = CaCl2 + H2O + CO2 ↑ NaHCO3 + HCl = NaCl + H2O + CO2↑(2)②⑥⑤⑧⑦⑨(3)NaOH浓溶液,2NaOH+CO2=Na2CO3+H2O
(4)将带火星的木条接近a导管口处,若复燃,则说明有氧气生成。反之,则无。
【例6】正确连接如下图所示的装置进行实验,可以验证mg某混合气体的成分是CO2 、H2O和CO,
并粗略测出每种气体的质量(每套装置限用一次)。
请回答下列问题:
(1)连接导管口(①-⑩)顺序:混合气体→ →尾气处理。
(2)证明原混合气体中CO存在的实验现象是 ;证明CO存
在的有关反应的化学方程式 、 。
(3)欲粗略测得二氧化碳的质量应进行的操作是 。
【答案】(1)⑨⑩⑧⑦④③⑤⑥①②(2)A中红色粉末变黑,澄清石灰水变浑浊
3CO+Fe2O3高温2Fe+3CO2 CO2+Ca(OH)2=CaCO3↓+H2O
(3)实验前称量装置B、C的总质量,实验后再称量B、C的总质量,计算实验前后B、
C总质量的变化值(或差值)
【例7】小组同学用下图所示的装置进行了两组兴趣实验(a、b管的体积相等,夹持
装置已略去)。
【资料】(1)白磷的着火点为40℃,红磷的着火点为240℃
(2)2NaOH + MgCl2 = Mg(OH)2↓ + 2NaCl
(1)如图1所示进行实验。关闭K,向烧杯中注入一定量的90℃的热水至图中虚线处。一段时间后,观察到a管中的现象是 。其中发生反应的化学方程式是 。对比a、b管中的实验现象,可得出燃烧的条件是 。
(2)如图2所示进行实验。关闭K,分别用排水集气法收集体积的氢气于两管中。再将镁条和大理石分别置于a、b管口内,向烧杯内逐滴加入浓盐酸,a、b管内均有气泡产生,其中a管反应的化学方程式是 。待两管内液体恰好全部排出后,向烧杯中加入过量的浓氢氧化钠溶液,溶液变浑浊。一段时间后,打开K,此时观察到a、b管中的现象是 。
【答案】(1)白磷燃烧产生白烟,a管中液面上升 4P + 5O2 2P2O5
温度要达到可燃物的着火点
(2)Mg + 2HCl = MgCl2+ H2↑ a管内液面上升,b管内液面下降,最终相平,达到距管口
约处。
【例8】兴趣小组根据老师提供的实验装置进行如下实验。(试剂均足量,假设各步反应均完全,装置可重复使用,部分夹持装置已省略,组合装置气密性良好。)
(1)甲组同学利用A中产生的氧气验证B中的黑色粉末是炭粉。
① A中反应的化学方程式是 。
② 为完成此实验,除用装置A、B外,还需要补充的装置有 (填装置序号)。
③ 说明黑色粉末是炭粉的反应的化学方程式是 。
(2)A中烧瓶内的气体可能含有CO、CO2、CH4中的一种或几种,为确定烧瓶内气体的成分,乙组同学进行如下实验:
【资料】甲烷和氧化铜反应的化学方程式为:CH4 + 4CuO 4Cu + CO2 + 2H2O
I. 将3.0 g的浓氢氧化钠溶液滴入烧瓶中,充分反应;
II.按A→C→B→C→D的顺序连接装置,打开K1,从K1处通入氮气,打开K2,排尽B中空气,加热B中足量的氧化铜固体,充分反应;
III.反应结束后,测得烧瓶中溶液的质量为3.1 g,B中固体的质量减少了0.32 g,
第二个C装置的质量增加了0.18 g。
① 打开K2前通入氮气的目的是 。
② 两个装置C中试剂相同,装置C中的试剂名称是 。
③ 烧瓶中气体的成分是 。
【答案】
(1)①2H2O2 2H2O + O2↑ ②CD
③C + O2 CO2 Ca(OH)2+ CO2 = CaCO3↓+ H2O
(2)①防止倒吸 ②浓硫酸 ③ CO2 和CH4
【例9】某化学研究性学习小组的同学们做了三个趣味实验,装置如右图(气密性良好)。当开启分液
漏斗的旋塞,液体滴入盛有固体的试管2中时,观察到不同的现象。
(1)若试管2中发生了化学反应,观察到试管1中有气泡产
生,且其中的石蕊溶液变红,试管2中发生反应的化学
方程式为 。
(2)若试管2中没有发生化学反应,观察到两支导管口同时冒气泡、
吸滤瓶内的石灰水变浑浊,则试管2中的固体可能是________。
(3)若观察到吸滤瓶内盛有的红色溶液变无色,分液漏斗中的液体、试管2中的固体分别是____________;烧杯中的液体可能是__________。请你解释溶液变色的原因:_________。
【答案】(1)CaCO3 + 2HCl =CaCl 2+ H2O + CO2↑(碳酸盐与酸反应生成二氧化碳即可)
(2)NaOH (烧碱、氢氧化钠固体)
(3)水、硝酸铵(或干冰、冰) 酸。
试管2中的固体溶解(或与液体反应)时吸收热量,使吸滤瓶中的压强减小,烧杯中的酸倒吸入锥形瓶中,与锥形瓶中碱性物质发生反应,使红色溶液变无色。
(1.说出试管2中降温;2.说出吸滤瓶中压强减小;3.酸中和掉碱性)
【例10】小刚和小丽两位同学用下图所示装置进行实验,制取二氧化碳并验证其与氢氧化钠能发生反应。
(1)小刚先关闭b,打开a、c、d,集气瓶中生成CO2的反应方程式为 ,NaOH与CO2的反应方程式为 ;此时没有观察到明显现象。
(2)小丽认为若要证明NaOH与CO2发生反应,接下来的操作是关闭 ,打开 ,此时应观察到的现象为 。
【答案】
(1)CaCO3+2HCl=CaCl2 + H2O +CO2 ↑
2NaOH +CO2 = Na2CO3 + H2O
(2) c、d,b,锥形瓶内的液体被压入石灰水中,石灰水变浑浊
【练习1】化学小组的同学探究二氧化碳与氢氧化钠的反应,实验方案如下:
实验装置 实验步骤及操作 实验现象
①将注射器1中的溶液推入充有的瓶中 气球鼓起
②…… 无明显现象
③将注射器2中的溶液推入瓶中 溶液中有气泡产生,气球变瘪
④向外拉注射器3 澄清石灰水变浑浊
(1)步骤①中气球鼓起的原因可能是 。
(2)步骤②中的操作是 ,其目的是 。
(3)步骤④中发生反应的化学方程式为 。
(4)本实验的结论是 。
【答案】
(1)NaOH溶液吸收CO2装置内压强变小,气球鼓起;
(2)向外拉注射器1,证明步骤1中装置内的CO2已被完全吸收;
(3)CO2+Ca(OH)2 = CaCO3↓+H2O
(4)CO2能和NaOH反应
【练习2】用如右图所示装置分别进行两个实验(已知:氯化钙溶液呈中性)。
(1)打开止水夹,向Ⅰ中液体加入一种黑色固体、Ⅱ中液体加入一种白色固体。
Ⅰ和Ⅱ中均有气泡出现,且Ⅱ中液体内出现燃烧现象。
①写出燃烧反应的化学方程式________。
②请说明Ⅱ中出现燃烧的原因________。
(2)打开止水夹,向Ⅰ中液体加入一小块固体。Ⅰ和Ⅱ中均有气泡出现,且Ⅱ中液体出现浑浊现象。关闭止水夹,发现Ⅱ中液面上升,溶液由浑浊变澄清。
①请说明溶液由浑浊变澄清的原因________。
②若实验后Ⅱ中澄清液中的溶质由一种或两种物质组成,为检验其成分,应该进行的实验操作是________。
【答案】
(1)① 4P + 5O2 点燃 2P2O5
② 白色固体(白磷)是可燃物,与氧气接触并达到着火点
(2)① Ⅰ中盐酸进入Ⅱ中将碳酸钙完全反应
② 取Ⅱ中的澄清液于试管中,向其中滴加紫色石蕊溶液
模块一 压强类
例题精讲
MnO2
模块二 仪器连接类
例题精讲
分液漏斗
活塞
①
F
浓硫酸
碳酸钠溶液
碳酸氢钠溶液
A
B
C
E
D
G
a
②
③
④
⑤
⑥
⑦
⑧
⑨
温馨小提示
1.通常情况下CO与酸、碱、盐溶液均不反应。
2.无水硫酸铜是白色固体,遇到水蒸气变成蓝色晶体。
模块三 其他
a
b
图2
K
1
2
1
2
图1
a
b
K
白磷
红磷
铜
铜
△
分液漏斗
K2
K1
烧瓶
A B C D
△
点燃
复习巩固
1
